DNAJB6b通過激活AKT通路增強結直腸癌細胞的侵襲遷移能力
陳丁雄,朱依青,史建紅,蔡 巖,郝佳潔,王明榮,梁建偉,張 鈺,*
(1.國家癌癥中心/國家腫瘤臨床醫學研究中心/中國醫學科學院北京協和醫學院腫瘤醫院,分子腫瘤學國家重點實驗室,北京 100021;2.國家癌癥中心/國家腫瘤臨床醫學研究中心/中國醫學科學院北京協和醫學院腫瘤醫院,結直腸外科,北京 100021)
結直腸癌(colorectal cancer,CRC)是影響人類健康的常見惡性腫瘤之一,其發病率和死亡率分別位居我國惡性腫瘤的第3位和第5位[1]。早期CRC 患者的5年生存率可達90%,但中晚期患者的5 年生存率不足20%[2]。在我國,約60%的CRC 患者確診時已為中晚期,盡管治療方法和手段不斷改善,但晚期患者的5年生存率仍一直徘徊在10%左右[3-4]。目前CRC的病因尚不明確,亟待進一步研究闡明其發生發展的分子機理,為研發更多有效的靶向藥物提供理論依據。
DnaJ 熱休克家族成員B6(DnaJ heat shock protein family member B6,DNAJB6)屬于DnaJ熱休克蛋白家族(Hsp40)B 亞族成員,又稱DnaJ 的哺乳動物親屬(mammalian relative of DnaJ,MRJ)。DNAJB6基因定位于染色體7q36.3,可剪接形成3 個轉錄本,編碼產生DNAJB6a、DNAJB6b 和DNAJB6d 共3 種蛋白異構體。DNAJB6作為輔助伴侶分子,可參與底物蛋白的正確折疊及轉運,阻止蛋白質異常聚集,調控蛋白降解及重塑等過程[5]。既往研究顯示DNAJB6功能失調不僅與多種疾病相關,在腫瘤發生進展過程中也發揮重要作用[6-9]。值得注意的是,DNAJB6的a和b兩個異構體的功能存在明顯差異。有研究提示DNAJB6a可發揮抑癌作用,而DNAJB6b 發揮促癌作用[10-14]。而且,上述兩個異構體的表達具有明顯的組織特異性,在不同類型的腫瘤中變化趨勢也有所不同[9-10]。目前,在腫瘤中的研究多集中于DNAJB6a,DNAJB6b的作用還鮮有報道。
我們在前期研究中通過免疫組織化學(immunohistochemistry,IHC)分析發現,DNAJB6 在CRC 組織中表達上調,其高表達是CRC患者預后不良的一個獨立預測因素。同時,功能研究提示DNAJB6 過表達可以顯著增強CRC 細胞的侵襲遷移能力[9]。由于相關研究提示DNAJB6的異構體a和b在表達和功能上存在較大差異,這兩個異構體在CRC中的表達變化和功能作用尚需進行深入研究。
在本研究中,我們首先對CRC 組織中DNAJB6 的異構體a 和b 的表達改變進行分析,并根據分析結果,使用基因表達敲降、Western blot檢測、Transwell侵襲遷移實驗及挽救實驗,探討了CRC組織中異常表達的DNAJB6 異構體對CRC 細胞侵襲運動能力的影響及其作用的分子機制。
1 材料與方法
1.1 試劑和儀器
細胞培養基DMEM、RPMI 1640 和IMDM 購自北京細工生物,胎牛血清購自Newzerum 公司,SDSPAGE 凝膠配制試劑盒購自碧云天生物,Lipofectamine 2000轉染試劑購自Invitrogen公司,BCA蛋白定量試劑盒、Opti-MEM 培養基、嘌呤霉素和ECL 化學發光檢測試劑購自Thermo Scientific 公司。AKT 和p-AKT(Ser473)抗體購自CST 公司,HA 標簽抗體購自MBL 公司、DNAJB6 和GAPDH 抗體購自Proteintech公司。DMSO購自Sigma公司,BEZ235購自Selleck 公司,Matrigel 和Transwell 細胞培養小室購自Corning 公司。電泳儀購自Bio-Rad 公司,酶標儀購自BioTek Instrument公司,倒置光學顯微鏡購自Olympus公司,低溫臺式高速離心機和二氧化碳恒溫培養箱購自Thermo Scientific 公司,化學發光成像儀購自Beckman,數字切片掃描儀購自Hamamatsu公司。
1.2 方法
1.2.1 CRC 腫瘤組織和正常組織mRNA 表達數據的獲取在NCBI 的GEO 數據庫中下載數據集GSE32323的表達矩陣數據和探針平臺矩陣數據,從中選取17對配對的CRC 腫瘤和癌旁正常組織的mRNA 表達數據。利用探針平臺矩陣,獲取DNAJB6a、DNAJB6b對應的探針209015_s_at 和208810_at。結合探針矩陣和表達矩陣,得到DNAJB6 的兩個轉錄本DNAJB6a 和DNAJB6b mRNA的表達數據。
1.2.2 細胞培養人胚胎腎細胞293FT、CRC 細胞系DLD-1 和HCT116 購自南京科佰生物,分別使用添加10%胎牛血清、青霉素(100 U/mL)和鏈霉素(0.1 mg/mL)的DMEM、RPMI 1640和IMDM培養基,于CO2體積分數為5%的37 ℃恒溫孵箱中培養。所有細胞系均經短串聯重復序列鑒定無誤。
1.2.3 siRNA轉染DNAJB6b特異性的siRNA的靶序列 為:siDNAJB6b-T1,5′-GCACGCACTTAACAGAA AT-3′;siDNAJB6b-T2,5′-GCTCATCGGAGCCTCTA TT-3′。陰性對照siRNA 的靶序列為:5′-TTCTCCGA ACGTGTCACGT- 3′ 。 使 用Opti- MEM 培 養 基 和Lipofectamine 2000轉染試劑瞬時轉染siRNA至CRC細胞,按產品說明書進行操作。轉染后培養48 h,收獲細胞沉淀進行Western blot檢測。
1.2.4 構建穩定敲降DNAJB6b 表達的CRC 細胞株pLKO.1-shDNAJB6b-puro 和pLKO.1-陰性對照shRNA質粒由本實驗室構建并保存。shDNAJB6b的靶序列與siDNAJB6b-T1 一致,陰性對照shRNA 的靶序列與陰性對照siRNA一致。在293FT細胞中,使用Opti-MEM培養基和Lipofectamine 2000 轉染可表達DNAJB6b shRNA(簡稱shDNAJB6b)或陰性對照shRNA 的轉移質粒和病毒包裝質粒,收集病毒上清感染DLD-1 和HCT116 細胞,使用嘌呤霉素篩選獲得穩定細胞株,用于后續的Western blot分析和挽救實驗。
1.2.5 抑制劑處理在CRC 細胞系DLD-1和HCT116中,使用20 nmol/L的PI3K-mTOR雙重抑制劑BEZ235處理細胞,以溶劑DMSO 處理細胞作為對照。處理24 h后,將各組細胞接種至Transwell上室進行侵襲遷移實驗,上室中的培養基仍含有相應的藥物。
1.2.6 挽救實驗在穩定敲降DNAJB6b 的DLD-1 和HCT116 細胞中,分別轉染組成型活化的myr-AKT 質粒和空載質粒(方法同siRNA 轉染),陰性對照shRNA組僅轉染空載體質粒,收集各組細胞進行Western blot檢測和Transwell實驗。
1.2.7 Western blot檢測使用含有蛋白酶抑制劑和磷酸酶抑制劑的裂解液提取分離經上述各種實驗處理細胞的總蛋白,經BCA法測定蛋白濃度,按常規方法進行PAGE 凝膠電泳并轉移至PVDF 膜,與AKT、p-AKT(Ser473)、DNAJB6及HA-tag抗體進行雜交并使用ECL 檢測試劑顯示雜交信號,以GAPDH 作為內參對照。
1.2.8 Transwell 實驗分為侵襲實驗和遷移實驗。侵襲實驗:將Matrigel 基質膠稀釋后鋪于Transwell 小室上室,下室加入含20%胎牛血清的新鮮培養基。在上室中接種1.5×105個細胞,培養48 h 后固定染色,統計穿膜細胞數量。遷移實驗:無需提前在Transwell上室鋪Matrigel 基質膠,細胞培養時間為36 h,其余步驟與侵襲實驗一致。
1.2.9 統計學分析使用SPSS Statistics 21軟件進行統計分析,使用GraphPad Prism 7 軟件進行圖表制作。使用配對樣本t檢驗分析CRC 腫瘤組織和癌旁正常組織中DNAJB6 不同轉錄本mRNA 表達水平的差異;使用獨立樣本t檢驗分析BEZ235 處理組和DMSO對照組CRC細胞侵襲遷移能力的差異;使用單因素方差分析法(one-way ANOVA)分析挽救實驗中各組細胞間侵襲遷移能力的差異,在方差齊性的前提下,使用Turkey-HSD 法進行組間比較。當P<0.05 時,為組間差異具有統計學意義。
2 結 果
2.1 DNAJB6 不同轉錄本在結直腸癌組織中的mRNA表達水平存在差異
從NCBI 的GEO 公共數據庫中下載數據集GSE32323的表達矩陣數據和探針平臺矩陣數據,選取17例手術切除的配對正常及腫瘤組織,提取DNAJB6a(209015_s_at探針)和DNAJB6b(208810_at探針)的mRNA表達數據進行統計分析。結果顯示,與癌旁正常組織相比,DNAJB6a在CRC組織中的mRNA表達差異無統計學意義(P=0.458,圖1A),而DNAJB6b在CRC 組織中的mRNA表達顯著上調(P<0.05,圖1B)。

圖1 CRC組織中DNAJB6不同轉錄本的mRNA表達變化情況
2.2 DNAJB6b正向調控AKT的活性
我們在前期研究中發現,敲降DNAJB6 表達可以顯著降低CRC 細胞的侵襲遷移能力[9]。由于有研究顯示AKT通路異常活化在CRC細胞的侵襲轉移過程中發揮重要作用[15-16],而且我們也發現PI3K-AKT-mTOR信號通路在CRC組織中過度活化并與患者的不良預后顯著正相關[17],因此在本研究中我們探討了AKT 異常活化在DNAJB6b介導的CRC細胞侵襲遷移表型中的作用。首先,我們檢測了DNAJB6b表達水平對AKT活性的影響。我們在DNAJB6b 高表達的兩個CRC 細胞系DLD-1 和HCT116 中,使用兩個獨立的siRNA 特異性敲降DNAJB6b 的表達,發現瞬時敲降DNAJB6b 的表達可使細胞中p-AKT(Ser473)的水平明顯降低(圖2A、B)。類似地,我們使用慢病毒感染DLD-1 和HCT116細胞,通過病毒載體表達的shRNA穩定敲降DNAJB6b的表達,同樣可以觀察到細胞中p-AKT(Ser473)水平的明顯下調(圖2C、D)。
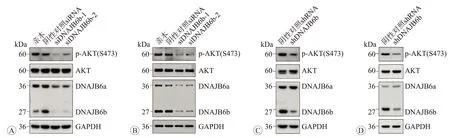
圖2 敲降DNAJB6b表達后下調p-AKT的蛋白表達水平
2.3 AKT 通路活化增強結直腸癌細胞的侵襲遷移能力
為證實AKT 信號通路活化在CRC 細胞系DLD-1和HCT116中對侵襲遷移能力的影響,我們使用PI3KmTOR 雙重抑制劑BEZ235 處理這兩個細胞并進行Transwell 侵襲和遷移實驗。分析結果顯示,使用BEZ235 處理抑制AKT 通路的活性可導致細胞侵襲遷移能力顯著降低(均為P<0.01,圖3)。
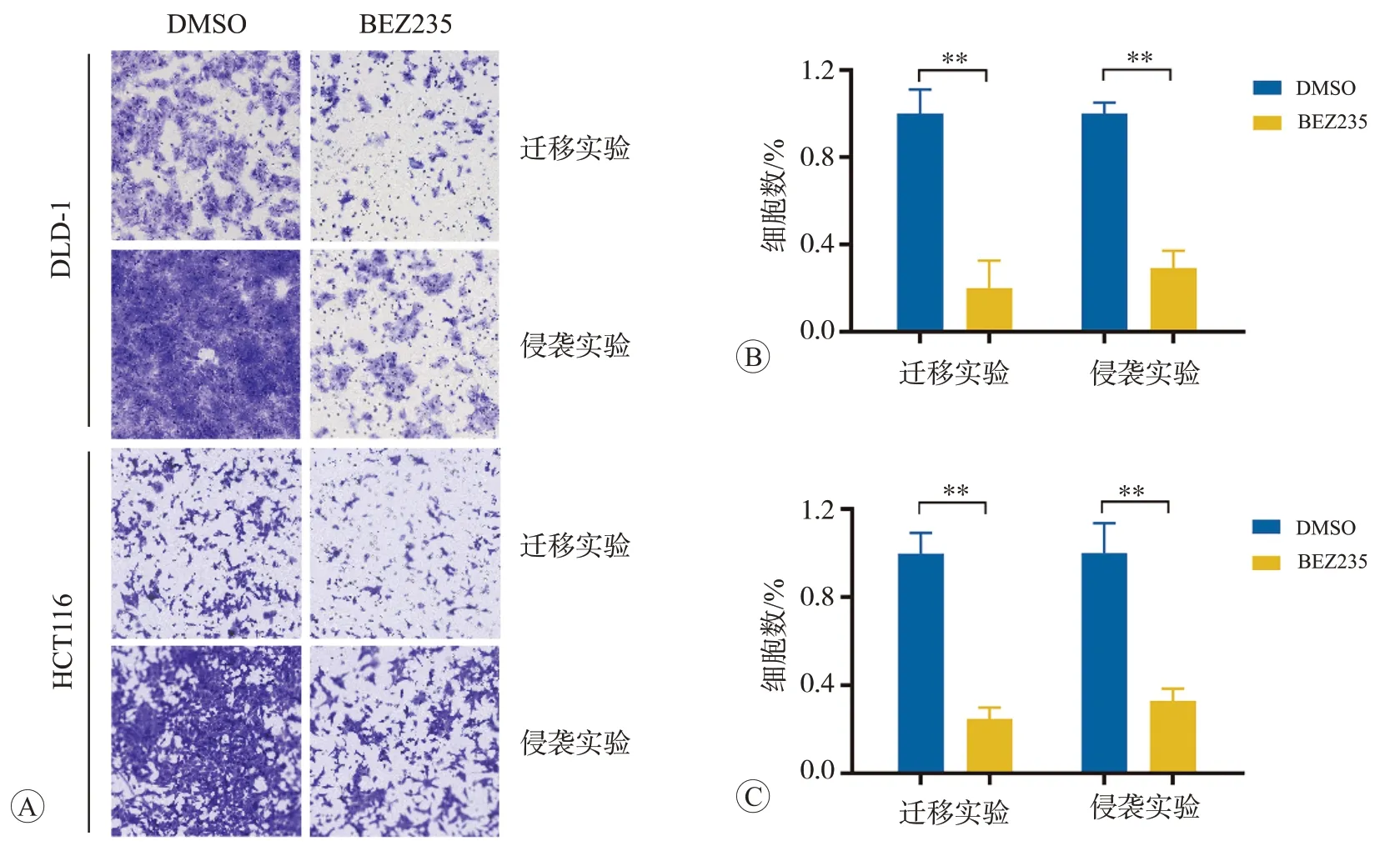
圖3 抑制AKT通路活性可降低CRC細胞的侵襲遷移能力
2.4 DNAJB6b 可通過激活AKT 通路增強CRC 細胞的侵襲遷移能力
為進一步證實AKT通路過度活化是否在DNAJB6b介導的侵襲遷移表型中發揮重要作用,我們進行了挽救實驗。分析結果顯示,在穩定敲降DNAJB6b 的DLD-1 和HCT116 細胞中,通過外源過表達組成型活化的AKT(myr-AKT)上調p-AKT(Ser473)的水平(圖4),可以顯著回復由于敲降DNAJB6b表達所致的細胞侵襲遷移能力降低(圖5)。

圖4 在DNAJB6b 穩定敲降及外源myr-AKT 過表達的Western blot檢測結果
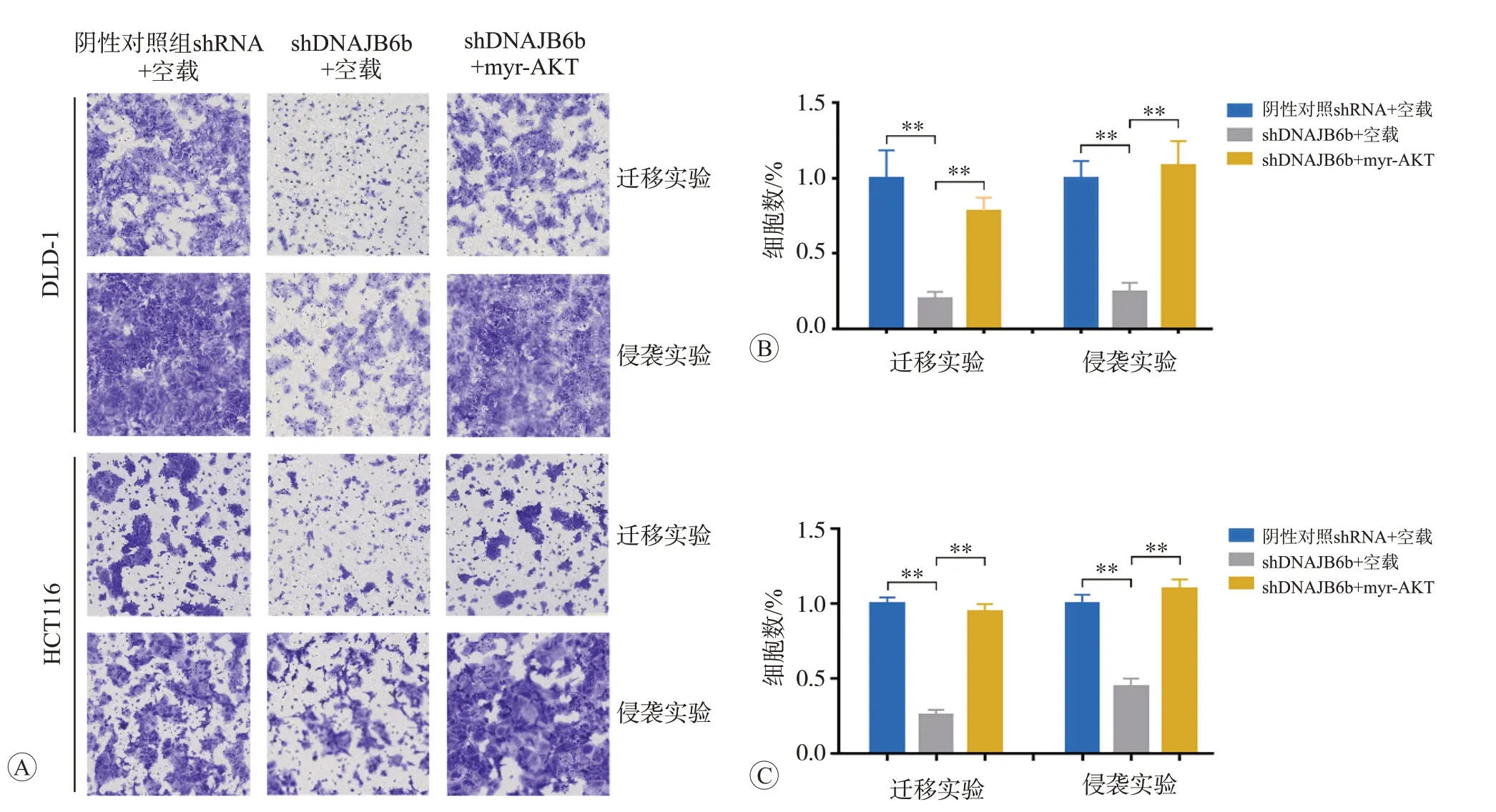
圖5 過表達myr-AKT可逆轉DNAJB6b敲降導致的CRC細胞侵襲遷移能力降低
3 討 論
CRC 中DNAJB6 異構體的作用尚未見文獻報道。在本研究中,我們分析發現,與正常癌旁組織相比,CRC組織中DNAJB6的異構體DNAJB6b mRNA的表達水平顯著上調,而DNAJB6a mRNA 的表達無顯著改變。而且,我們進一步研究發現,DNAJB6b高表達可通過激活AKT通路的活性增強CRC細胞的侵襲遷移能力,提示DNAJB6b異常過表達可能在CRC的發生發展過程中發揮重要作用。
以往的研究顯示,DNAJB6 在不同類型的腫瘤組織中表達變化趨勢不同。例如免疫組織化學(IHC)分析結果顯示在食管癌、乳腺癌組織中DNAJB6 表達下降,而在肺癌和結直腸癌中的表達水平升高[9,14,18-21]。然而由于現有商售抗體不能對DNAJB6 的不同異構體加以區分,IHC 分析實際上無法反映單個異構體的表達改變。近期,有研究報道,在食管鱗癌中DNAJB6a mRNA 表達水平顯著下調并發揮抑癌作用,而DNAJB6b mRNA的表達水平無顯著變化[10]。盡管我們的IHC 分析結果顯示DNAJB6 在CRC 組織中表達上調,但Western blot 分析結果顯示DNAJB6 的異構體a和b 在CRC 組織中的表達豐度存在明顯差異[9]。不僅癌組織中DNAJB6b的表達水平明顯高于正常組織,而且DNAJB6b 的表達豐度也遠高于DNAJB6a,提示DNAJB6b可能是在CRC細胞中發揮功能作用的優勢異構體。為驗證這一發現,在本研究中我們對GEO數據庫中的mRNA 表達數據進行分析,發現DNAJB6b mRNA 在CRC 組織中表達顯著上調,而DNAJB6a mRNA 的表達并無明顯改變。而且,使用siRNA 和shRNA特異性地敲降CRC細胞中DNAJB6b的表達,可以顯著抑制CRC 細胞的侵襲遷移能力。上述結果表明,DNAJB6b 而非DNAJB6a 在CRC 組織中表達上調,同時提示DNAJB6b過表達在CRC細胞中發揮促癌作用。
為進一步分析DNAJB6b過表達促進CRC細胞侵襲遷移的分子機制,我們分析了相關信號通路的表達變化,發現p-AKT(Ser437)的表達水平在DNAJB6b 敲降細胞中明顯降低。PI3K/AKT信號通路異常活化在多種惡性腫瘤的發生發展中發揮重要作用。既往有大量文獻報道,PI3K/AKT 信號通路的活化與CRC 細胞的侵襲轉移密切相關[15-16]。在本研究中,我們使用PI3K/mTOR 通路雙重抑制劑BEZ235 處理DLD-1 和HCT116細胞,證實AKT通路的活化確實可以增強這兩個CRC細胞系的侵襲遷移能力。進而,我們通過挽救實驗證實,AKT的激活在DNAJB6b過表達介導的CRC細胞侵襲遷移過程中發揮重要作用。
綜上所述,本研究結果提示DNAJB6b異常過表達在CRC細胞中發揮促癌作用,而且DNAJB6b可通過正向調控AKT的活性增強CRC細胞的侵襲遷移能力。同時,本研究結果提示,DNAJB6b可能作為潛在的分子靶點,用于CRC,特別是轉移性CRC 的治療。目前,DNAJB6b調控AKT活性的具體分子機制還未闡明,也未見到有關DNAJB6b特異性抑制劑的報道。后續的研究一方面將深入探索揭示DNAJB6b促癌作用的分子機制,同時需要篩選鑒定DNAJB6b的靶向抑制劑并探索聯合靶向治療策略。

