多重耐藥鮑曼不動桿菌生物被膜形成能力在醫院感染監測中的研究
李凱旋,狄友華,周 楊,王 幸,陳 蕾,嚴蕊娜
(1.西安醫學院第二附屬醫院控感科,陜西西安,710038;2.西安醫學院第二附屬醫院呼吸與危重癥醫學科,陜西西安,710038)
鮑曼不動桿菌(AB)非發酵革蘭陰性桿菌,專性需氧,屬于不動桿菌屬。通過環境、各類醫療器械表面以及醫務人員的手傳播,對溫度和pH有較強的適應能力,在干燥環境和非生物表面均可長期存活。是近年來醫院獲得性感染的重要條件致病菌之一[1]。最常發生于重癥監護室(ICU)的有嚴重基礎疾病、氣管切開/插管、高齡且住院時間長、免疫功能低下或缺失、接受呼吸機或中心靜脈置管等侵入性操作患者,可引起呼吸機相關性肺炎(VAP)、血流感染(敗血癥)、手術傷口感染、軟組織感染、泌尿生殖道感染、中樞神經系統感染(腦膜炎)等難治性感染甚至死亡[2]。據全球相關報道統計每年感染鮑曼不動桿菌約有100萬人,多重耐藥菌株引起感染占其中一半數量[3],在鮑曼不動桿菌感染者中ICU患者的死亡率達45%~60%,若被泛耐藥鮑曼不動桿菌感染可達到84.3%[4-5],給臨床治療帶來了極大的困擾和挑戰,引起臨床醫生以及微生物研究者的高度關注。
生物膜的形成是細菌的主要耐藥機制之一。形成生物膜的菌株耐藥性可以提高10~1000倍。據估計,65%~80%的人類感染是由具有生物膜形成能力的細菌引起[6]。當鮑曼不動桿菌形成生物被膜后,使機體的吞噬細胞和殺傷細胞不能對細菌產生有效攻擊,同時抗生素亦不能有效清除生物膜,還可誘導耐藥性產生;同時被生物膜包裹的細菌難以獲得氧氣和營養,處于休眠狀態,從而對抗生素不敏感,待抗生素治療停止后殘存細菌迅速繁殖,使用抗菌藥物不能完全對其徹底清除,導致被感染對象反復發作,難以治愈。鮑曼不動桿菌的強耐藥性與生物膜的形成有一定的相關性。本文旨在檢測臨床分離的多重耐藥鮑曼不動桿菌菌株的生物膜形成能力,統計分析生物膜陽性多耐菌的分布,并為臨床治療提供思路和方法。
1 材料與方法
1.1 材料
1.1.1 菌株來源:收集醫院2018年3月—2020年3月臨床住院患者痰液、分泌物、肺泡灌洗液、尿液、血液等標本分離培養出的多重耐藥鮑曼不動桿菌89珠,經VITEK-2全自動細菌鑒定儀鑒定符合本實驗菌株要求。剔除同一患者相同部位重復菌株。鮑曼不動桿菌質控菌珠ATCC19606購于北京三踏生物科技有限公司。
1.1.2 試劑和耗材:普通瓊脂粉、營養肉湯培養基、結晶紫染液、剛果紅培養基(上海裕明實業有限公司),PBS緩沖液(北京索萊寶科技有限公司),96孔細胞培養板(賽業生物科技有限公司)。
1.1.3 主要儀器:比濁儀(山東鑫科生物科技股份有限公司),生化培養箱(上海躍進醫療器械有限公司),分析天平(MT儀器上海有限公司),多功能酶標儀(美國寶特有限公司)。
1.2 方法
1.2.1 剛果紅瓊脂培養基的配制:用分析天平精確稱取剛果紅干粉0.8 g、腦心浸液干粉37 g、葡萄糖50 g、瓊脂粉150 g,加入無菌蒸餾水至1000 mL,充分搖勻后分裝于兩個錐形瓶中,橡膠塞封口,121℃高壓蒸汽滅菌15~20 min,當溫度降至55℃時,在生物安全柜中倒入直徑為9 mm的培養皿,靜置4℃冰箱冷藏備用。
1.2.2 剛果紅瓊脂培養基定性初篩:將篩選出的實驗多耐菌株分別接種于剛果紅培養基中,生化培養箱35℃恒溫培養18~24 h,然室溫放置24 h,觀察結果:呈黑色、干燥粗糙、出現結晶的菌落為生物膜陽性菌株,而紅色光滑菌落則為不產生生物膜菌株。
1.2.3 菌懸液的配制:將剛果紅培養基上顯示為生物被膜陽性菌株直接接種于血瓊脂平板上,經過37℃、100 rpm振搖培養18~24 h至對數期,3000 rpm離心5 min,棄上清,再用無菌生理鹽水調節菌液濁度至0.5麥氏濁度(1.5×108CFU/mL)。
1.2.4 生物膜形成的定性測定:在6孔細胞培養板上建立多重耐藥鮑曼不動桿菌生物膜,以質控菌株作為對照組。挑取質控菌株和實驗菌株于5ml LB肉湯培養液中,37 ℃恒溫培養12 h、24 h、36 h、48 h、60 h、72 h,用比濁儀調整菌液濃度至0.5麥氏濁度,6孔細胞培養板內加入26 mm×21 mm已滅菌的蓋玻片,分別吸取2 mlLB肉湯培養液和200 μl菌液加入6孔細胞板中,37℃恒溫生化箱培養,每24 h更換培養液1次,3天后將蓋玻片從培養基中移出,用無菌PBS溶液快速沖洗3次,以去除蓋玻片上附著的浮游菌,室溫靜置風干后,在酒精燈上加熱固定,然后用1%結晶紫溶液染色20 min,再用無菌PPS溶液快速沖洗3次,以便除去多余的染液,室溫靜置風干。置于2.5%戊二醛中浸泡固定,于4℃冰箱保存,次日再用無菌PBS溶液沖洗3次,室溫靜置風干用于掃描電鏡觀察。
1.2.5 生物膜形成的定量測定:在96孔細胞培養板內各加入100 μl菌液和100 μlLB培養液,每24 h更換LB培養液1次,以未加菌液的LB培養液作為空白對照,恒溫培養3 d后用PBS溶液沖洗細胞培養板,室溫靜置風干后,加入1%結晶紫溶液200 μl室溫染色20 min,用無菌PBS溶液沖洗染液,室溫靜置風干后,再加入95%乙醇脫色15 min,以便洗去多余的結晶紫,將多功能酶標儀調節至570nm波長處,然后測定其吸光度(A)值。生物膜形成陽性以均值為空白對照2倍以上為判定標準[7]。
1.3 統計學方法
采用SPSS 23.0軟件,計數資料以百分率(%)表示,單因素方差分析組間實驗數據,檢驗水準α=0.05,P<0.05為差異有統計學意義。
2 結果
89株多耐藥實驗菌株分別接種在剛果紅培養基中,培養3 d后有64株呈陽性反應,產生黑色干燥菌落,為產生物膜的菌株,陽性率達71.91%(64/89)。回顧標本來源生物膜陽性的多重耐藥鮑曼不動桿菌以呼吸與危重癥醫學科的ICU病房最多,占45.31%(29/64),重癥醫學科占21.88%(14/64),神經外科17.19%(11/64),普外科和骨科均為10.94%(7/64),其他科室9.38%(6/64)。
將篩選出的產生物膜多重耐藥實驗菌株在6孔細胞培養板上培養3 d后均可以形成成熟的生物膜,經結晶紫染色后肉眼可見蓋玻片表面覆蓋有一層紫色致密物質,將蓋玻片放置于高倍鏡下觀察,清晰可見大量細菌相互黏連包裹于其中,形成膜狀微菌落(圖1),經革蘭染色的浮游性鮑曼不動桿菌在高倍鏡下觀察,細菌呈分散方式分布(圖2)。掃描電鏡觀察實驗菌株和質控菌株圖像,發現實驗菌株細菌黏連聚集包裹融合成立體膜狀集落結構,而質控菌株則是大量細菌聚集成團形成分散的微菌落,由此可見實驗菌株形成生物膜的能力較標準菌株更強一些(圖3和圖4)。

圖1 體外培養形成的生物膜(×40)
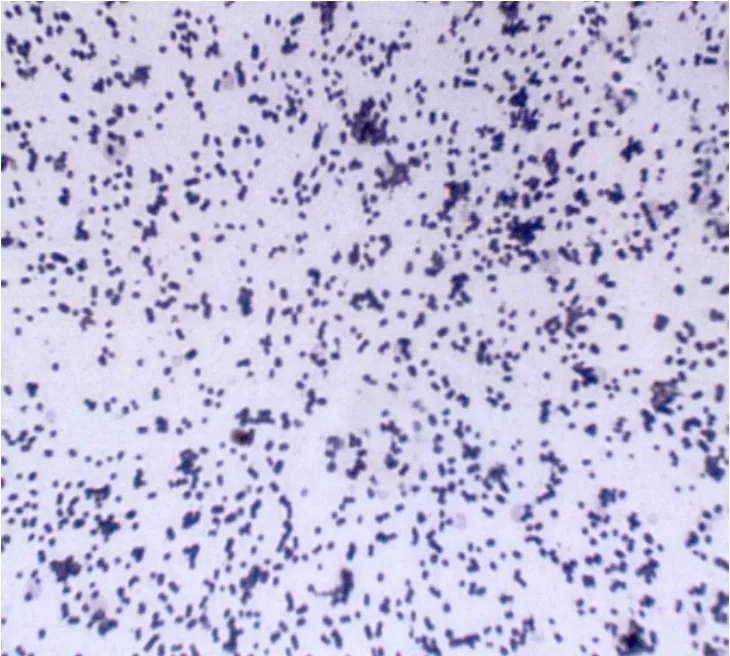
圖2 浮游型鮑曼不動桿菌(×40)

圖3 質控菌株生物膜(×5000)

圖4 實驗菌株生物膜(×5000)
89株多耐實驗菌株在96孔細胞培養板培養3天后,經多功能酶標儀測定其吸光度值發現,培養48 h形成的生物膜量最高,結果顯示:71珠多重耐藥鮑曼不動桿菌能夠形成生物膜,陽性率達79.78%(71/89),剛果紅培養基中呈陽性反應的菌株在細胞培養板上均能形成細菌生物膜。行單因素方差分析,差異有統計學意義(P<0.05)。見圖5。

圖5 多功能酶標儀測定結果
3 討論
生物膜細菌是細菌的另一種生存方式,由外界多種因素影響和細菌自身相互作用產生,生物膜的形成延長鮑曼不動桿菌在醫院環境中的存活時間,使菌株定值于醫院環境設施(如床欄、門把手)、醫護人員手、氣管導管、中心靜脈置管等,逃避宿主免疫系統的免疫殺傷作用,極大增強了對抗生素的耐藥性,是院內感染廣泛傳播的主要原因,進一步加重鮑曼不動桿菌感染者的病情和治療難度,因此,強化環境物表的清潔消毒,增加消毒頻次,定期監測消毒效果,減少致病菌的定植傳播,嚴格執行無菌操作,及時評估留置管道感染風險,今早拔除各類管道,減少耐藥菌株的產生,提高醫務人員手衛生意識,阻斷傳播途徑,嚴格落實多重耐藥菌管理預防和控制措施。
本研究通過剛果紅培養基定性法和結晶紫染色定量法分別對臨床分離的89珠多重耐藥鮑曼不動桿菌進行生物膜形成能力的檢測,其中70%以上多重耐藥鮑曼不動桿菌均能形成生物被膜;剛果紅培養基中呈陽性反應的菌株經結晶紫染色培養、掃描電鏡觀察實驗菌株細菌黏連聚集包裹融合成立體膜狀集落結構;71株多重耐藥鮑曼不動桿菌在96孔細胞培養板上均能形成細菌生物膜,且在48 h時生物膜量達到峰值。表明臨床分離多重耐藥鮑曼不動桿菌大多都已形成細菌生物膜,與 Zeighami等[8]研究結果一致。楊芬等[9]對臨床152株鮑曼不動桿菌進行生物膜形成能力檢測,其生物膜陽性率達89.5%。文獻報道的臨床鮑曼不動桿菌生物膜陽性率雖然存在一定差異,但大多實驗結論表明其具有較高水平的形成能力,這可能與標本地域、來源科室、標本部位及類型、培養基成分、實驗檢驗方法等導致不同研究結果差異。
目前研究確定的生物膜耐藥機制主要有以下幾個方面:①生物膜的限制滲透作用,成熟穩定期的生物膜是由大量胞外基質及高密度細菌形成致密空間結構,限制抗菌素的滲透,減緩抗菌素的擴散速度,降低抗菌素的有效濃度,使其不能發揮殺菌作用。②生物膜的營養限制學說,生物膜內的營養物質由外及內是逐級遞減的,深層細菌處于饑餓狀態不受抗菌素的干預,在治療停止后,殘存的細菌又迅速繁殖,形成耐藥性更強的生物膜,從而使感染遷延不愈[10]。③外排泵基因、耐藥性相關基因和生成基因等多種基因表達上調,且部分基因僅在生物膜狀態下表達。④QS感應系統,承擔細菌相互傳遞信號的作用,通過調控生物膜的形成和外排泵作用來增加耐藥性。⑤免疫逃逸,細菌被包裹在胞外基質內,免疫吞噬細胞和殺傷細胞不能對細菌產生有效攻擊,從而使感染反復,遷延難愈。
生物膜狀態下的鮑曼不動桿菌其耐藥性不僅包括細菌本身的耐藥機制,同時還具備生物被膜的耐藥機制,使感染更難治愈。目前國內外學者主要從抗細菌黏附、清除已形成的生物膜、干預生物膜形成、新型抗菌素的研發以及中西藥結合等方面尋找防控和治療生物膜感染性疾病的方法。楊佩紅等報道替加環素對MDR-Ab具有較好的抗菌活性,且可以破壞結構穩定的生物膜[11]。天蠶素A、SET-M33脯氨酸二聚體A3-APO等抗菌肽可破壞鮑曼不動桿菌生物膜[12]。中藥五倍子能抑制鮑曼不動桿菌的生長及其生物膜的形成[13]。噬菌體能破壞已形成的生物膜,主要機制包括編碼裂解酶、破壞QS系統、裂解宿主菌[14]。賴必鵬等[15]報道DnaJ基因過表達能顯著抑制鮑曼不動桿菌生物膜形成能力。ICU分離出的鮑曼不動桿菌均為多重耐藥菌株,多黏菌素B可通過減少細菌胞外分泌物含量來影響其生物膜形成能力,從而達到殺菌效果[16]。在臨床體外試驗中多重耐藥的鮑曼不動桿菌具有很強的耐藥性且與生物膜形成能力呈正相關。生物被膜的產生是其多重耐藥機制的重要原因之一,病原菌被膜包裹增加了臨床控制感染的難度,其傳播途徑主要為接觸傳播,因此做好院內感染的防控工作及其重要。雖然對多重耐藥鮑曼不動桿菌生物膜的形成和耐藥機制有一定認識,但其耐藥機制復雜,部分研究結果仍存在分歧,有待進一步深入研究,因此臨床應以預防為主,落實各項防控措施,防止生物膜形成,合理使用抗菌藥物,結合多種方法治療鮑曼不動桿菌的感染。
利益沖突聲明:作者聲明本文無利益沖突。

