限時喂養對DNA疫苗免疫效果的影響
李方琳,梁 鵬,粟雨芯,馬忠仁,蘇君鴻
(1.西北民族大學 生物醫學研究中心,甘肅 蘭州 730030;2.西北民族大學 生命科學與工程學院,甘肅 蘭州 730030)
流感是由流感病毒引起的急性呼吸道傳染性疾病。流感病毒是一種高度傳染性呼吸道病原體,對全球公共衛生構成重大威脅[1]。目前預防和控制流感最為有效的措施就是接種疫苗。近年來,DNA疫苗因其免疫效果好、危險性低、操作方法簡便、價格低廉、易于貯藏和運輸等優點引起廣泛關注[2-5]。
營養、免疫功能和病理狀態間的作用是相互的[6-7],營養攝入和營養狀況影響宿主的免疫能力和身體對疾病或感染的反應;免疫缺陷影響營養利用,一些致病微生物或疾病可能引起營養不良和免疫缺陷,人體的生化指標測定與飲食攝入和臨床檢查相關聯,也與免疫學測量相關聯[8-9]。此外,飲食攝入量的定性和定量也參與免疫調節[10-11]。限時喂養(Time-restricted feeding,TRF)是將進食限制在特定時間。最受歡迎的TRF進食時間是8:16,意味著8 h的進食窗口之后是16 h的空腹窗口[12-15]。有研究表明,在禁食期間腸道微生物群中與抗生素活性相關的基因表達水平顯著增加,同時與宿主免疫系統相關的基因表達上調[16]。本試驗探討8 h進食窗口對小鼠免疫效果的影響。
1 材料與方法
1.1 主要材料與試劑
pcDNA3.1(+)-HA重組質粒、小鼠淋巴細胞分離液(達科為生物技術有限公司)、RPMI-1640培養基、優級胎牛血清(蘭州民海生物工程有限公司)、35 mm培養皿(Thermo)、200目尼龍網、15 ml離心管、96孔板、10 ml移液管、MTT試劑盒(Promega)、Con A及受體破壞酶RDE(Sigma)、BSA(索萊寶)、H1N1流感病毒(武漢生物制品研究所有限責任公司)、1%雞紅細胞(自制)、U型血凝板。
1.2 試驗動物
雄性SPF級BALB/c小鼠,由中國科學院蘭州獸醫研究所實驗動物中心提供。試驗期間,所用飼料為普通小鼠生長繁殖飼料,墊料為輻照木屑,飼料及墊料均購自蘇州雙獅生物有限公司。
1.3 方法
1.3.1 適應階段 4周齡、體重15~20 g的BALB/c小鼠(n=24)。試驗開始前,所有小鼠被飼養在溫度24.9±1.2 ℃、相對濕度50.9±7.1%、12 h的光/暗循環、無特定病原體的環境中,為期1周。適應期間小鼠可以隨意獲取食物和飲水,為保持環境干燥、清潔,每4 d更換1次飲水與墊料。
1.3.2 試驗階段 適應結束后,將小鼠分為2個大組,即自由進食組(N)和8 h限時喂養組(F),其中每大組又分為2個亞組,各組均經肌肉分別注射25 μg重組質粒pcDNA3.1(+)-HA及同體積生理鹽水進行免疫,即pcDNA3.1(+)-HA實驗組(N/F-pcDNA3.1(+)-HA),對照組(N/F-Con),每籠6只。N組小鼠全天均可自由獲取食物和水。F組小鼠于初次免疫后立即進入限時喂養,即上午8:30喂養、下午4:30撤去食物,第二天上午8:30再次喂養,如此重復30 d。2周后進行加強免疫,檢測小鼠指標。以初次免疫開始記為0 w。試驗分組如圖1所示。

圖1 試驗設計
1.3.3 樣本采集 以每籠為單位,F組每日8:30給食、下午4:30撤食,N組為前一天8:30給食,次日8:30撤去飼料,給飼料與撤飼料時均進行稱量,二者之間的差值為小鼠每日進食量。從初次免疫開始,每周在撤去食物之前稱量小鼠體重。
1.3.4 血清抗體檢測
1.3.4.1 分離血清。加強免疫2周后,采集小鼠血液,室溫放置2 h,2 000 rpm離心10 min,分離血清,-80 ℃備用。
1.3.4.2 制備1%雞紅細胞。對成年未經免疫的公雞翅下采血,離心洗滌數次,取紅細胞沉淀,用PBS稀釋為1%,置于4 ℃備用。
1.3.4.3 四個紅細胞凝集單位抗原。1個紅細胞凝集單位是指能引起等量標準化紅細胞凝集時的病毒量,紅細胞凝集抑制試驗一般采用4個紅細胞凝集單位(25 μl體積中含有4個紅細胞凝集單位的病毒量)。取一次性血凝板,每孔加入50 μl PBS,第一孔加入50 μl稀釋后的抗原,按照1:2n倍比稀釋抗原,隨后每孔加入50μl 1%雞紅細胞,室溫靜置30 min觀察結果。當結果為第一孔++++,第二孔++,第三孔+/-,第四孔-時,則該抗原稀釋度為四個紅細胞凝集單位抗原。
1.3.4.4 去除非特異性血凝抑制素。將小鼠血清與受體破壞酶(RDE)按照1:4混合,于37 ℃恒溫過夜后,56 ℃水浴1 h,加入雞濃縮紅細胞,4 ℃放置1 h,離心,取上清備用。
1.3.4.5 紅細胞凝集抑制試驗(HI)。在一次性血凝板每孔加入25 μl PBS,在第1孔加入經RDE處理過的小鼠血清或標準血清,按照1:2n倍比稀釋血清,第11孔吸出25 μl棄掉,第12孔不含血清。每孔加入25 μl四個紅細胞凝集單位抗原,輕輕混勻,室溫孵育1 h后,每孔加入1%雞紅細胞,室溫放置30 min后觀察結果。
1.3.5 脾細胞刺激 加強免疫2周后,BALB/c 小鼠脫頸處死,立刻泡于75%的酒精10~20 min,按照說明書分離脾臟淋巴細胞。用移液器小心吸出淋巴細胞層,轉移到新的無菌離心管中,加入10 ml 1640培養基洗滌,室溫下,轉速250 g離心10 min,棄上清。用含有10%胎牛血清和1%雙抗的1640培養基重懸細胞,最后調整細胞濃度為4×104/ml,向96孔板中每孔加入100 μl。培養24 h后,分別用5 μg/ml Con A、H1N1流感病毒、2μg/ml BSA和1640培養基作為刺激物,各組重復5孔,37 ℃、5% CO2培養48 h,加入20 μl MTT,繼續培養4 h,用酶標儀在490 nm波長下測定每孔的OD值。數據表示為刺激指數(SI),即其余刺激孔的平均OD值除以培養基處理孔的平均OD值。
2 結果與分析
2.1 飲食與體重變化
通過對各組小鼠飲食與體重進行稱量,結果顯示,限時喂養1周后,與N組相比,F組小鼠體重較低(圖2),但這種差距隨著時間的推移逐漸減小,可能是在限時喂養后期,小鼠逐漸適應這種飲食模式。同時,經過對小鼠進食量進行記錄統計發現,F組小鼠累計進食量減少(圖3),可能是限時喂養前期F組體重較輕。
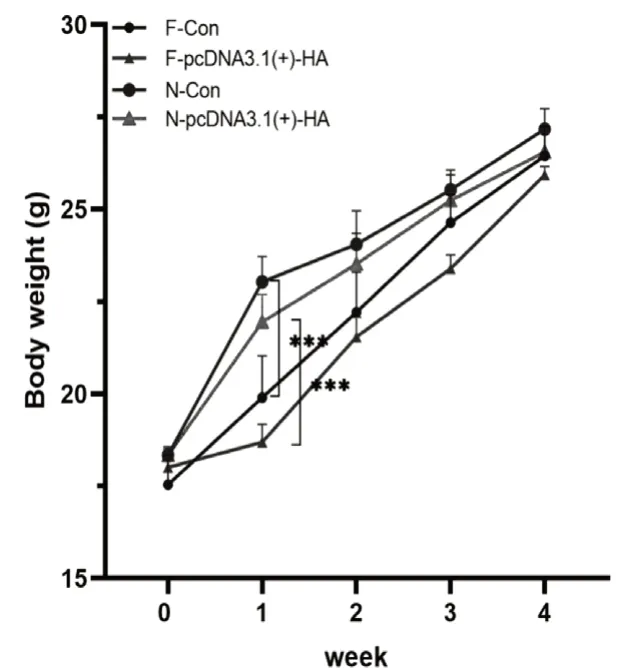
圖2 限時喂養對小鼠體重的影響
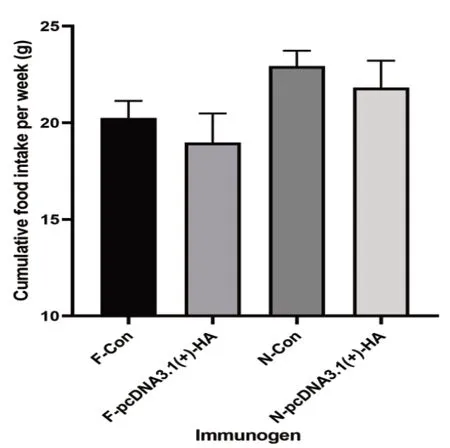
圖3 限時喂養對小鼠進食量的影響
2.2 血清抗體檢測
使用紅細胞凝集抑制試驗對小鼠血清抗體進行檢測,結果顯示,陽性對照的完全凝集孔為第9孔,F-pcDNA3.1(+)-HA組小鼠血清完全凝集孔為第5~6孔(圖4A),N-pcDNA3.1(+)-HA組小鼠血清完全凝集孔為第4~5孔(圖4B),表明F-pcDNA3.1(+)-HA組小鼠血清抗體效價較N-pcDNA3.1(+)-HA組高,也意味著限時喂養在一定程度上增強了小鼠的體液免疫。
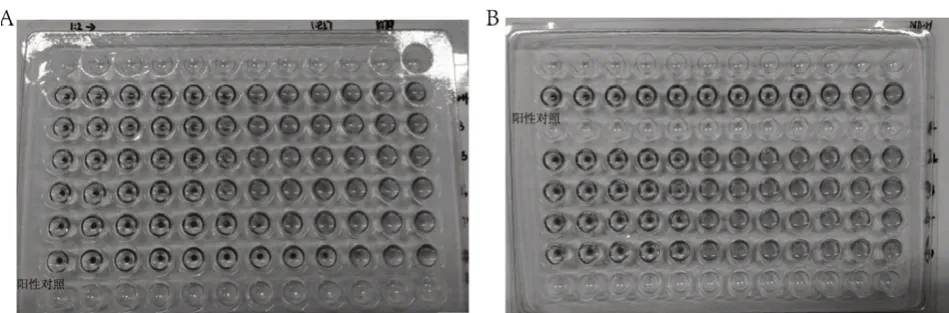
圖4 小鼠血清抗體檢測
2.3 脾細胞刺激
采用MTT法檢測脾臟T細胞增殖情況,進一步確定限時喂養如何影響細胞免疫。如圖5所示,F-pcDNA3.1(+)-HA和N-pcDNA3.1(+)-HA組對ConA以及H1N1的增殖反應明顯強于F-Con組及N-Con組。F-pcDNA3.1(+)-HA對ConA以及H1N1的增殖反應明顯強于N-pcDNA3.1(+)-HA,也表明限時喂養在一定程度上可以增強抗原特異性T細胞應答。
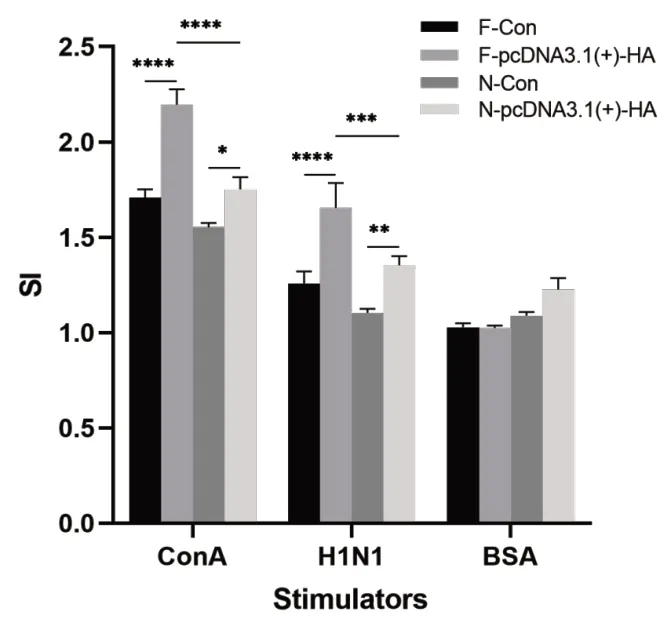
圖5 小鼠脾細胞增殖情況
3 討論
與N組相比,限時喂養4周后,無論是F-pcDNA3.1(+)-HA組還是F-Con組,累計進食量均有所下降,但對小鼠最終的體重沒有明顯影響。注射DNA疫苗的小鼠細胞免疫均有所增強,但F-pcDNA3.1(+)-HA組增強更加明顯,該結果與體液免疫結果一致。這些結果表明,TRF在一定程度上可以增強小鼠免疫功能。

