單孔腹腔鏡膽囊切除術手術時間延長的影響因素分析
侯澤斌,段亞飛,徐 輝,羅銀義,崔 桐,閆 軍
(1.山西醫科大學,山西 太原,030001;2.山西醫科大學第一醫院肝膽胰外科)
隨著外科微創理念與技術的發展,膽囊切除的手術方式經歷了開腹到腹腔鏡的演變過程;近年,經臍單孔腹腔鏡膽囊切除術(single-incision laparoscopic cholecystectomy,SILC)在順利完成膽囊切除的基礎上兼具損傷小、術后康復快、美容效果好等優勢,在各大醫院開展,為膽囊良性疾病的手術治療提供了新的選擇[1],但由于其操作空間較小、器械相互干擾、“筷子效應”及需要助手與術者的良好配合等技術難點,導致較標準腹腔鏡膽囊切除術(laparoscopic cholecystectomy,LC)的操作難度提高,手術時間延長[2-3]。研究表明,腹腔鏡手術時間延長會導致并發癥發生率增加[4],因此明確SILC手術時間延長的相關因素對提高手術安全性具有非常重要的意義。本研究通過分析SILC患者的多項臨床資料與手術時間的關系,明確手術時間延長的主要因素,探討圍手術期如何通過控制影響因素提高手術安全性,以期為臨床工作提供指導。
1 資料與方法
1.1 臨床資料 回顧分析2018年4月至2021年6月由山西醫科大學第一醫院肝膽胰外科同一組醫師完成的SILC患者的臨床資料,共納入556例,其中男246例(44.2%),女310例(55.8%),14~91歲,平均(53.60±7.65)歲。納入標準:符合膽囊切除指征的良性疾病,包括急性或慢性膽囊炎、膽囊結石、膽囊息肉、膽囊腺肌癥等;全程行SILC;病例資料完整。排除標準:合并腫瘤或其他免疫系統疾病;各種原因導致術中加孔或中轉開腹;病例資料不完整。術前患者均簽署手術同意書,本研究方案經醫院倫理委員會審核批準并獲得患者知情同意。
1.2 手術方法 經臍或于臍上、臍下切開1.5~2 cm,電刀依次切開皮下組織、腹白線后鈍性分離腹膜外脂肪并打開腹膜,置入單孔多通道底座,通道包括1個氣腹通道、2個5 mm孔、1個10 mm孔。術者與扶鏡手立于患者左側,扶鏡手立于術者前方,助手立于患者右側(圖1)。10 mm Trocar置入30°腹腔鏡,探查腹腔,左側5 mm Trocar置入操作器械,器械主要包括分離鉗、電鉤、超聲刀、剪刀及吸引器等;右側5 mm Trocar置入輔助器械,主要包括重型抓鉗、艾利斯抓鉗。除超聲刀外,其余腹腔鏡器械均為預彎器械。抓鉗鉗夾膽囊底部,并將膽囊向腹腔上方提起,以暴露膽囊三角,根據術中張力調整抓鉗鉗夾膽囊的位置、力度及方向。分離膽囊三角,仔細游離膽囊管及膽囊動脈,確認結構無誤后于膽囊管近端上2枚Hem-o-lok夾,遠端上1枚Hem-o-lok夾后用剪刀離斷,膽囊動脈上1枚Hem-o-lok夾后用超聲刀離斷,用超聲刀或電鉤沿膽囊肝臟面漿肌層將膽囊剝離,充分止血后仔細檢查確保無膽汁外漏及其他副損傷,將膽囊裝入標本取出器后連同器械及底座一同撤出腹腔,膽囊送病理檢查。0號腹腔鏡薇喬線依次縫合白線及皮下組織,5-0薇喬線縫合皮膚后結束手術。

圖1 手術站位
1.3 觀察指標 收集患者基本信息及臨床資料,包括性別、年齡、身體質量指數(body mass index,BMI)、糖尿病、高血壓、膽囊壁厚度、膽囊結石及頸部嵌頓情況、上腹部手術史、膽囊萎縮情況、急性膽囊炎、白細胞水平、手術時間、并發癥。手術時間定義為自切開皮膚至手術結束;將手術時間延長定義為手術用時超過手術時間分布的上四分位數,即≥80 min。
1.4 統計學處理 應用SPSS 22.0軟件進行數據分析。定量資料以均數±標準差表示,采用t檢驗進行組間比較;定性資料以頻數及百分比表示,采用χ2檢驗進行組間比較。應用Logistic回歸進行相關因素分析及關聯強度的計算。P<0.05為差異有統計學意義。
2 結 果
2.1 兩組患者臨床資料及并發癥的比較 納入本研究的556例患者均順利完成SILC,手術時間26~175 min,平均(62±22)min,延長組139例患者,平均(95±14)min;非延長組417例患者,平均(51±10)min。11例(1.98%)發生并發癥,其中臍部切口感染4例(0.72%),膽道損傷1例(0.18%),胃腸道損傷1例(0.18%),術后胃腸道功能紊亂2例(0.36%),術后腹腔出血1例(0.18%),切口疝2例(0.36%);其中延長組6例(1.08%),非延長組5例(0.90%)。兩組BMI、上腹部手術史、急性炎癥期、膽囊壁厚≥3 mm、膽囊萎縮、并發癥差異有統計學意義(P<0.05),見表1。
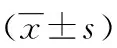
表1 兩組患者一般臨床資料的比較
2.2 延長組手術時間的Logistic回歸分析結果 以未延長組為參照,將BMI、上腹部手術史、急性炎癥期、膽囊壁厚≥3 mm、膽囊萎縮納入多因素Logistic回歸分析,結果顯示,BMI(P<0.05,OR=1.729)、上腹部手術史(P<0.05,OR=6.201)、膽囊壁厚≥3 mm(P<0.05,OR=5.142)、急性炎癥期(P<0.05,OR=6.033)、膽囊萎縮(P<0.05,OR=2.417)是SILC手術時間延長的獨立危險因素,見表2。
表2 多因素Logistic回歸分析
3 討 論
本研究結果顯示,BMI、上腹部手術史、膽囊壁厚≥3 mm、急性炎癥期及膽囊萎縮是SILC手術時間延長的獨立影響因素,延長組較未延長組并發癥發生率更高。既往研究表明,肥胖患者由于腹壁脂肪層增厚、腹腔內與膽囊三角區脂肪堆積,常伴發脂肪肝使肝臟體積增大等情況,導致術中操作空間受限、術野暴露困難,明顯延長了手術時間[5]。筆者在實際操作中體會,建立SILC臍部切口時,高BMI患者皮下較厚的脂肪層會使術者無法準確找到腹白線而錯誤地切到肌肉層,引起較多出血并影響操作視野,進而延長入腹時間,因此針對此類患者應適當擴大切口保證充分的操作空間,因臍底脂肪層較薄,由臍底開始切開皮下脂肪層有助于準確找到腹白線。此外,在患者心肺功能可耐受的情況下適當提高氣腹壓或留置胃腸減壓管有助于增加操作空間。剪刀及電鉤等銳性器械應盡量在腹腔鏡直視下進出腹腔,避免損傷胃腸道。由于膽囊三角區脂肪堆積,分離膽囊動脈、膽囊管時盡量采用鈍性分離的方式暴露管道結構,確認結構無誤后再離斷。
本研究中1例上腹部手術史患者在電刀建立臍部切口時不慎損傷粘連的腸管漿肌層,術中及時發現并通過臍部小切口進行腸管修補,術后恢復良好。有上腹部手術史的患者腹腔內粘連率高達95%[6],粘連通常會導致腹腔原有結構發生改變及手術操作空間受限,這些均會增加手術難度、延長手術時間、增加并發癥的發生風險。由于原切口及周圍部位粘連情況最為嚴重,我們一般選取離既往手術切口較遠處入腹,采用Hasson法直視下逐層入腹,打開腹白線及腹膜外脂肪層后鉗夾腹膜組織;如感覺質韌厚實并向上提拉腹壁費力,表明此處可能存在粘連,打開腹膜時應注意保護粘連的腸管;如存在輕度粘連可用手指或無損傷鉗鈍性分離粘連后再置入SILC底座。松解腹腔內粘連時,助手可牽拉粘連帶提供張力,術者選擇無腸管及其他重要結構且較薄的部位進行松解,可用電鉤或超聲刀離斷,粘連松解后應仔細止血并確定無其他副損傷。術中只需對影響操作的粘連進行松解,不影響手術操作及無梗阻癥狀的粘連不必分離,避免造成副損傷[7]。此外,對于松解粘連難度極大或腹腔內結構嚴重變形的病例應盡早加孔或中轉開腹,以確保手術安全及患者的生命健康。
Kokoroskos等[8]在一項包含1 089例患者的前瞻性研究中指出,膽囊壁增厚與LC手術時間、中轉開腹、延長住院時間明顯相關,并認為可將膽囊壁厚度作為手術復雜程度及并發癥的預測因素,與本研究結果一致。慢性膽囊炎反復發作常致膽囊壁纖維化增厚、膽囊周圍組織粘連,急性膽囊炎膽囊壁充血水腫也可造成膽囊壁增厚,助手用常規重型抓鉗鉗夾時往往比較困難,常需要輔以“提”“推”的動作輔助暴露,必要時可更換為艾利斯鉗進行操作,以提供更好的咬合力。此外,膽囊周圍的組織粘連與增生的纖維條索可能形成假性管狀結構,影響對解剖結構的判斷,因此術中應耐心分離,仔細辨別。
隨著醫療技術的進步,超過72 h的急性膽囊炎已不再是腹腔鏡膽囊切除術的禁忌證,Roulin等[9]的一項薈萃分析結果顯示,超過72 h的急性膽囊炎確診后立刻行LC與先應用抗生素10~14 d控制炎癥后6周再行LC的患者相比,在手術時間、圍手術期并發癥方面差異無統計學意義,并縮短了抗生素使用時間、住院時間,減少了住院花費。本組行SILC時也適當放寬手術指征,未將72 h作為手術禁忌證,患者行常規化驗檢查排除手術禁忌證后均行SILC,統計結果顯示,急性膽囊炎與SILC手術時間延長獨立相關。本研究納入的病例中包括各種病理類型的急性膽囊炎。急性單純性、化膿性及壞疽性炎癥膽囊張力一般較大,導致助手鉗夾膽囊困難,通常需在腹腔鏡入腹后利用穿刺減壓針先行穿刺減壓,隨后助手用艾利斯鉗鉗夾膽囊,以防止術中滑脫。術中如不慎使膽汁或膿液外漏進入腹腔,膽囊剝離后可將其放入標本取出器后先取出腹腔,再重新置入操作器械進行徹底沖洗,必要時可留置腹腔引流管。急性炎癥后,膽囊周圍通常存在粘連,導致手術難度增加,分離此類粘連時應耐心謹慎,盡量從膽囊壁與周圍組織粘連的間隙開始分離,充分暴露膽囊的同時避免副損傷的發生(圖2~圖5)。壞疽性與穿孔性膽囊炎通常膽囊壁糜爛,但膽管系統依然質韌,因此遇解剖結構不清晰、無法辨認膽管結構時,質韌的管狀結構可成為重要提示,而且少數此類膽囊的膽囊動脈因受炎癥影響而發生閉鎖,導致術中無法找到膽囊動脈,最后只能放置引流管后結束手術,術后需密切觀察患者情況,防止腹腔出血的發生。以上這些原因均可增加手術時間及難度,并會提高并發癥的發生風險。
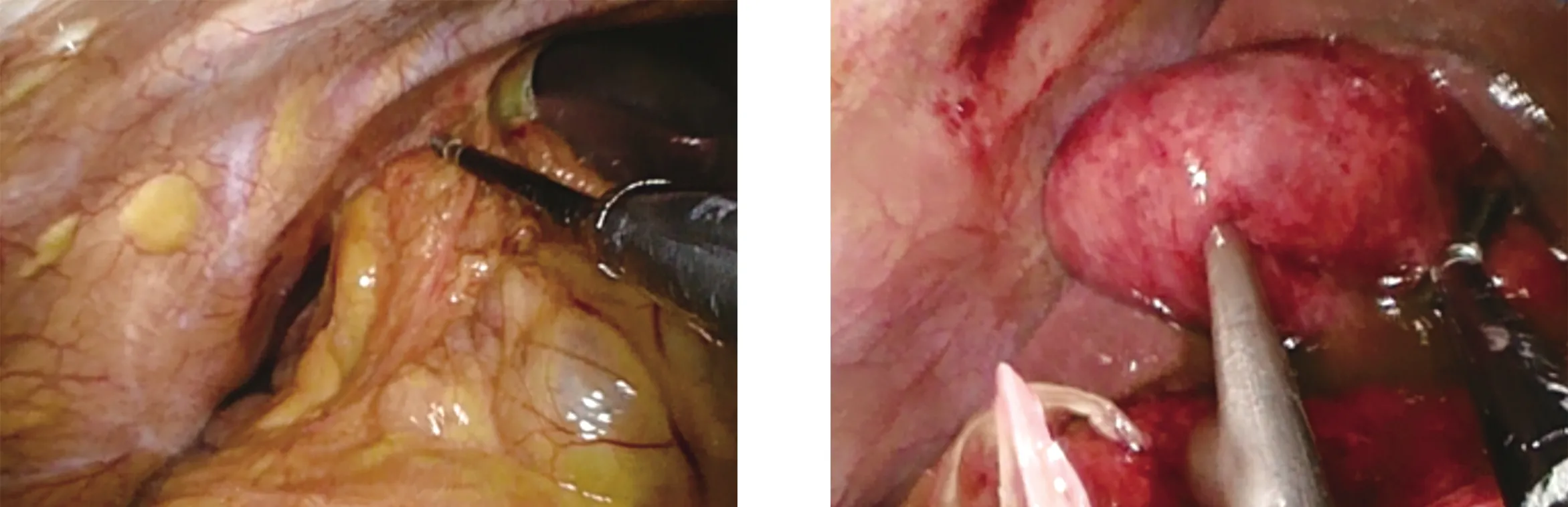
圖2 膽囊周圍粘連 圖3 膽囊穿刺減壓
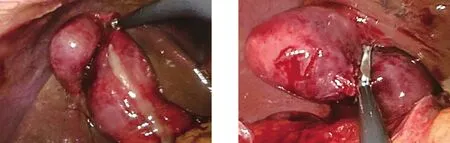
圖4 急性化膿性膽囊炎 圖5 艾利斯鉗鉗夾
膽囊炎癥反復發作及靜止性結石長期刺激膽囊壁可引起膽囊壁慢性纖維化增生形成瘢痕攣縮,進而導致膽囊萎縮并失去濃縮與排泄膽汁的正常生理功能[10-11]。萎縮性膽囊炎通常伴發膽囊區組織粘連、解剖位置改變與膽囊壁增厚等病理變化,造成腹腔鏡手術切除難度提高及損傷肝外膽管的風險增大,成為肝膽外科領域的難點[12]。對于膽囊周圍存在的粘連,疏松型可通過鈍性牽拉進行分離;致密型常需在電鉤或超聲刀銳性離斷的同時輔以鈍性牽拉,并且需要助手與術者的良好配合。對于膽囊三角區粘連,我們通常由后入路并緊靠壺腹部下方開始分離,避免造成重要血管、肝外膽管的損傷。萎縮性膽囊炎也可導致膽囊管攣縮變短,引起肝外膽管受牽拉上提靠近膽囊頸部并成角,當膽總管較細及膽囊三角區解剖不充分時,術者極易將成角下方的膽總管誤認為膽囊管而離斷[12],造成嚴重的醫療事故,因此術中應警惕此類情況發生,充分解剖膽囊三角區,仔細辨別重要解構。對于無法完全切除的困難型萎縮膽囊,近年以取盡結石、破壞膽囊腔、廢棄膽囊功能為原則的膽囊廢棄術可有效減少膽管損傷、中轉開腹及術中出血的發生,成為腹腔鏡下切除萎縮性膽囊的可選術式[13]。
此外,術者與助手的水平及配合程度同樣是影響SILC手術時間的關鍵因素。研究發現,經過規范培訓的主治醫師較住院醫師行LC的手術時間更短,但手術并發癥、中轉率及住院時間無顯著差異[14];在SILC術式中助手的作用類似于LC術中操作者的“左手”,在整個手術過程中具有非常重要的作用。本研究受限于我院SILC均由同一位醫師實施,并且缺乏不同助手術中表現情況的相關資料,因此未納入術者與助手因素對手術時間的影響。但筆者在參加助手培訓過程中體會,助手的難點主要在于掌握預彎器械的使用及適度的牽拉膽囊兩方面,助手在學習初期由于無法熟練掌握預彎器械在腹中的空間感,常導致抓取膽囊時間延長[15],進而導致手術時間延長。根據術中需求助手需向不同方向牽拉膽囊輔助術者操作,而且牽拉膽囊的張力要適度,張力過小會為術者分離組織造成困難,且無法提供充足的操作空間;張力過大可能導致膽囊床撕裂出血,影響手術視野。然而助手在學習初期為了提供更好的張力及操作空間,常在未調整好牽拉角度的情況下過度提拉膽囊導致撕裂出血,由此可見,助手不恰當地牽拉膽囊會增加手術難度,導致手術時間延長。
綜上所述,影響SILC手術時間延長的因素主要是BMI、上腹部手術史、急性炎癥期、膽囊壁厚度超過3 mm及萎縮性膽囊,術前評估上述因素有助于醫師預測手術難度、減少并發癥的發生及提高手術安全性。

