Wnt 5a在支氣管肺發育不良模型中的作用機制探討
李羽白,王軍△,殷靜
支氣管肺發育不良(broncho-pulmonary dysplasia,BPD)是極早產兒常見的不良結局。隨著孕婦糖皮質激素以及早產兒肺泡表面活性物質替代療法的廣泛應用,早產兒存活率顯著提高,但BPD發病率逐年上升[1]。已有研究表明Wnt信號通路在早期肺發育和肺部疾病中至關重要[2],但Wnt 5a 作為Wnt 信號通路中的關鍵因子在BPD中的作用鮮有報道。本研究采用Western blot 和胸腺嘧啶脫氧核苷類似物(EdU)染色法檢測BPD細胞和動物模型中肺泡表面標志物表面活性蛋白C(SPC)、水通道蛋白5(AQP5)、Wnt 5a 蛋白表達水平以及細胞增殖能力的變化,初步探討Wnt 5a在BPD發生發展中的作用及意義。
1 材料與方法
1.1 材料與試劑 人非小細胞肺癌細胞A549細胞系購自美國ScienCell Research Laboratiories 公司;SD 孕鼠購自浙江維通利華實驗動物技術有限公司[動物生產許可證號:SCXK(浙)2019-0001];胎牛血清、F12培養基、青霉素/鏈霉素溶液(Gibco,美國);蛋白裂解液RAPI、蛋白酶抑制劑Cocktail(Servicebio,中國);BCA 蛋白濃度測定試劑盒及BeyoClickTMEdU-488 細胞增殖檢測試劑盒(Beyotime,中國);兔源一抗SPC 抗體(Affinity,美國);兔源一抗AQP5 抗體(Bioworld,美國);兔源一抗Wnt 5a 抗體及鼠源一抗GAPDH 抗體(Proteintech,美國);辣根過氧化物酶標記的山羊抗兔二抗、辣根過氧化物酶標記的山羊抗鼠二抗(Servicebio,中國);Wnt 5a抑制劑HY-123071(MCE,中國)。
1.2 方法
1.2.1 細胞培養 A549 細胞采用含10%胎牛血清和1%青霉素/鏈霉素溶液的F12培養基于37 ℃、5%CO2中進行培養。在6 孔板中按照2×105個/孔種植細胞,24 h 細胞貼壁后將細胞分成2 部分。第一部分分2 組:對照組、BPD 組;第二部分分3 組:對照組、BPD 組、BPD+Wnt 5a 抑制劑組,Wnt 5a 抑制劑終濃度為5μmol/L。BPD 組和BPD+Wnt 5a 抑制劑組置于37 ℃、85%O2敷箱中培養48 h,對照組置于37 ℃、5%CO2的敷箱中培養48 h。
1.2.2 動物模型制備 將2 只SD 孕鼠所產的仔鼠按隨機數字表法分為對照組和BPD 組(各5 只)。BPD 組新生大鼠連同母鼠置于85%O2的密閉塑料箱中,溫度25~26 ℃、CO2體積分數<50%(堿石灰吸收CO2)、濕度50%~60%、每日開箱1 h添加水、飼料,更換墊料。對照組同母鼠置于同一室內環境(25~26 ℃、21%O2)中,其余條件同高氧保持不變。
1.2.3 標本的采集和處理 在BPD 組SD 大鼠高氧環境7 d后,2組大鼠行10%水合氯醛(0.05 mL/10 g)腹腔注射麻醉取肺。每只大鼠肺組織來源樣品分為2份:1份為200 mg,用于組織蛋白提取;剩余組織置于組織凍存管,-80 ℃冰箱凍存備用。對照組A549細胞在孵育72 h后,BPD組及BPD+Wnt 5a抑制劑組在高氧48 h后收取細胞,用蛋白裂解液和蛋白酶抑制劑提取蛋白。
1.2.4 肺組織形態學觀察 經HE 染色、掃描后使用CaseViewer軟件觀察2組大鼠肺組織形態學變化。
1.2.5 細胞和肺組織SPC、AQP5、Wnt 5a 蛋白表達檢測 將細胞及大鼠肺組織提取的蛋白測定蛋白濃度后,取30μg 變性蛋白進行Western blot:使用濃度為12%的SDS-PAGE分離目標蛋白質,然后通過濕轉將蛋白轉移至PVDF 膜中;用5%的脫脂奶粉室溫封閉2 h,1×TBST洗滌5 min后將PVDF膜置于經推薦稀釋濃度稀釋后的一抗中,4 ℃孵育過夜;1×TBST洗滌10 min×3次后將PVDF膜置于二抗中,室溫下孵育2 h;再次1×TBST洗滌10 min×3次后經化學發光(ECL)采集圖像。
1.2.6 細胞增殖水平檢測 采用EdU細胞增殖檢測試劑盒,嚴格按照試劑盒說明書操作。經EdU 與Hoechst 染色后,在熒光顯微鏡下觀察細胞并采集照片,增殖細胞呈現綠色熒光。每組選取5 張照片,使用Image J 軟件對結果進行量化(n=5):陽性細胞率=EdU 熒光染色細胞數/總細胞數×100%,然后將其標化統計。
1.3 統計學方法 采用GraphPad Prime 8 軟件進行數據分析。數據均以±s表示。2 組間均數比較采用t檢驗,多組間比較使用單因素方差分析,組間多重比較采用Dunnett-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 2組A549細胞SPC、AQP5蛋白表達量比較 A549細胞在高氧造模48 h 后SPC、AQP5 表達量降低,提示在BPD 組中肺泡Ⅰ型上皮和肺泡Ⅱ型上皮受損,見圖1。
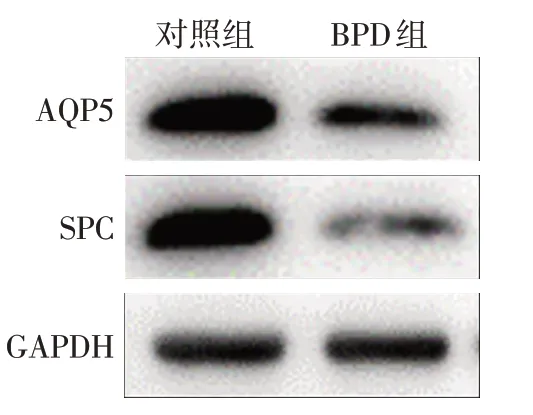
Fig.1 Changes of SPC and AQP5 expression levels in BPD cell model圖1 BPD細胞模型SPC、AQP5表達量變化
2.2 2組A549細胞增殖能力比較 與對照組相比,BPD組陽性細胞率(標化后)小于對照組陽性細胞率(0.42±0.08vs.0.83±0.10,t=7.214,P<0.01,n=5),高氧造模顯著抑制了A549細胞的生長,見圖2。
2.3 2組A549細胞Wnt 5a蛋白表達量比較 Western blot 結果顯示,A549 細胞在高氧造模48 h 后Wnt 5a表達量升高,提示Wnt 5a信號通路在BPD細胞模型中被激活,見圖3。
2.4 BPD動物模型中肺組織病理改變 結果顯示,BPD組較對照組肺泡面積增大、肺泡數量減少、肺泡間隔明顯增寬,BPD 高氧造模破壞了肺泡的形態功能,見圖4。
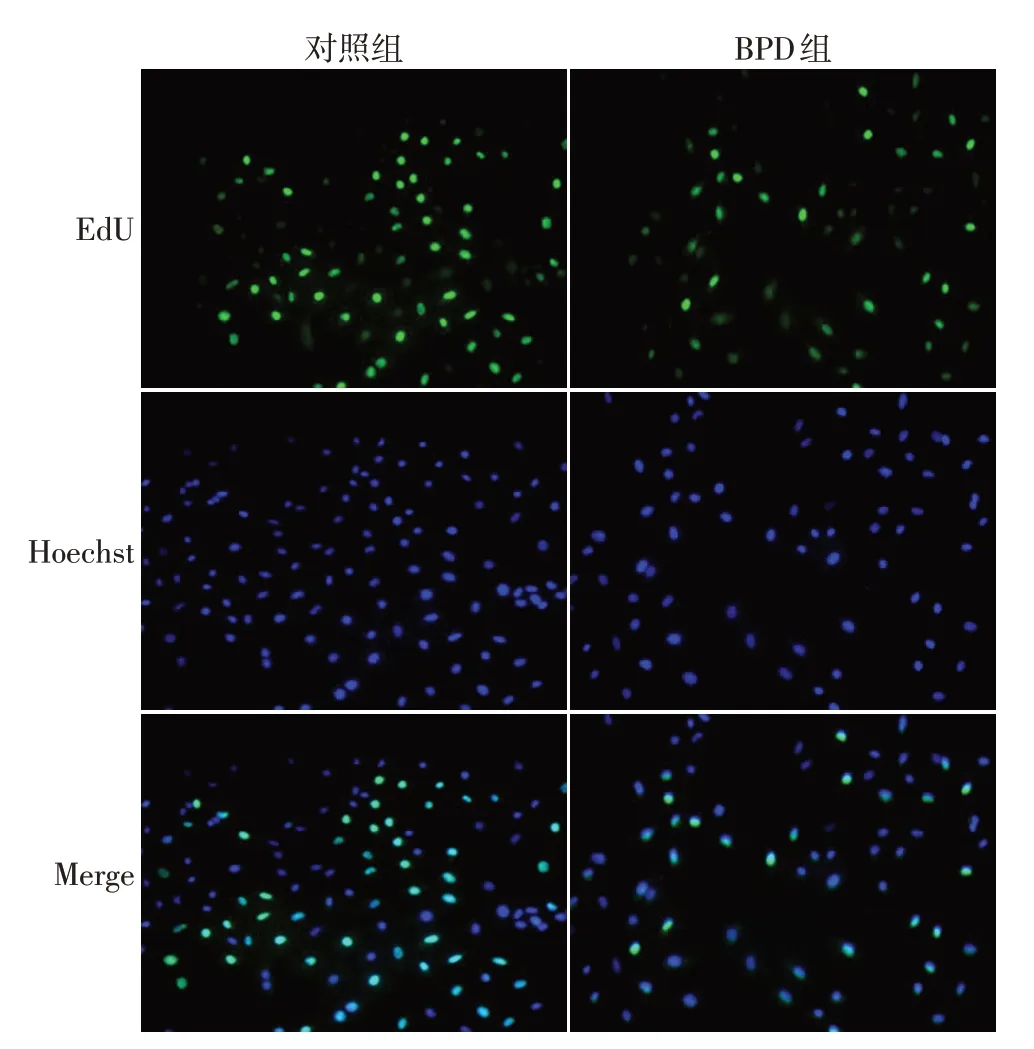
Fig.2 EdU changes in BPD cell model(×200)圖2 BPD細胞模型EdU變化(×200)
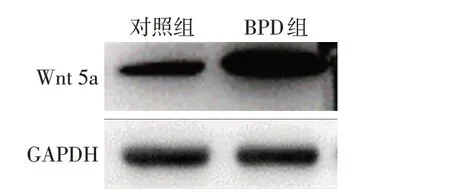
Fig.3 Changes of Wnt 5a expression levels in BPD cell model圖3 BPD細胞模型Wnt 5a表達量變化
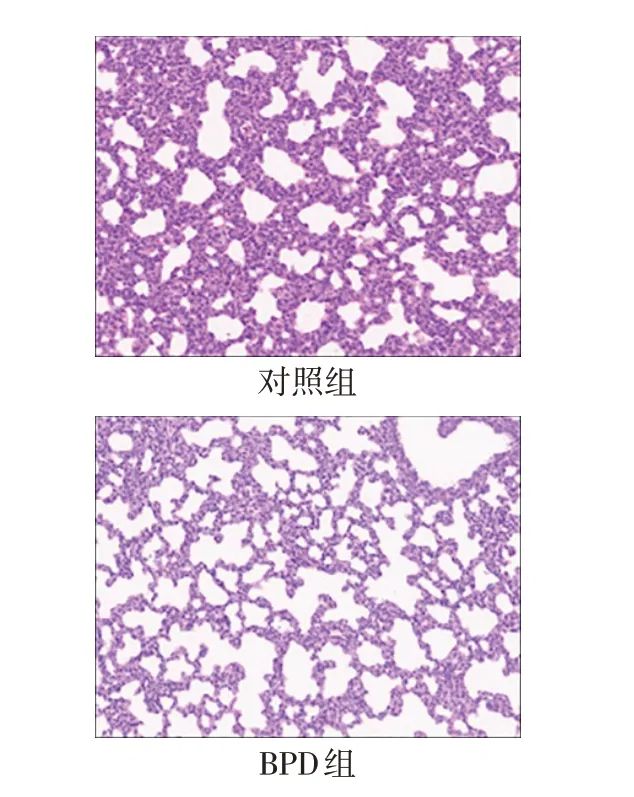
Fig.4 Pathological sections of rat lung tissue in the control group and BPD group(HE,×200)圖4 對照組與BPD組大鼠肺組織病理切片(HE,×200)
2.5 2組大鼠肺組織SPC、AQP5、Wnt 5a蛋白表達水平比較 Western blot 結果顯示,BPD 組SPC、AQP5蛋白表達量均低于對照組,而Wnt 5a蛋白表達高于對照組,與在細胞水平觀察結果一致,見圖5。
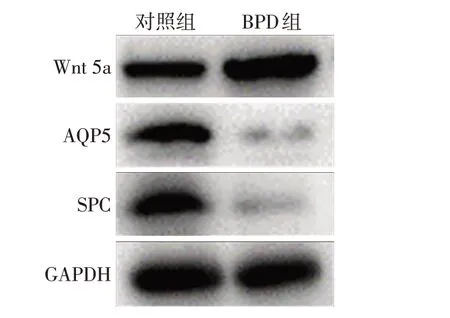
Fig.5 Changes of expression levels of SPC,AQP5 and Wnt 5A in BPD animal model圖5 BPD動物模型中SPC、AQP5、Wnt 5a表達量變化
2.6 Wnt 5a 抑制劑對BPD 細胞模型Wnt 5a、SPC、AQP5 蛋白表達的影響 Western blot 結果顯示,與BPD 組相比,BPD+Wnt 5a 抑制劑組A549 細胞Wnt 5a 蛋白表達量降低,SPC、AQP5 蛋白表達量增高,見圖6。
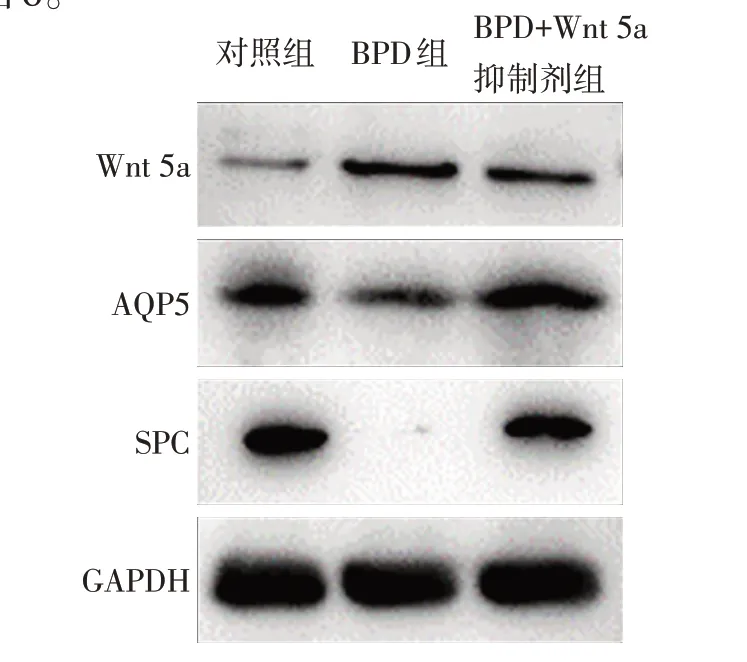
Fig.6 Expression changes of Wnt 5A,SPC and AQP5 in BPD cell model after treatment with Wnt 5a inhibitor圖6 應用Wnt 5a抑制劑后BPD細胞模型Wnt 5a、SPC、AQP5表達量變化
2.7 應用Wnt 5a抑制劑后各組A549細胞增殖能力比較 細胞增殖實驗結果顯示,經量化后對照組、BPD 組、BPD+Wnt 5a 抑制劑組陽性細胞率分別為0.81±0.12、0.36±0.09、0.52±0.01,差異有統計學意義(F=34.270,P<0.01)。對照組EdU熒光染色細胞數/總細胞數陽性細胞率大于BPD 組(P<0.01);BPD+Wnt 5a 抑制劑組較BPD 組升高(P<0.05)。可見在高氧造模條件下阻斷Wnt 5a 信號通路后肺泡上皮細胞損傷減小,細胞增殖能力恢復,見圖7。
3 討論
3.1 防治BPD 的重要性 有調查顯示2017 年江蘇省19 家醫院胎齡<34 周早產兒BPD 的發病率為24.9%[3],是國內2006—2008 年10 家醫院回顧性調查的發病率(4.2%)的4.9倍[4]。因此,BPD仍然是嬰幼兒健康的一大威脅。感染、炎癥、胎兒生長受限、孕婦并發子癇前期、機械通氣和氧療、動脈導管未閉以及遺傳因素等被認為是BPD 的高危影響因素,但具體發病機制仍不清楚[1]。嚴重BPD患兒可因呼吸衰竭而死亡[5]。存活的BPD患兒在兒童期也更易發生感染和肺功能下降[6]。Wnt 5a在早期肺發育及肺部疾病中發揮重要作用,但Wnt 5a在BPD中的研究卻鮮有報道,探究Wnt 5a在BPD模型中的作用可能為防治BPD提供新思路。
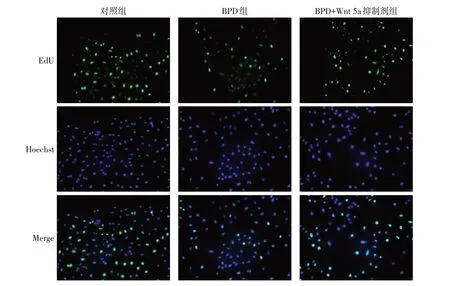
Fig.7 EdU changes in BPD cell model after treatment with Wnt 5a inhibitor(×200)圖7 應用Wnt 5a抑制劑后BPD細胞模型EdU變化(×200)
3.2 Wnt 5a 蛋白廣泛參與肺發育及肺部疾病的發生 Wnt 信號通路是早期肺發育、肺泡形成及損傷修復的重要調控途徑,依據是否激活β 連環素分為β 連環素依賴的Wnt 經典信號通路和非β 連環素依賴的Wnt非經典信號通路。Wnt 5a是非經典Wnt信號通路的配體之一,廣泛參與肺形態的形成和肺部疾病的發生。在肺發育早期,Wnt 5a 缺失會導致遠端氣道分支過多,而Wnt 5a過表達可干擾正常上皮間充質相互作用,導致遠端氣道分支和擴張減少[7]。在小鼠膿毒癥致新生小鼠肺發育急性肺損傷中,血清Wnt 5a 水平隨肺損傷嚴重程度加深而升高[8];在小鼠哮喘肺組織中Wnt 5a mRNA 和蛋白水平升高[9];同時,慢性阻塞性肺疾病和肺纖維化時Wnt 5a表達亦升高[10-11]。
3.3 Wnt 5a 在BPD 造模過程中異常激活 Wnt 5a在肺發育早期和肺疾病中的作用提示其可能參與了BPD的發生發展。本研究通過高氧誘導的BPD細胞和動物模型來模擬疾病在人體中的表現,高氧對新生大鼠和A549 細胞的刺激常用于制作實驗性動物模型和細胞模型。肺的發育分為胚胎期、假腺期、小管期、囊狀期和肺泡期5 個階段。新生大鼠肺發育相當于極早產兒肺發育的囊狀期,將新生大鼠用于制作動物模型符合早產兒發生BPD 的病理條件[12]。通過Western blot 和EdU細胞增殖實驗發現,在BPD細胞模型和動物模型中AQP5 和SPC 蛋白表達量降低,Wnt 5a 蛋白表達量升高,細胞增殖能力減弱。AQP5 和SPC 分別為肺泡Ⅰ型上皮細胞(AECⅠ)和AECⅡ表面標志蛋白,其表達量變化反映AECⅠ和AECⅡ損傷修復的變化[13]。在應用Wnt 5a抑制劑后AQP5、SPC 蛋白表達量有所升高,細胞增殖能力也有所恢復。上述結果提示在高氧造成的肺泡上皮細胞損傷過程中Wnt 5a 信號通路被激活,表明Wnt 5a異常激活參與了BPD 的發生發展,同時也為防治BPD提供了新思路。在85%高氧造模的動物模型和對照組動物病理切片中,高氧動物模型肺組織肺泡面積增大,肺泡數量減少,肺泡間隔明顯增寬,同以往研究結論一致[14],提示BPD 的動物造模成功。在既往研究中發現,AECⅡ可作為肺泡上皮細胞的祖細胞,在肺泡上皮細胞受到損傷后AECⅡ可向AECⅠ轉化,是BPD肺組織損傷修復的重要機制,即SPC表達降低、AQP5表達增加[15]。這與本研究結果不一致,可能是因為損傷中后期AECⅡ向AECⅠ轉化不足以代償AECⅠ的損傷,導致AECⅠ、AECⅡ在高氧后同時受損。
Wnt 5a可通過非經典Wnt信號通路或者抑制經典信號通路發揮作用,但本研究未能進一步闡明Wnt 5a 在BPD 模型中如何發揮作用,這也將是后續研究中需要探究的問題。

