Exendin-4對hIAPP誘導的胰島β細胞凋亡的保護作用
劉辰,梁倩雯,趙濟全
2型糖尿病的主要特征為胰島β細胞數量減少、胰島素分泌減少以及胰島淀粉樣多肽(islet amyloid polypeptide,IAPP)蛋白沉積[1-2]。人源胰島淀粉樣多肽(human IAPP,hIAPP)是由胰島β細胞合成的具有37 個氨基酸殘基的短肽,與胰島素協同分泌[3]。hIAPP 的過度沉積不僅影響胰島素的正常分泌,而且能夠促進胰島β 細胞的凋亡,從而導致2 型糖尿病的發生[4]。研究表明,細胞膜功能紊亂、線粒體氧化應激參與了hIAPP誘導的胰島β細胞凋亡過程[5]。Exendin-4 是一種發現于希臘毒蜥毒液的短腸促胰島素多肽,含有39 個氨基酸殘基,與胰高血糖素樣肽-1(GLP-1)在結構上具有53%的同源性,屬于GLP-1 受體長效激動劑[6]。近年來研究發現,Exendin-4 可以通過多種途徑改善胰島β 細胞的功能,起到治療糖尿病的作用[7-8]。本研究旨在探討Exendin-4 在體外對hIAPP 誘導的胰島β 細胞凋亡的保護作用及其可能的分子機制。
1 材料與方法
1.1 材料 小鼠胰島β細胞INS-1E由本實驗室保存;hIAPP購自南京肽谷生物科技有限公司;Exendin-4 購自MedChemExpress 公司;胎牛血清、RPMI 1640 培養基購自美國Gibco公司;青霉素-鏈霉素購自美國HyClone公司;CCK-8細胞增殖毒性檢測試劑盒、BCA 定量試劑盒、乳酸脫氫酶(LDH)檢測試劑盒、腺苷三磷酸(ATP)檢測試劑盒、JC-1 線粒體膜電位檢測試劑盒購自北京碧云天公司;鼠源Bcl-2、Bax、Bad、Tubulin 一抗及二抗購自武漢Proteintech 公司;PVDF 膜、ECL 發光液購自美國Millipore 公司。細胞培養箱購自青島海爾公司;電泳、轉膜裝置購自美國Bio-Rad 公司,多功能酶標儀購自英國PerkinElmer公司,全自動化學發光成像分析系統購自上海天能公司;流式細胞儀購自美國BD公司。
1.2 方法
1.2.1 細胞培養及藥物配制 將INS-1E細胞置于含10%胎牛血清、100 U/mL 青霉素、100 mg/L 鏈霉素的RPMI 1640 培養基中,37 ℃、5%CO2飽和濕度培養箱中培養至對數生長期。稱量hIAPP和Exendin-4粉末,加適量超純水,配制成1 mol/L母液,分裝保存。實驗前,取一定量母液用細胞培養液稀釋成實驗所需濃度的工作液,冷藏保存。
1.2.2 CCK-8法分析hIAPP誘導細胞凋亡以及Exendin-4的保護作用 取對數生長期的INS-1E細胞,按照4×103個/孔接種于96 孔板,培養過夜后棄掉培養基,加入含有2.5、5、10、20 μmol/L hIAPP 的完全培養基培養48 h,建立hIAPP 誘導INS-1E 細 胞 凋 亡 模 型。之 后 用20、50、100 nmol/L 的Exendin-4預處理細胞24 h篩選Exendin-4的有效濃度,每孔加入10 μL 的CCK-8 試劑,繼續培養2 h。用酶標儀在450 nm 處測定各組光密度(OD)值。實驗重復3 次,取3 孔平均值。按照公式計算細胞增殖率,細胞增殖率=[(對照組平均OD值-實驗組平均OD值)/空白組平均OD值]×100%。
1.2.3 細胞LDH釋放檢測 將對數生長期細胞接種于96孔板,分 為 空 白 組、Exendin-4 組、hIAPP 模 型 組、hIAPP+Exendin-4 組以及陽性對照組(LDH 釋放試劑)。Exendin-4預處理24 h后加入hIAPP處理48 h。將細胞培養板用多孔板離心機300×g離心5 min。分別取各孔的上清液120μL,加入到新的96 孔板中,每孔加入60 μL 的LDH 檢測工作液,在490 nm處測定OD值。實驗重復3次,取3孔平均值。
1.2.4 細胞內ATP 檢測 細胞接種于6孔板,實驗分為空白組、Exendin-4 組、hIAPP 模 型 組、hIAPP+Exendin-4 組。Exendin-4預處理24 h后加入hIAPP處理48 h。去除培養液,用預冷PBS 清洗,加入200 μL 裂解液,裂解細胞。裂解后4 ℃、12 000×g離心5 min,取適量上清液加入到新的檢測板內,隨后立即加入ATP檢測工作液,震蕩混勻,用化學發光儀進行檢測。實驗重復3 次,取3 孔平均值。根據ATP 標準品繪制標準曲線,計算ATP的濃度。
1.2.5 JC-1 熒光探針法檢測線粒體膜電位 細胞分組處理同1.2.4,處理48 h 后,消化細胞并重懸于1 mL 細胞培養液中,加入1 mL JC-1 染色工作液,顛倒混勻,細胞培養箱中孵育20 min。孵育結束后,500×g、4 ℃離心3 min收集細胞。用JC-1染色緩沖液洗滌2次,沉淀細胞,棄上清液,再用適量的JC-1染色緩沖液重懸細胞,流式細胞儀上機檢測。根據紅綠色熒光的比例分析線粒體膜電位的變化。實驗重復3次。
1.2.6 Western blot 檢測相關蛋白表達 分組同1.2.4,各組相應處理48 h后,用RIPA裂解液裂解細胞,BCA蛋白定量試劑盒進行蛋白定量,加入5×上樣緩沖液后煮沸5 min。應用SDS-PAGE電泳進行蛋白分離,半干法電轉運至PVDF膜,室溫封閉1 h,分別加入一抗抗體Bcl-2(1∶1 000)、Bax(1∶1 000)、Bad(1∶2 000),Tubulin(1∶10 000),4 ℃孵育過夜。TBST洗滌后,二抗室溫孵育1 h,加入ECL 發光液,使用天能成像系統檢測發光情況。用Image J 軟件對目的蛋白條帶進行灰度值分析,計算相對表達量。
1.3 統計學方法 采用軟件GraphPad 7.0 進行數據分析。符合正態分布的計量資料用均數±標準差(±s)表示,多組間均數比較用單因素方差分析,組間多重比較采用Tukey’s 檢驗,P<0.05為差異有統計學意義。
2 結果
2.1 Exendin-4 抑制hIAPP 誘導的INS-1E 細胞凋亡 終濃度為5、10、20μmol/L的hIAPP作用于INS-1E細胞48 h后,細胞的增殖率分別下降了23%、50%和67%(P<0.05),見圖1。選擇20μmol/L作為凋亡誘導的實驗濃度。終濃度為20、50 和100 nmol/L 的Exendin-4 預處理24 h 后加入hIAPP,結果顯示,50和100 nmol/L 的Exendin-4 可有效緩解由hIAPP 導致的細胞凋亡(P<0.01),見圖2,后續采用50 nmol/L的Exendin-4為實驗濃度。
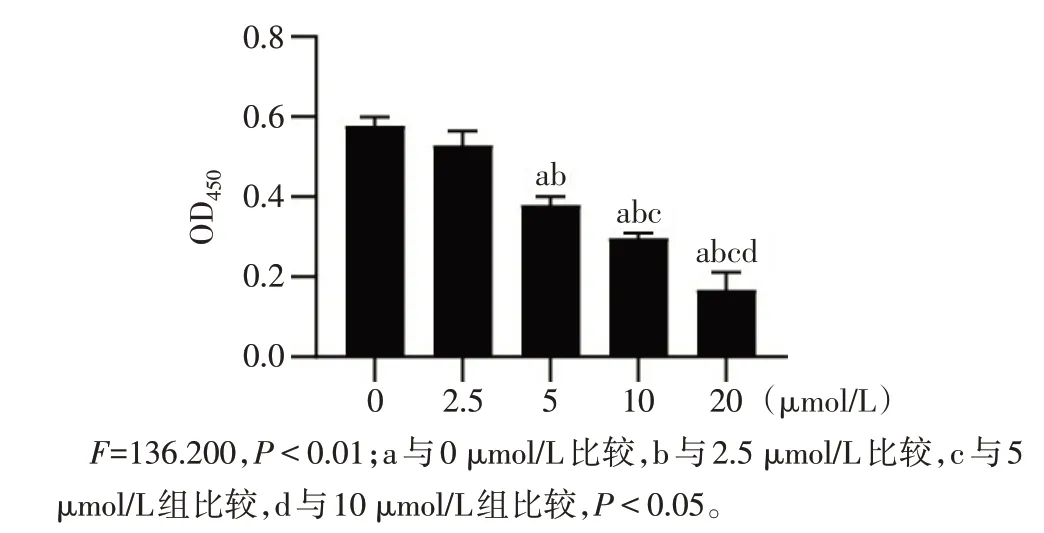
Fig.1 Effects of different concentrations of hIAPP on apoptosis of INS-1E cells圖1 不同濃度hIAPP對INS-1E細胞凋亡的影響
2.2 Exendin-4 抑制hIAPP 誘導的INS-1E 細胞內LDH 釋放 與空白組比較,hIAPP 模型組顯著增加細胞LDH 的釋放(P<0.05),而Exendin-4 預處理后能夠明顯降低細胞外LDH 的水平(P<0.05),Exendin-4組對LDH釋放無影響,見圖3。
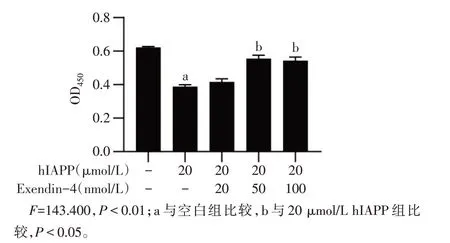
Fig.2 The effects of Exendin-4 on hIAPP induced apoptosis ofINS-1E cells圖2 不同濃度Exendin-4對hIAPP誘導的INS-1E細胞凋亡的影響
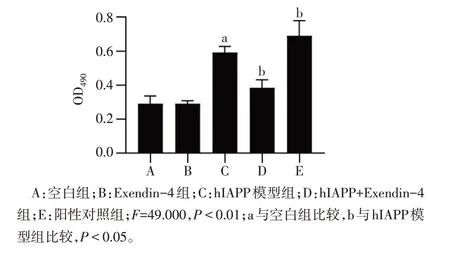
Fig.3 Changes of LDH release level of INS-1E cells in each group圖3 各組INS-1E細胞LDH釋放水平變化
2.3 Exendin-4 減少hIAPP 導致的INS-1E 細胞 內ATP 消耗 與空白組比較,hIAPP 模型組明顯增加細胞內ATP 的消耗(P<0.01),而Exendin-4 預處理后能夠緩解由hIAPP 導致的細胞內ATP 的消耗,Exendin-4組對ATP的生成無影響,見圖4。
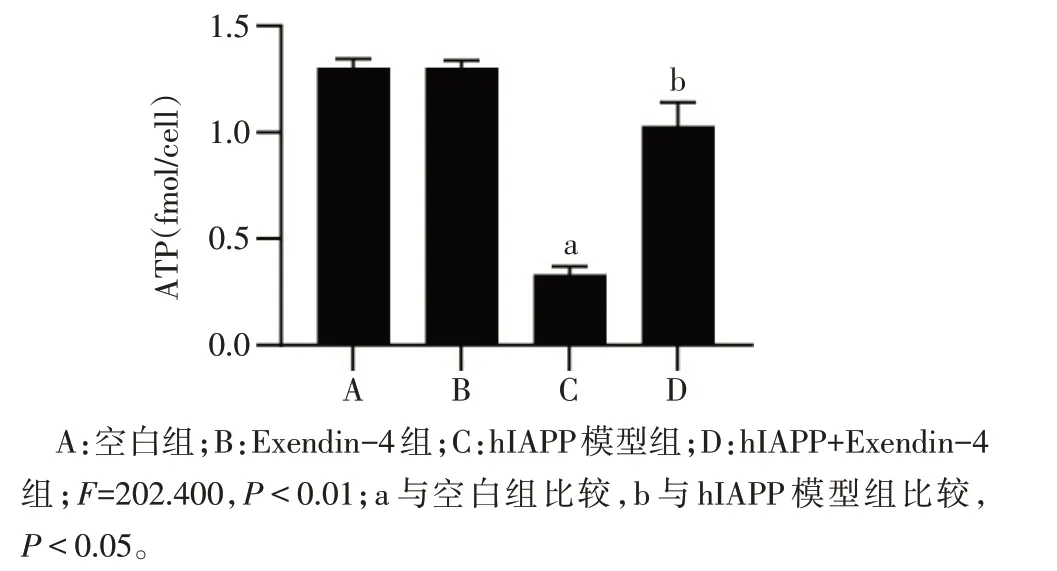
Fig.4 Comparison of the ATP consumption in INS-1E cells in each group圖4 各組INS-1E細胞內ATP消耗情況比較
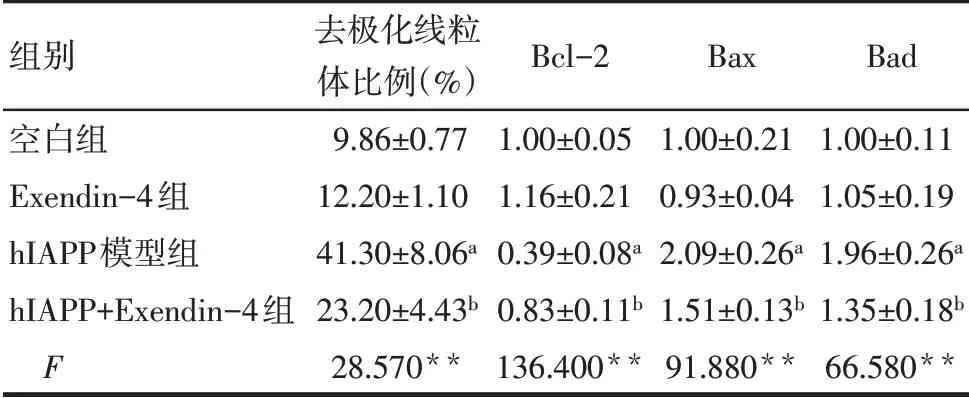
2.4 Exendin-4阻止hIAPP誘導的INS-1E細胞線粒體膜電位丟失 結果顯示,hIAPP處理后,去極化線粒體的比例明顯高于空白組,hIAPP 導致了線粒體膜電位的丟失,而Exendin-4預處理后能夠顯著降低去極化線粒體的比例,抵抗細胞凋亡,Exendin-4 組對線粒體膜電位無明顯影響,見圖5、表1。

Fig.5 Comparison of mitochondrial membrane potential loss between four groups of INS-1E cells圖5 各組INS-1E細胞線粒體膜電位丟失情況比較
Tab.1 Comparison of apoptosis related protein expression levels between the four groups of INS-1E cells表1 各組INS-1E細胞凋亡相關蛋白表達水平變化比較(n=3,±s)
Tab.1 Comparison of apoptosis related protein expression levels between the four groups of INS-1E cells表1 各組INS-1E細胞凋亡相關蛋白表達水平變化比較(n=3,±s)
**P<0.01;a與空白組比較,b與hIAPP模型組比較,P<0.05。
組別空白組Exendin-4組hIAPP模型組hIAPP+Exendin-4組F去極化線粒體比例(%)9.86±0.77 12.20±1.10 41.30±8.06a 23.20±4.43b 28.570**Bcl-2 1.00±0.05 1.16±0.21 0.39±0.08a 0.83±0.11b 136.400**Bax 1.00±0.21 0.93±0.04 2.09±0.26a 1.51±0.13b 91.880**Bad 1.00±0.11 1.05±0.19 1.96±0.26a 1.35±0.18b 66.580**
2.5 Exendin-4調控線粒體凋亡途徑相關蛋白的表達 與空白組相比,hIAPP模型組抗凋亡蛋白Bcl-2表達水平下降,促凋亡蛋白Bax和Bad的表達水平升高,Exendin-4預處理后能顯著上調Bcl-2的表達,同時下調Bax和Bad的表達,見表1、圖6。
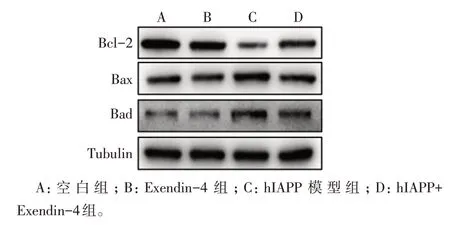
Fig.6 The apoptosis-related protein expression levels of INS-1E cells in each group圖6 各組INS-1E細胞凋亡相關蛋白表達水平
3 討論
胰島素在糖尿病的治療過程中起著至關重要的作用。胰島β 細胞是內源性胰島素產生的唯一來源,其功能正常是維持體內血糖和代謝平衡的重要因素。研究發現約40%的2型糖尿病患者胰島中有大量的淀粉樣蛋白沉積[9],經鑒定其主要成分是IAPP[10]。目前IAPP 被認為是聚集性較強的多肽之一,當血糖升高時,IAPP 濃度成倍增加,由于hIAPP是由胰島β 細胞分泌,其在胰島周圍的濃度要顯著高于血液中的濃度[11]。研究發現,胰島周圍高濃度的hIAPP 通過形成大量淀粉樣沉積進而導致胰島β細胞的凋亡以及功能紊亂[12]。對于由hIAPP沉積引起的細胞凋亡的具體機制尚不明確。目前研究認為其可能通過激活c-Jun 氨基末端激酶(JNK)和絲裂原活化蛋白激酶(MAPK)信號通路,誘導細胞凋亡[13-14]。本研究結果顯示,隨著hIAPP濃度的增加,INS-1E 細胞增殖活性明顯降低,表明hIAPP 的聚集可以抑制INS-1E 細胞增殖。LDH 是存在于細胞中的一種穩定酶,當質膜損傷后迅速釋放到細胞培養基中,是反映細胞毒性的標志物。本研究發現hIAPP可以加速INS-1E細胞中LDH的釋放,促進細胞凋亡。
研究表明,胰腺中GLP-1及其類似物Exendin-4能夠促進胰島β細胞增殖,抑制β細胞凋亡,刺激胰島素的合成以及分泌;而在肝臟、肌肉及脂肪組織中,GLP-1則能夠促進葡萄糖的吸收,并增加肝臟的胰島敏感性;此外,GLP-1還通過抑制胃排空來增加飽腹感[7]。但是對于Exendin-4能否改善由IAPP 聚集引起的β細胞凋亡及其機制還缺乏研究。本研究發現,Exendin-4可以促進胰島β細胞的增殖并且明顯減少由IAPP 導致的細胞內LDH 釋放,提示Exendin-4具有改善IAPP誘導的細胞凋亡的作用。
根據激活方式和信號分子通路的不同,細胞凋亡可分為外源性途徑的細胞凋亡和內源性途徑的細胞凋亡(也稱為線粒體途徑的細胞凋亡)[15]。內源性途徑的細胞凋亡是糖尿病胰島β細胞死亡的一種主要方式[16]。線粒體膜電位丟失是內源性細胞凋亡的重要特征,會影響線粒體ATP 的產生以及誘導促凋亡因子的釋放[17]。在本研究中,INS-1E 細胞接觸hIAPP后會損傷線粒體功能,抑制ATP的產生,并導致線粒體膜電位嚴重丟失,去極化比例增加。而Exendin-4可以有效增加ATP的含量,并且恢復線粒體膜電位至正常水平。
Bcl-2蛋白家族由抗凋亡和促凋亡成員構成,這些家族蛋白彼此間相互作用維持平衡來共同調控線粒體功能,在線粒體途徑的凋亡發生過程中具有關鍵作用[18-19]。促凋亡蛋白Bax 和Bad 能通過增加線粒體膜的通透性加速細胞凋亡。而抗凋亡蛋白成員Bcl-2 可以維持線粒體外膜的完整性。抗凋亡蛋白和促凋亡蛋白表達水平的平衡是維持線粒體膜電位的重要因素[20]。已有研究結果顯示,Exendin-4可以通過調節ERK1/2 通路保護棕櫚酸酯毒性誘導的細胞凋亡[21]。本實驗中,Exendin-4 能夠明顯抑制hIAPP導致的Bcl-2蛋白表達下調以及Bax和Bad蛋白表達上調。
綜上所述,Exendin-4可以通過線粒體途徑改善由hIAPP 聚集導致的胰島β 細胞凋亡,其作用機制可能與Exendin-4 調控線粒體膜電位和凋亡相關蛋白表達有關。本研究為Exendin-4 的臨床應用提供了新的理論依據。

