大鼠缺血性腦卒中早期miR-27a表達與鐵死亡的關系
張婧,孫輝,朱禮軍,馮子人,杜琳,孟愛國
2020 年我國40歲以上人群中卒中患者約1 780萬人,其中新發腦卒中患者高達340萬人[1]。臨床上針對缺血性腦卒中的治療主要為藥物溶栓療法和手術取栓治療[2],因時間窗等因素限制,只有少數患者可從中獲益。鐵死亡(Ferroptosis)是近年來新發現的一種非細胞凋亡性的程序性細胞死亡方式,是鐵依賴性的脂質過氧化物積累的結果[3]。研究發現,鐵死亡在神經系統性疾病的發生發展過程中發揮重要作用,調控細胞鐵死亡可能會成為預防和治療腦卒中的新方法[4-5]。微小RNA(miRNA,miR)主要與靶基因mRNA的3'-非編碼區結合,通過降解靶基因mRNA或抑制其翻譯來控制靶基因在轉錄水平的表達[6]。本課題組前期研究表明,miRNA 參與調節了缺血性腦損傷的進展,且miRNA表達的動態變化與腦組織損傷進展密切相關[7-8]。另有研究發現,在大鼠腦皮層神經元擬缺血損傷模型中,miR-27a 參與缺血性腦血管疾病發病過程[9]。然而miR-27a在其中具體的作用機制尚不清楚。本研究采用大鼠大腦中動脈栓塞(MCAO)模型,觀察miR-27a 表達及鐵死亡變化情況,探討兩者間的關系。
1 材料與方法
1.1 實驗動物 8 周齡SPF 級雄性SD 大鼠88 只,體質量250~280 g,購自北京華阜康科技有限公司,生產許可證號:SCXK(京)2020-0004;大鼠飼養于華北理工大學實驗動物中心,使用許可編號:SYXK(冀)2015-0038。
1.2 試劑與儀器 線栓(L0000)購自廣州佳靈生物技術有限公司;ago-miR-27a 以及antago-miR-27a 購自廣州銳博生物科技有限公司;二甲基亞砜(DMSO)購自梯希愛(上海)化成工業發展有限公司,鐵死亡特異性抑制劑Ferrostatin-1(純度≥90%,17729)購自美國Cayman Chemical公司;TTC溶液購自北京雷根生物技術有限公司;谷胱甘肽過氧化物酶4(GPX4)一抗購自武漢ABclonal 公司;β-actin 一抗購自北京博奧森;辣根過氧化物酶標記的抗兔IgG 二抗購自北京中杉金橋;超敏ExPlus ECL化學發光檢測試劑購自北京莊盟國際生物基因科技有限公司;谷胱甘肽(GSH)、組織鐵和丙二醛(MDA)檢測試劑盒購自南京建成生物工程研究所;RNA提取試劑盒購自北京金百特生物技術有限公司;反轉錄試劑盒(ZR102-1)、2×SYBR qPCR Mix(熒光定量)試劑盒(ZF102-2)購自北京莊盟國際生物基因科技有限公司。
1.3 分組及給藥 將88只大鼠按隨機數字表法分成以下11組,每組8 只。實驗1 設正常(control)組、假手術(Sham)組、模型組(按照缺血時間不同,分為6 h組、12 h組、24 h組、48 h組)。實驗2設缺血48 h組(I 48 h組)、缺血48 h+Ferrostatin-1 組(I 48 h+Fer-1 組,于手 術 前2 h 腹腔注射0.5 mL 的Ferrostatin-1,按2 mg/kg 給藥)、缺血48 h+DMSO 組(I 48 h+DMSO組,于手術前2 h腹腔注射0.5 mL DMSO)。實驗3設缺血48 h 組(I 48 h 組)、I 48 h+陰性對照(NC)組、缺血48 h+miR-27a激動劑組(I 48 h+ago-miR-27a組)、缺血48 h+miR-27a抑制劑組(I 48 h+antago-miR-27a組);于術前7 d開始向側腦室分別注射陰性對照試劑(20 μmol/L)、ago-miR-27a(20 μmol/L)、antago-miR-27a(20 μmol/L),每日1 次,連續5 d,給藥量為5μL。術后48 h處死大鼠并取材。
1.4 大鼠造模 利用2%戊巴比妥鈉(30 mg/kg)腹腔麻醉動物。麻醉滿意后行頸正中切口,充分暴露頸動脈后,小心將迷走神經與頸總動脈分離,結扎頸總動脈和頸外動脈,線栓經頸內動脈至大腦中動脈,形成大鼠半腦缺血。所有手術均為左側大腦中動脈栓塞,模型組的缺血時間分別為6、12、24、48 h,經藥物干預的大鼠缺血時間為48 h。假手術組只經頸正中切口,不栓塞大腦中動脈。成功造模標志:術后清醒但不能直線行走,出現右側偏癱,神經功能學評分1~4分。
1.5 腦組織TTC染色 大鼠在腦缺血后相應時間點,立即處死并于冰上取腦組織,迅速放入-20 ℃冰箱冷凍30 min,其后將冷凍的大鼠腦組織切成2 mm 厚的5個冠狀切片。隨后將腦片置于TTC 溶液中,37 ℃放置15 min,翻面繼續于TTC 染液中避光浸染15 min。染色完成后,腦組織通過4%多聚甲醛固定1 d,后拍照留存。使用Image J 軟件進行分析以計算大鼠的腦梗死面積,用梗死面積的百分比(%)表示。缺血區面積比=(腦切片白色缺血區域面積)/(腦切片總面積)×100%。
1.6 Western blot檢測GPX4蛋白表達 稱取凍存的腦組織,每50 mg加入0.2 mL組織裂解液(每1 mL組織裂解液中加入0.01 mL 的蛋白酶抑制劑)進行組織蛋白提取。待蛋白提取完成后,對其進行SDS-PAGE,后將膠中蛋白轉到PVDF 膜上。5%脫脂牛奶封閉2 h,洗膜后于GPX4 抗體(1∶1 000)中4 ℃孵育過夜。加入含有辣根過氧化物酶的二抗(1∶5 000)室溫孵育2 h,滴加配置好的ECL顯色液,后通過全自動化學發光圖像分析儀掃描并保存結果圖像。經Image J 軟件分析所顯出的蛋白圖像灰度值,以β-actin作為內參蛋白,計算出目的蛋白的相對表達量。
1.7 腦組織GSH、組織鐵和MDA 含量檢測 稱取0.1 g腦組織,加入0.9 mL 的勻漿介質,冰水浴中剪碎、研磨,制成10%的勻漿液,2 500 r/min離心15 min,吸取上清液。嚴格按照檢測試劑盒說明進行相應操作,計算GSH、組織鐵和MDA含量。
1.8 qPCR 檢測miR-27a 的相對表達量 根據RNA 提取試劑盒說明書,嚴格進行大鼠腦組織中總RNA的提取,在波長為260 nm 和280 nm 處測量吸光度,計算RNA 純度和總量。經反轉錄后得到cDNA,保存于-20 ℃冰箱。使用qPCR法進行擴增,擴增引物序列見表1。PCR條件:94 ℃預變性3 min;94 ℃15 s,60 ℃30 s,72 ℃30 s,40 個循環;72 ℃7 min。選擇U6 snRNA 作為miR-27a 檢測的標準化內參,使用相對定量2-ΔΔCt的循環閾值法計算miR-27a的相對表達量。
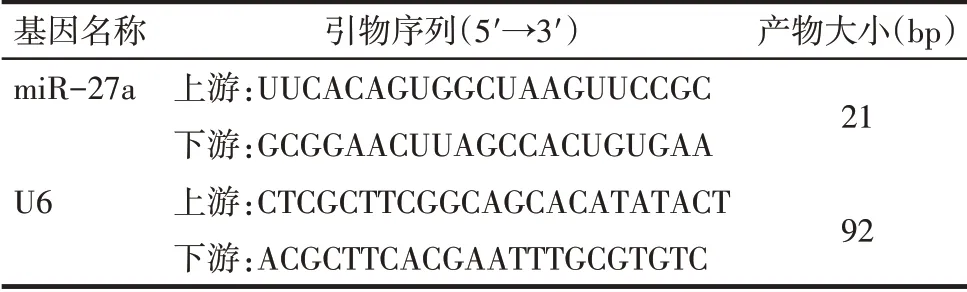
Tab.1 Primer sequences for qPCR表1 qPCR引物序列
1.9 統計學方法 采用SPSS 17.0 對結果進行統計學分析,計量數據以均數±標準差(±s)表示,結果數據符合正態分布,多組結果比較用單因素方差分析,多重比較用LSD-t檢驗,以P<0.05為差異有統計學意義。
2 結果
2.1 大鼠缺血性腦卒中早期腦組織中miR-27a 表達及鐵死亡水平變化 與Sham組比較,各模型組大鼠神經功能評分增加(P<0.05),提示造模成功,見圖1A。與Sham組比較,隨著缺血時間的延長,各模型組腦組織中miR-27a的表達增多,GPX4和GSH含量下降,組織鐵和MDA 的含量升高(P<0.05)。其中在缺血48 h 組變化最為明顯,在后續實驗中選擇此時點進行缺血干預。與Control組相比,Sham組中上述結果變化差異無統計學意義。見圖1、2,表2。
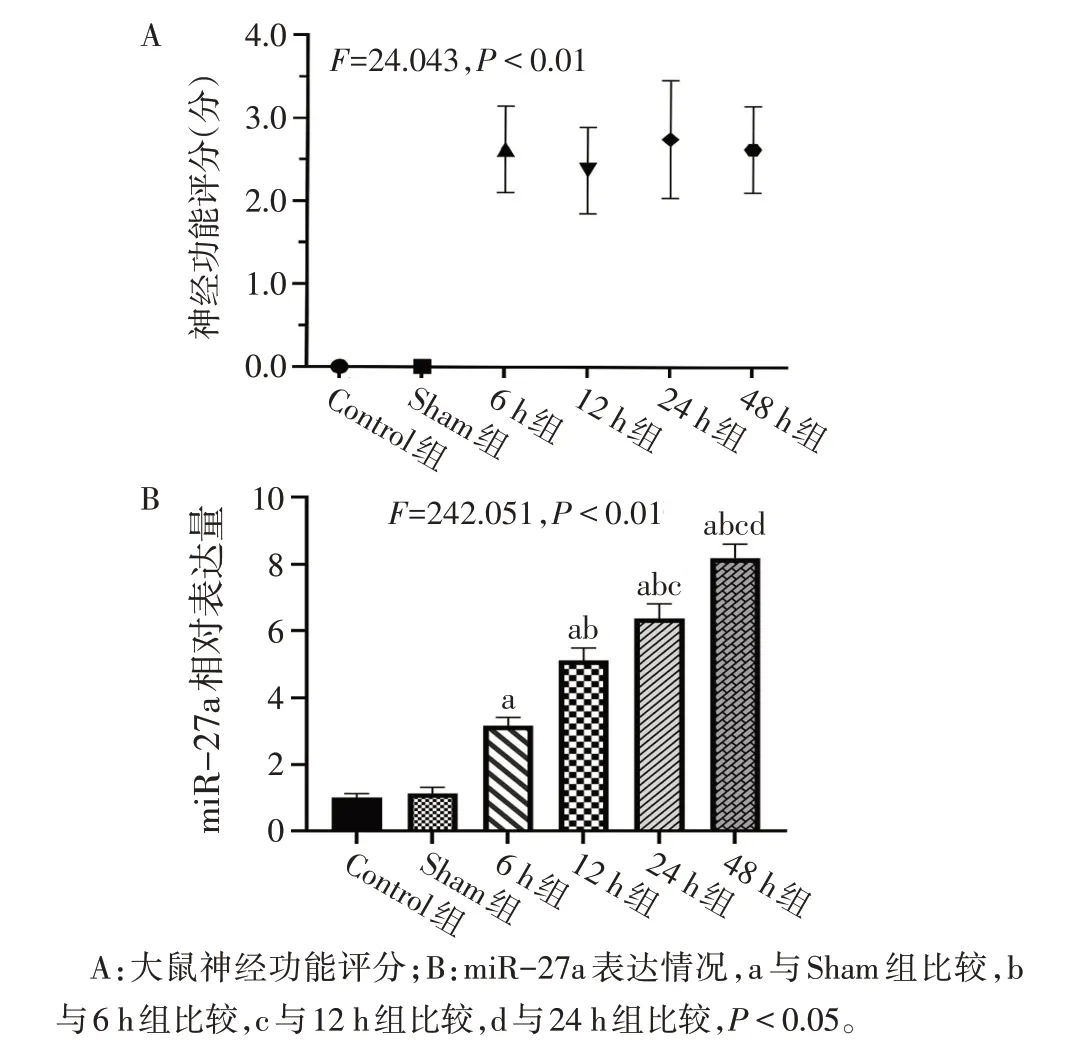
Fig.1 Neurological function score and miR-27a expression in each group of rats圖1 各組大鼠神經功能評分和miR-27a表達情況
Tab.2 Comparison of GSH,Fe and MDA between the six groups of rats表2 6組中GSH、Fe及MDA水平比較(n=8,±s)
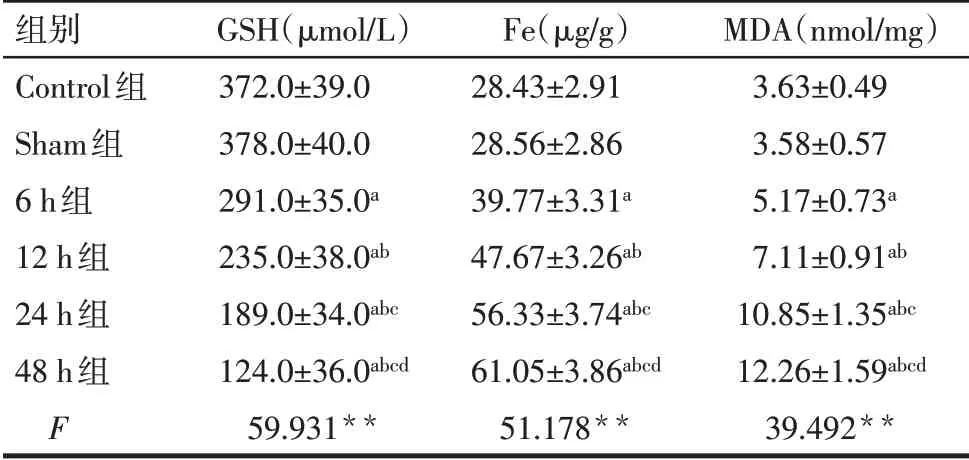
Tab.2 Comparison of GSH,Fe and MDA between the six groups of rats表2 6組中GSH、Fe及MDA水平比較(n=8,±s)
**P<0.01;a與Sham 組比較,b與6 h 組比較,c與12 h 組比較,d與24 h組比較,P<0.05。
組別Control組Sham組6 h組12 h組24 h組48 h組F GSH(μmol/L)372.0±39.0 378.0±40.0 291.0±35.0a 235.0±38.0ab 189.0±34.0abc 124.0±36.0abcd 59.931**Fe(μg/g)28.43±2.91 28.56±2.86 39.77±3.31a 47.67±3.26ab 56.33±3.74abc 61.05±3.86abcd 51.178**MDA(nmol/mg)3.63±0.49 3.58±0.57 5.17±0.73a 7.11±0.91ab 10.85±1.35abc 12.26±1.59abcd 39.492**
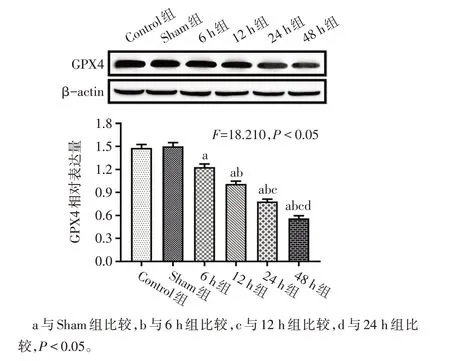
Fig.2 Expression of GPX4 protein in brain tissues of rats in each group of rats圖2 各組大鼠腦組織GPX4蛋白表達情況
2.2 Ferrostatin-1 可減輕缺血性腦卒中大鼠早期腦組織損傷 與I 48 h+DMSO 組比較,I 48 h+Fer-1 組大鼠腦梗死面積減小(P<0.01),同時GPX4 和GSH表達升高(P<0.05),而組織鐵及MDA 含量減少(P<0.05);與I 48 h 組相比,I 48 h+DMSO 組變化差異無統計學意義(P>0.05)。見圖3、4,表3。
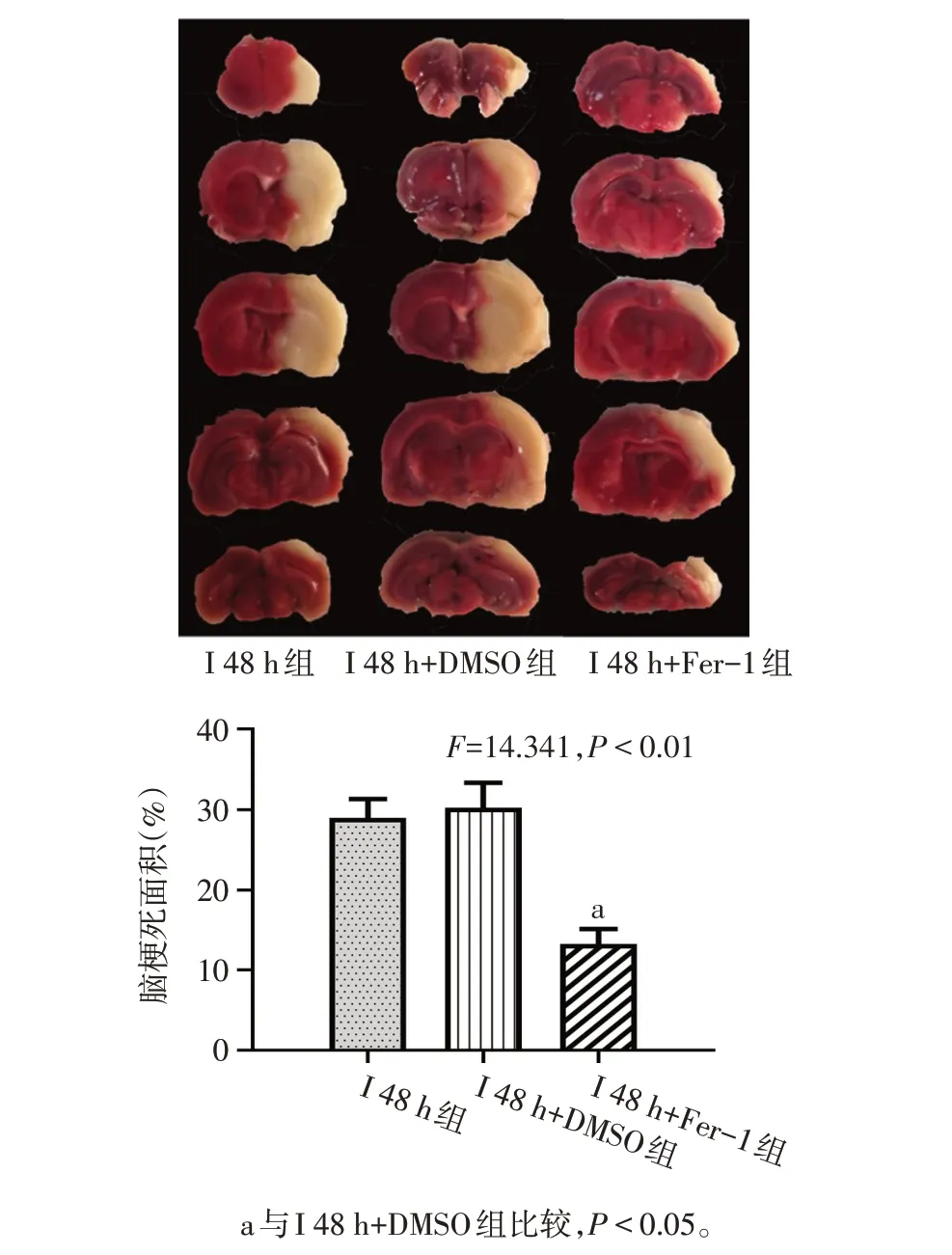
Fig.3 Cerebral infarct area of rats in each group of rats圖3 各組大鼠腦梗死面積情況
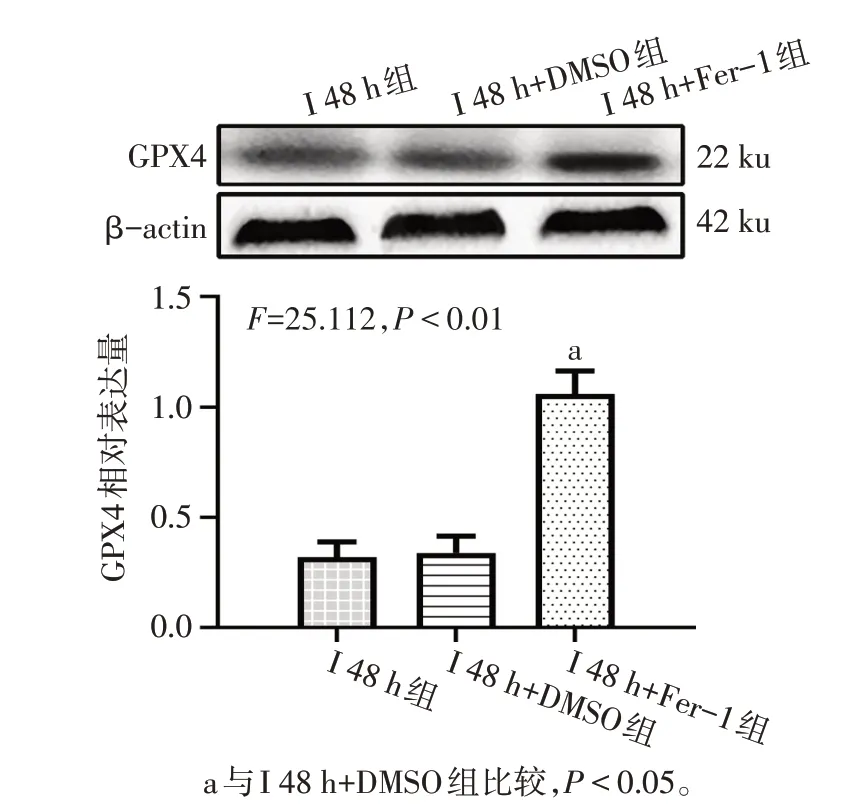
Fig.4 The relative expression of GPX4 in each group of rats圖4 各組大鼠GPX4相對表達情況
2.3 miR-27a促進大鼠缺血性腦卒中早期鐵死亡和腦組織損傷 與I 48 h+NC組相比,I 48 h+ago-miR-27a組大鼠腦組織中miR-27a表達升高,腦梗死面積增加(P<0.05),神經功能評分升高(P<0.05),GPX4和GSH 表達降低(P<0.05),但組織鐵及MDA含量增多(P<0.05);而給予antago-miR-27a 干預后,ago-miR-27a 作用被逆轉;與I 48 h 組相比,I 48 h+NC 組中相關結果差異無統計學意義(P>0.05)。見圖5、6,表4。
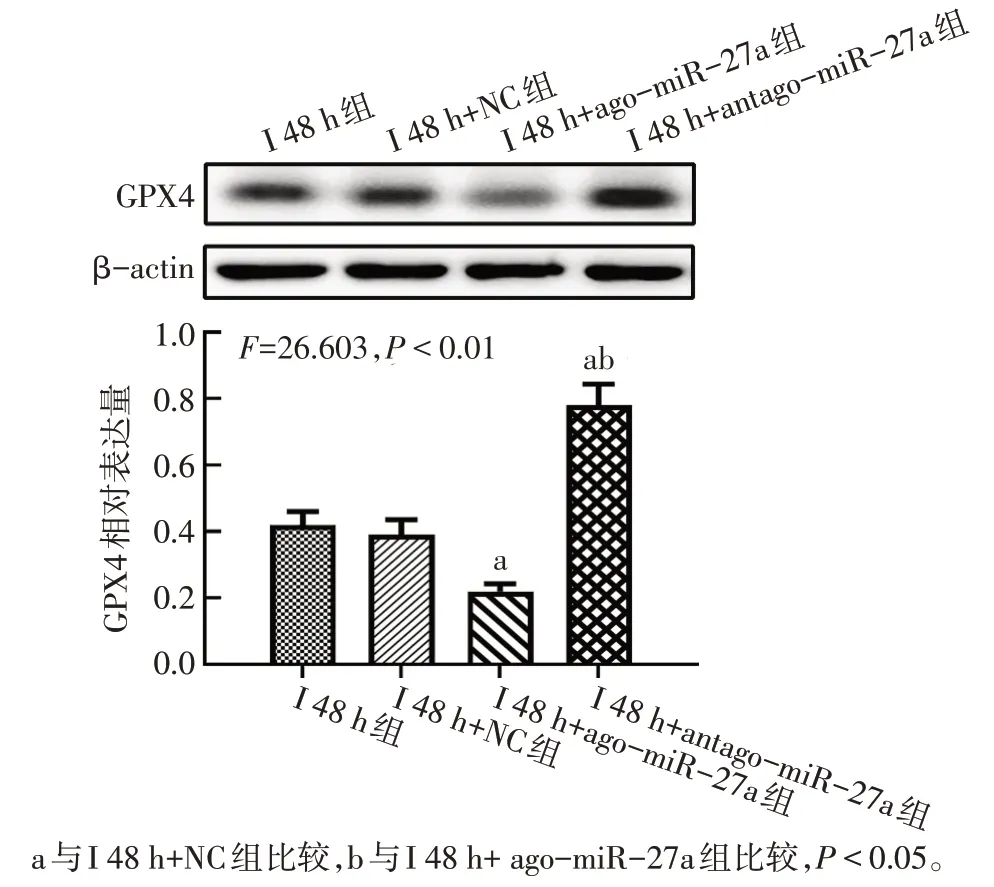
Fig.5 The changes of GPX4 in each group of rats圖5 各組大鼠GPX4蛋白表達變化
3 討論
Tab.3 Comparison of GSH,Fe and MDA between the three groups of rats表3 3組中GSH、Fe及MDA水平比較(n=8,±s)
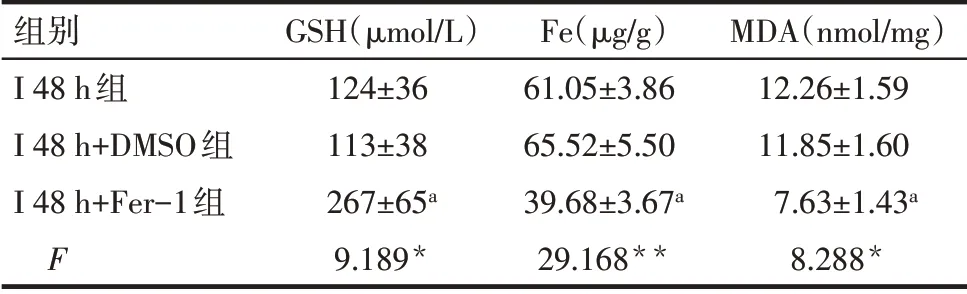
Tab.3 Comparison of GSH,Fe and MDA between the three groups of rats表3 3組中GSH、Fe及MDA水平比較(n=8,±s)
*P<0.05,**P<0.01;a與I 48 h+DMSO組比較,P<0.05。
組別I 48 h組I 48 h+DMSO組I 48 h+Fer-1組F GSH(μmol/L)124±36 113±38 267±65a 9.189*Fe(μg/g)61.05±3.86 65.52±5.50 39.68±3.67a 29.168**MDA(nmol/mg)12.26±1.59 11.85±1.60 7.63±1.43a 8.288*
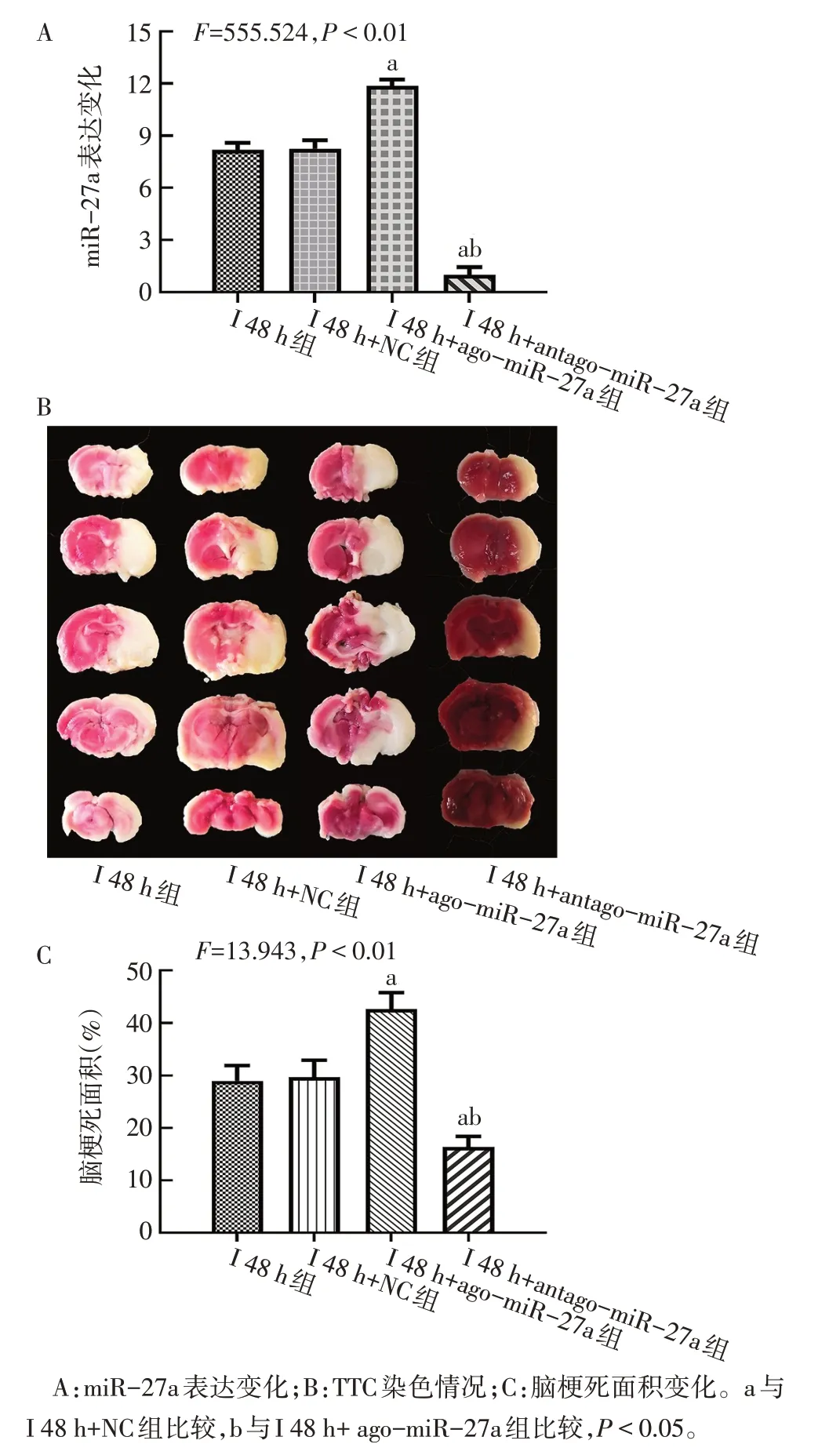
Fig.6 The expression of miR-27a and changes of cerebral infarct size of rats in each group圖6 各組大鼠miR-27a表達和腦梗死面積變化
鐵死亡是由鐵和脂質過氧化物的積累所引起的,當細胞內Fe2+增多時,會引起細胞發生芬頓(Fenton)反應,產生大量的活性氧以及羥自由基等氧化物質;這些物質會在細胞中與多不飽和脂肪酸結合,進而形成大量脂質過氧化物和MDA,最終導致鐵死亡的發生[10]。鐵螯合劑如去鐵胺、去鐵酮,鐵死亡抑制劑Ferrostatin-1 通過降低鐵和脂質過氧化物抑制鐵死亡的發生。GPX4 是重要的抗氧化物,GSH 是其發揮作用的輔助因子,GSH 和GPX4 減少是引起鐵死亡產生的關鍵因素[11]。研究發現,鐵死亡誘導劑Erastin 通過抑制胱氨酸/谷氨酸逆向轉運體減少GSH合成,使得GPX4合成原料不足,活性下降,促進鐵死亡[3]。鐵死亡誘導劑RSL3則直接抑制GPX4活性[12]。因此,鐵、MDA、GSH和GPX4被作為檢測鐵死亡的生物標志物,其中前兩者為促鐵死亡因子,后兩者被視為抗鐵死亡因子。當缺血性腦卒中發生時,會引發腦組織中興奮性毒性反應,并誘導細胞中GSH 以及GPX4 產生減少[13-14];同時,當缺血性腦卒中發生后,腦組織中鐵和脂質過氧化物積累增加[15-16],進一步促進鐵死亡的發生。因此,探究鐵死亡與缺血性腦卒中的關系,對缺血性腦卒中的機制研究以及防治均有重要意義。
Tab.4 Comparison of neurological function score and ferroptosis-associated indicators in brain tissue between the four groups of rats表4 4組中神經功能評分和鐵死亡相關指標的水平比較 (n=8,±s)

Tab.4 Comparison of neurological function score and ferroptosis-associated indicators in brain tissue between the four groups of rats表4 4組中神經功能評分和鐵死亡相關指標的水平比較 (n=8,±s)
**P<0.01;a與I 48 h+NC組比較,b與I 48 h+ago-miR-27a 組比較,P<0.05。
組別I 48 h組I 48 h+NC組I 48 h+ago-miR-27a組I 48 h+antago-miR-27a組F神經功能評分(分)2.63±0.52 2.63±0.52 3.63±0.52a 1.38±0.52ab 25.118**GPX4相對表達量0.42±0.07 0.39±0.08 0.22±0.04a 0.78±0.11ab 26.603**GSH(μmol/L)124.0±36.0 128.0±33.0 52.0±26.0a 263.0±44.0ab 18.617**Fe(μg/g)61.05±3.86 63.21±3.94 89.47±5.26a 45.67±4.52ab 50.491**MDA(nmol/mg)12.26±1.59 12.47±1.78 17.84±2.25a 7.82±1.31ab 16.170**
研究發現,小鼠缺血性腦卒中模型中GSH 含量明顯減少,脂質活性氧(ROS)的含量增加[17]。Tuo等[18]研究顯示,在單側短暫性大腦中動脈閉塞存在的情況下,tau蛋白等與鐵水平的升高有關。研究發現使用Ferrostatin-1可抑制心肌細胞鐵死亡,減輕心肌損傷[19]。上述研究表明鐵死亡是一些疾病的重要病理因素之一,抑制鐵死亡的發生可減輕疾病的病理損傷。本研究結果發現,在缺血性腦卒中早期,大鼠腦組織中GPX4、GSH表達水平降低,而鐵和MDA含量升高,提示鐵死亡參與缺血性腦卒中的發生發展過程。本研究進一步使用Ferrostatin-1 干預后發現,其可使腦組織中GPX4、GSH表達水平升高,降低鐵和MDA含量,同時明顯減輕大鼠腦組織損傷。提示抑制鐵死亡的發生可減輕缺血性腦卒中損傷。
miR-27a 是miR-23a~27a~24-2 基因簇中 的 一員,在神經系統疾病中發揮重要作用[20-21]。有研究報道,在大鼠腦皮層神經細胞擬缺血損傷模型中,miR-27a 表達升高,可以參與缺血性腦血管疾病發病過程[22];而給予外泌體miR-27a 后可以明顯增加缺血的腦組織損傷[23],表明miR-27a 具有潛在的促腦缺血損傷作用。另有研究發現miR-27a可促進鐵死亡的產生[24],故本研究推測miR-27a 可能與缺血性腦卒中過程中鐵死亡的發生有關。為了明確miR-27a 是否參與了缺血性腦卒中的病理過程,筆者觀察了miR-27a的表達變化,結果顯示,模型組大鼠腦組織中miR-27a表達出現顯著升高,抑制miR-27a 表達后,大鼠神經功能評分降低,腦梗死面積明顯減小,而GPX4 和GSH 的產生增多,且鐵和MDA含量降低。而使用agomiR-27a 促進miR-27a 表達具有相反的效果。提示miR-27a具有加重腦組織損傷的作用,該作用是通過促進鐵死亡的發生實現的。
綜上所述,在大鼠缺血性腦卒中早期miR-27a的表達增多,其通過促進鐵死亡的發生,從而加重腦組織損傷。本研究為探究miR-27a和鐵死亡在缺血性腦卒中過程中的機制以及臨床預防和治療缺血性腦卒中提供了新的方法和途徑,但miR-27a 與鐵死亡之間的具體作用機制還需更進一步研究。

