Na2SO4-(NH4)2SO4-H2O三元體系相圖及其應用
畢曉旭 ,宋繼田,2,蘇杭,石冬琦
(1.天津科技大學 機械工程學院 天津市輕工與食品工程機械裝備集成設計與在線監控重點實驗室,天津 300222;2.低碳綠色過程裝備國際聯合研究中心,天津 300222)
硫酸鈉和硫酸銨的混合廢水存在于多種工業過程中[1-4],通常此類工業廢水的處理方式是將其蒸干,產生的雜鹽堆場堆放或者焚燒,造成環境二次污染[5]。
分質結晶是從混合溶液中分離和提取單質鹽的有效方法[6-7],通過相圖可以分析鹽類溶解或析出的先后順序和溶液組成的變化規律,因此,(NH4)2SO4和Na2SO4的溶解度數據是必不可少的[8-11]。有部分文獻報道了(NH4)2SO4和Na2SO4體系的多元水鹽溶解度數據[12-16],但應用于單質鹽的實際結晶過程需要提供更高溫度下的溶解度數據,所以本文研究了三元體系Na2SO4-(NH4)2SO4-H2O在353.15 K的相平衡,并以此為基礎,以沉釩廢水為例,研究單質鹽的結晶分離。
1 實驗部分
1.1 試劑與儀器
無水硫酸鈉、硫酸銨、甲醛溶液、氯化鋇、酚酞指示劑、甲基紅指示劑、氫氧化鈉、硫酸氧化釩、鉻酸鈉均為分析純;去離子水,自制(常溫pH≈6.6,電導率<1×10-5S/m);模擬廢液組分見表1。

表1 廢水離子含量指標Table 1 Simulated wastewater composition and mass fraction
AX224ZH/E分析天平;HXC-500-8A多點磁力攪拌低溫恒溫槽;EL-3KJ電子天平;MNZF-100真空遠紅外干燥箱;XRD-6100X射線衍射儀;ICS-1100高效離子色譜儀;BHS-1電熱數顯恒溫水浴;SF212-1夾套玻璃反應釜。
1.2 實驗方法
1.2.1 相平衡實驗 使用等溫溶解平衡法測定固液相平衡數據[17-19]。把一系列不同質量比例的硫酸鈉、硫酸銨和去離子水加入平衡瓶中,將平衡瓶密封之后置于多點磁力攪拌恒溫槽(353.15±0.1) K中,以350 r/min的轉速連續攪拌,大約60 h后系統達到固液相平衡后停止攪拌,自然靜置6 h。待懸浮料液澄清后,使用預熱的取液管取少量上層清液,稱重后定容于容量瓶中,然后使用預熱后的藥匙迅速從平衡瓶中取少量濕固相,稱重后定容容量瓶中,分別測定液相和濕固相的離子組成。過濾平衡瓶中的剩余料液,固體干燥后研磨,通過X射線粉末衍射結合濕固相法鑒定固相。
1.2.2 結晶分離實驗 結晶分離裝置圖見圖1。由攪拌、控溫、蒸發、抽濾4個系統組成。
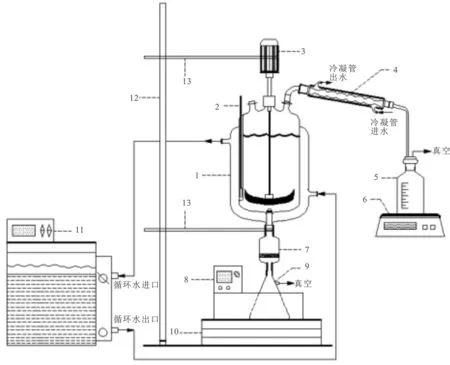
圖1 結晶實驗裝置流程圖Fig.1 Experimental apparatus for crystallization 1.夾套玻璃結晶釜;2.溫度計;3.機械攪拌;4.冷凝管;5.收集瓶;6.電子天平;7.砂芯漏斗;8.恒溫水浴;9.抽濾瓶;10.升降臺;11.高溫循環器;12.鐵架臺;13.支架
攪拌系統:使用電機帶動攪拌槳在結晶釜內攪拌,攪拌槳為雙葉錨式攪拌槳(聚四氟乙烯材質)。
控溫系統:高溫循環器以水為介質,提供熱量或冷量,通過夾套與結晶反應釜中的料液傳熱以提供結晶推動力,控溫精度±0.1 K。
蒸發系統:結晶釜連接循環水真空泵抽真空,等溫蒸發結晶時通過調節循環水真空泵的開度,控制蒸發系統的蒸發和結晶速率,二次蒸汽被冷凝后儲存于收集瓶中,收集瓶放置于電子天平上,電子天平實時稱量收集瓶中冷凝水重量。
抽濾系統:蒸發或冷卻結晶結束后的固液混合物于抽濾系統中過濾,結晶物被截留在砂芯漏斗中,母液儲存于抽濾瓶中,抽濾瓶放置在恒溫水浴中保溫,并將水浴溫度與結晶溫度一致(±0.1 K)。
1.3 離子分析方法
2 結果與討論
2.1 353.15 K條件下Na2SO4-(NH4)2SO4-H2O三
元體系的溶解度數據及相圖
表2為353.15 K時Na2SO4-(NH4)2SO4-H2O三元體系的溶解度數據。由表2中的數據繪制的353.15 K時的Na2SO4-(NH4)2SO4-H2O三元體系相圖見圖2。

表2 353.15 K(NH4)2SO4-Na2SO4-H2O 三元體系溶解度數據Table 2 Solubility data of (NH4)2SO4-Na2SO4-H2O ternary system at 353.15 K
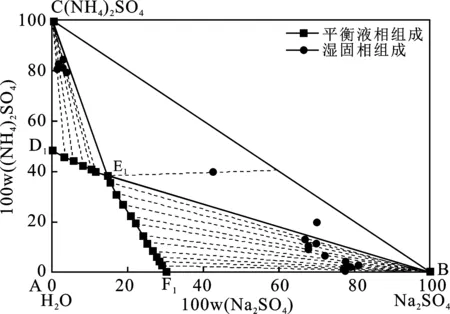
圖2 353.15 K (NH4)2SO4-Na2SO4-H2O 三元體系相圖Fig.2 Equilibrium phase diagram of the ternary system
由表2和圖2可知,353.15 K條件下,三元體系Na2SO4-(NH4)2SO4-H2O為簡單共飽和型,有一個共飽點,其組成為:W(Na2SO4)=14.73%、W((NH4)2SO4)=38.17%、W(H2O)=47.10%,圖2中點A、B、C分別代表H2O、Na2SO4、(NH4)2SO4,兩條單變量曲線F1E1和D1E1分別對應單鹽Na2SO4和(NH4)2SO4在353.15 K下的溶解度曲線。相圖分為4個區域,A D1E1F1為不飽和區,BF1E1為Na2SO4單質結晶區,CD1E1為(NH4)2SO4單質結晶區,CE1B為Na2SO4和(NH4)2SO4的共結晶區,353.15 K Na2SO4的單質結晶區明顯大于(NH4)2SO4的單質結晶區面積。
對353.15 K相圖中共飽點E1的固相進行XRD測定,結果見圖3。
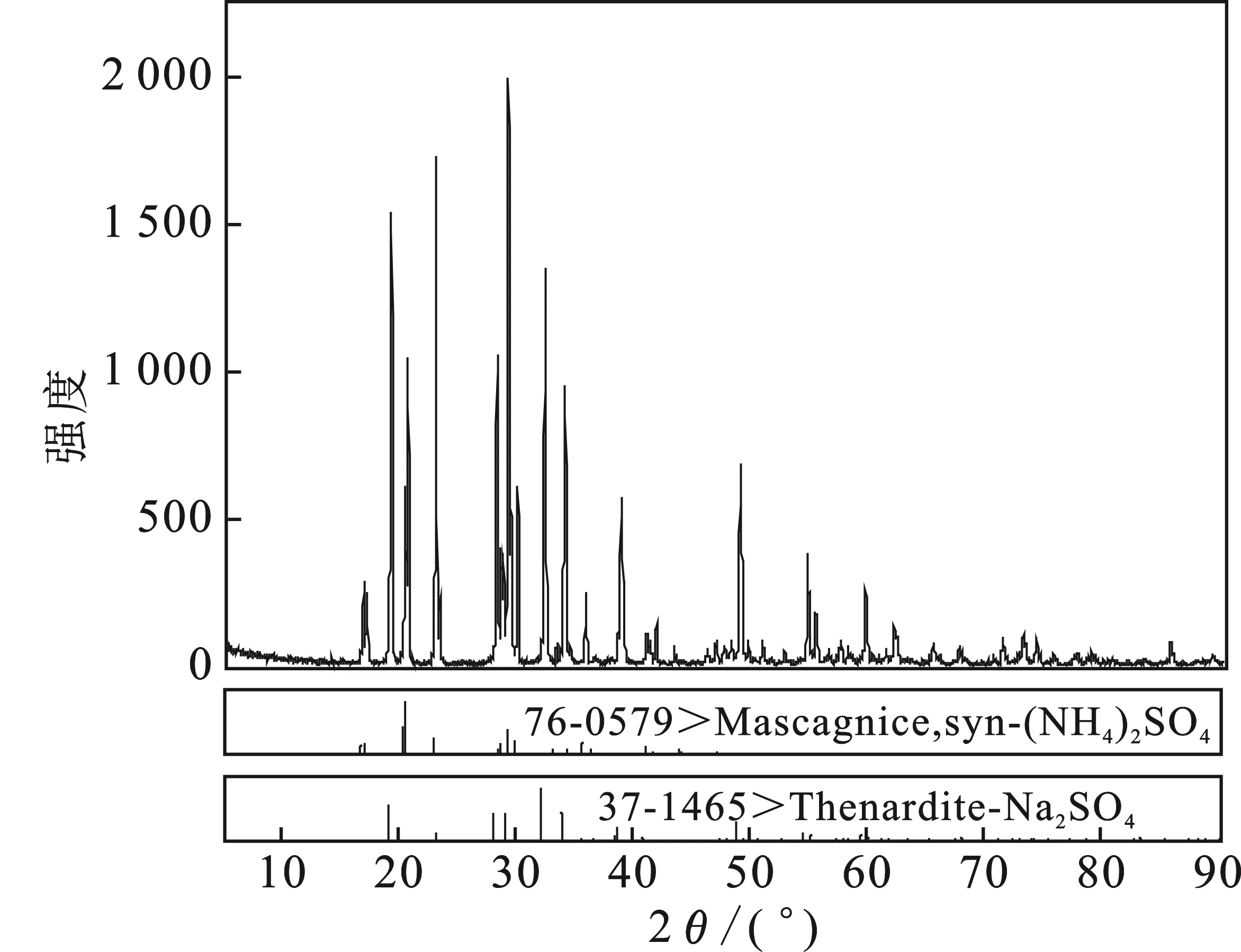
圖3 共飽點E1 XRD圖譜Fig.3 X-ray diffraction pattern of the eutectic point E1
由圖3可知,當Na2SO4-(NH4)2SO4-H2O體系達到共飽和時,平衡固相為Na2SO4和(NH4)2SO4的混合鹽,證明353.15 K該體系無固溶體和其他復鹽形成。
2.2 相圖分析
353.15 K體系相圖和333.15 K體系相圖共飽點組成分別為W(Na2SO4)=14.73%,W((NH4)2SO4)=38.17%、W(Na2SO4)=16.17%,W((NH4)2SO4)=36.54%,353.15 K條件下硫酸鈉結晶區略大,硫酸銨結晶區則較小。基于此,硫酸鈉和硫酸銨分別在353.15,333.15 K分離可獲得最大收率。沉釩廢液理論結晶分離過程見圖4中(a)、(b)、(c)三個階段。(a)353.15 K等溫蒸發結晶分離Na2SO4單質鹽;(b)288.15 K冷卻結晶分離復鹽NaNH4SO4·2H2O;(c)333.15 K等溫蒸發結晶分離(NH4)2SO4單質鹽。每個階段分離過程見表3,表4中(a)、(b)、(c)三個分離階段與圖4(a)、(b)、(c)相對應。
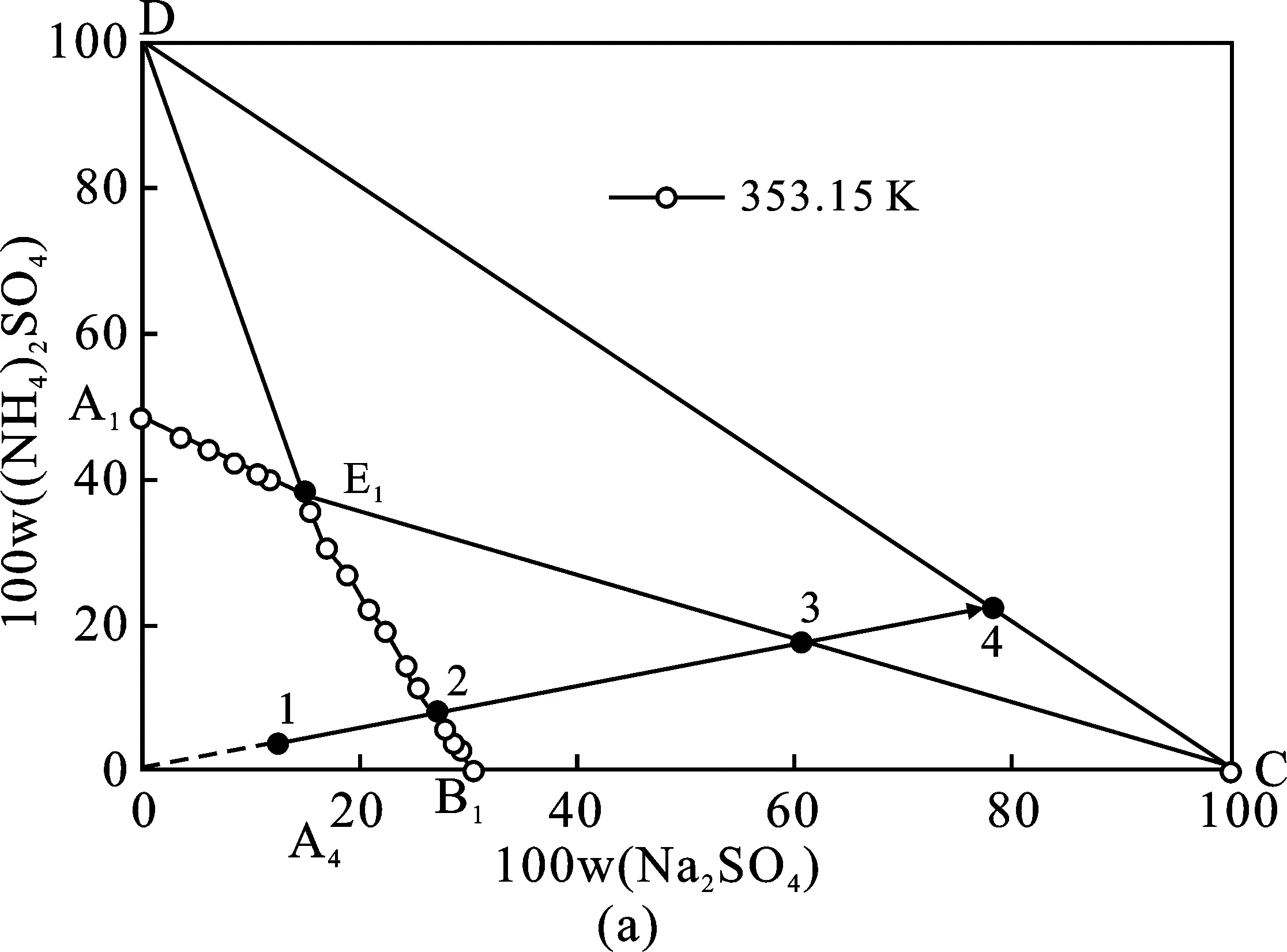
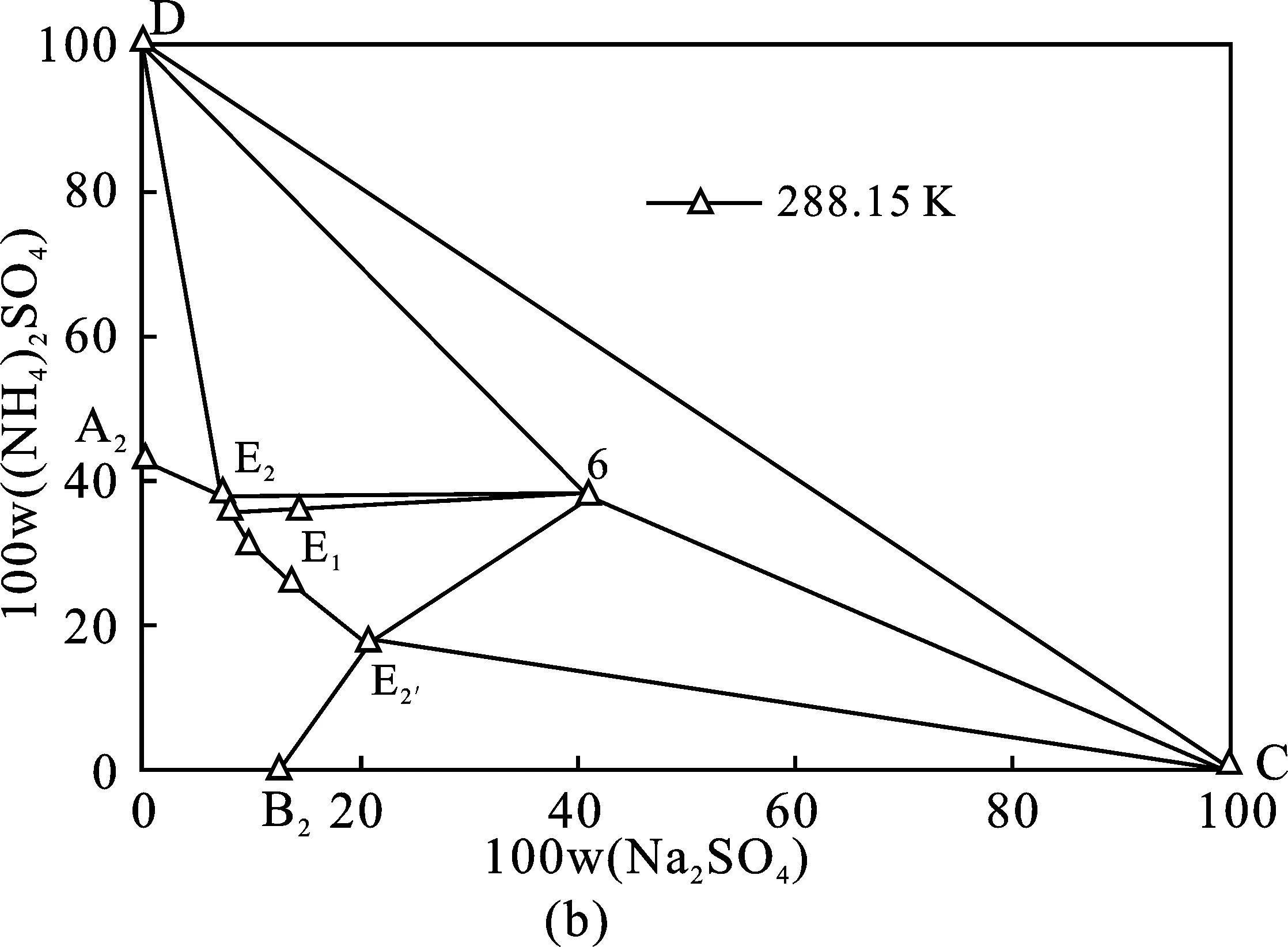
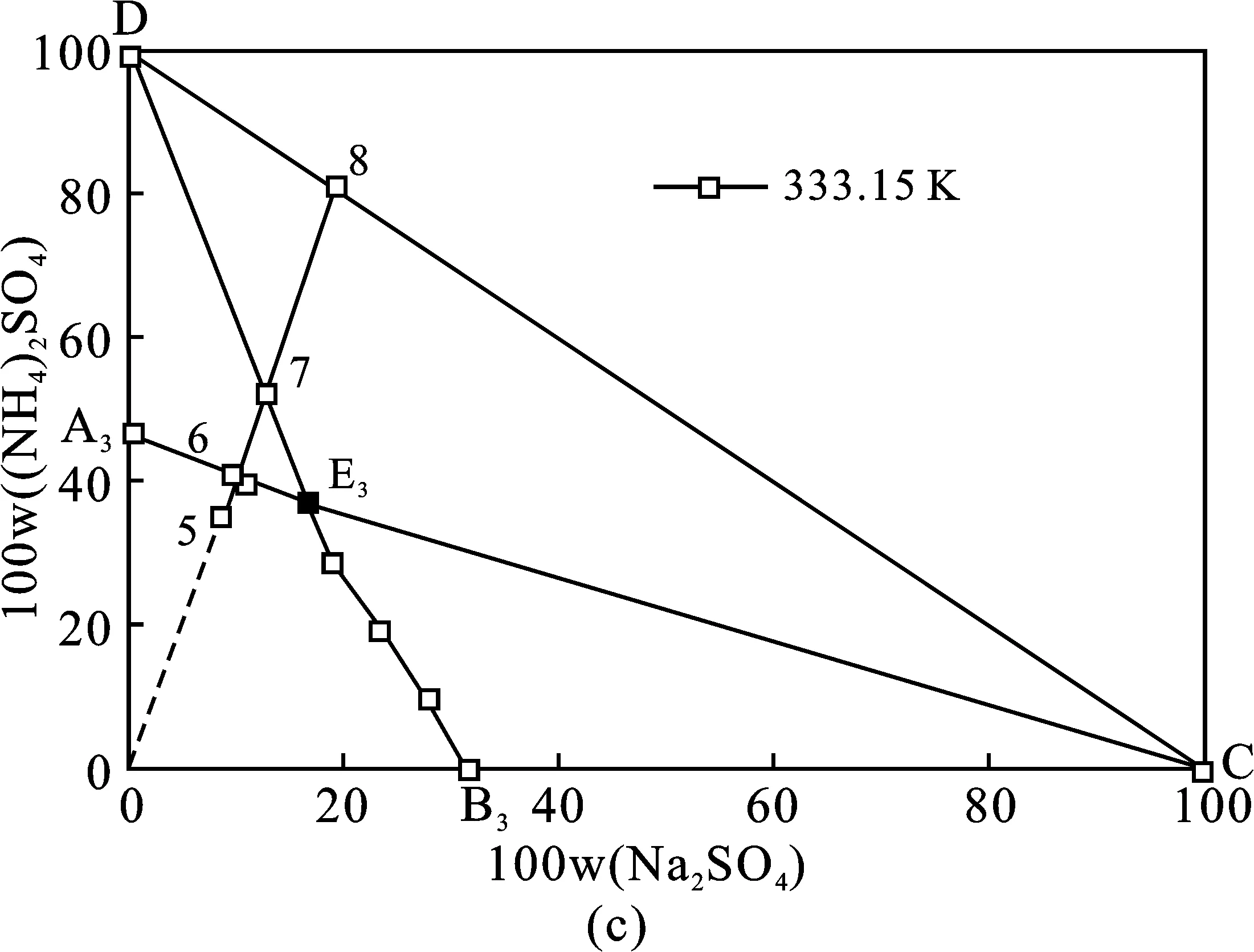
圖4 (NH4)2SO4和Na2SO4 混合物在相圖中表示的分離方法Fig.4 Sketch of the method for separation of the Na2SO4+(NH4)2SO4mixture shown in the equilibrium phase diagrams at T=353.15,288.15,333.15 K
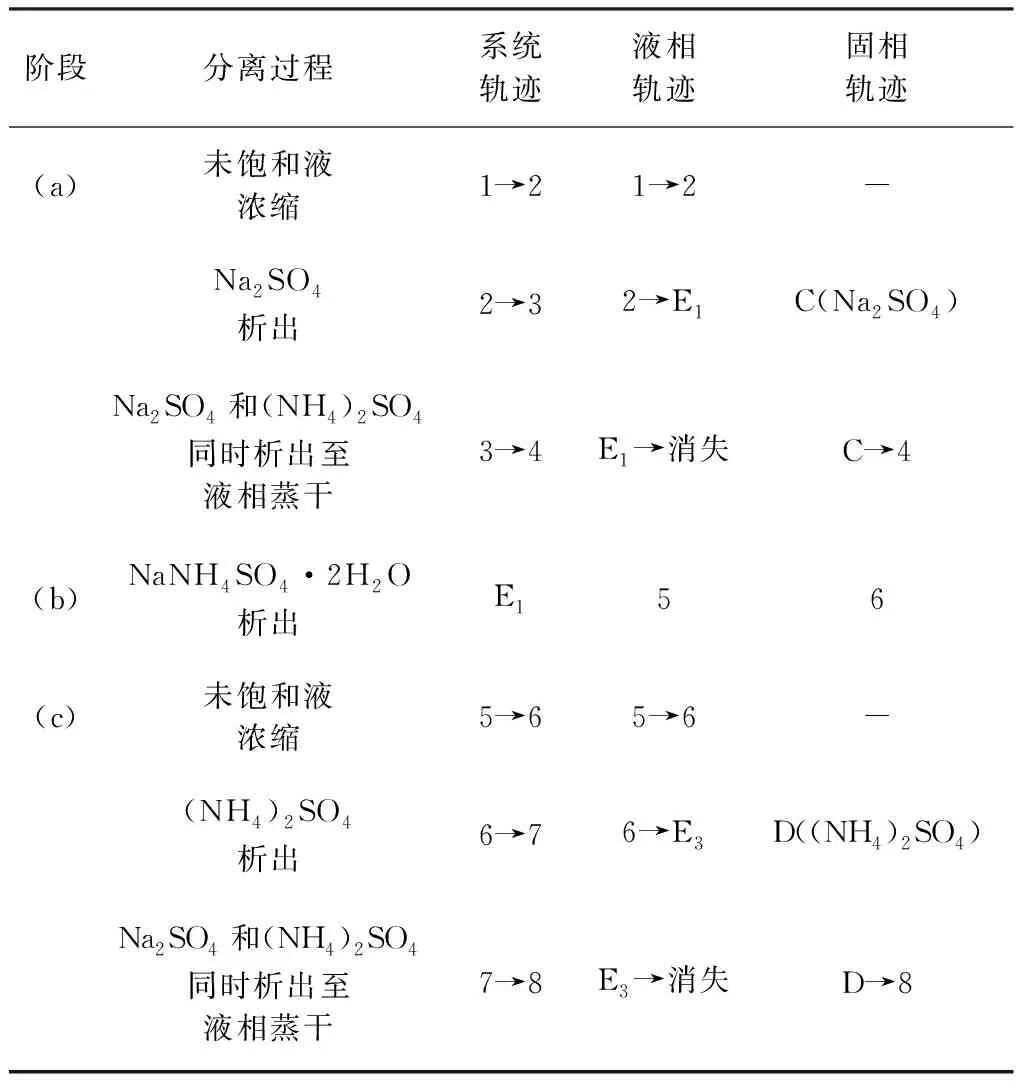
表3 沉釩廢水的蒸發與冷卻結晶過程Table 3 The evaporation and cooling crystallization process of vanadium precipitation solution
2.3 單質鹽結晶分離研究
2.3.1 353.15 K條件下Na2SO4蒸發結晶分離研究 在(a)階段中,廢液蒸發過程中液相離子濃度、溶質析出率、產品純度與收率的變化規律見表4。根據表4繪制出蒸發率與產品純度、收率的關系,見圖5。
由表4和圖5可知,當蒸發率達到94.64%時,產品純度開始大幅度下降,這是因為系統達到了共飽點,液相中的(NH4)2SO4也開始大量析出,此時液相中(NH4)2SO4與Na2SO4質量比W約為2.53,而353.15 K Na2SO4-(NH4)2SO4-H2O三元體系共飽點處(NH4)2SO4與Na2SO4質量比W為2.59,結果非常相近,也進一步說明了353.15 K條件下Na2SO4-(NH4)2SO4-H2O相圖的準確性。另外,當蒸發率達到92.86%時,繼續蒸發,收率增加的趨勢緩慢,甚至會逐漸的下降。這主要是因為蒸發率過高,導致系統粘度大,過濾時分離困難,有部分晶體殘留在反應釜壁面。因此,在實際分離過程中,應保持較小的蒸發率,降低系統粘度,但由于Na2SO4-(NH4)2SO4-H2O三元水鹽體系的特殊性,蒸發率的降低會導致液相中(NH4)2SO4與Na2SO4比例減小,并最終導致在后續階段分離(NH4)2SO4變得十分困難。綜上考慮,選擇編號6作為最佳實驗條件,此時蒸發率為93.97%,液相W=2.39,Na2SO4純度為98.95%,收率為83.17%。

表4 蒸發過程中離子濃度、溶質析出率、產品純度與收率的變化規律Table 4 Variation of ion concentration,solute precipitation rate,product purity and yield during evaporation
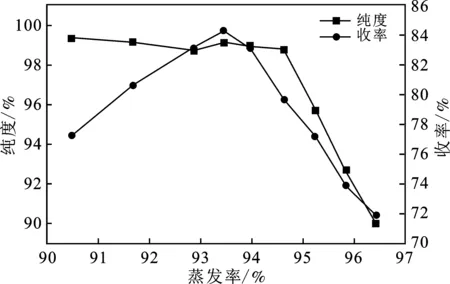
圖5 Na2SO4收率與純度隨蒸發率的變化規律Fig.5 Variation law of Na2SO4 purity and yield with increasing evaporation ratio
2.3.2 288.15 K條件下復鹽NaNH4SO4·2H2O冷卻結晶分離研究 階段(a)母液在288.15 K冷卻結晶分離后,液相離子質量分數和所得復鹽質量見表5。

表5 冷卻結晶后液相離子質量分數和復鹽質量Table 5 Mass fraction of liquid ions and mass of double salt after cooling and crystallization
由表5可知,二次母液中,(NH4)2SO4與Na2SO4比例由2.39增大至3.67,析出的復鹽質量占母液質量的16.71%。由于階段(b)冷卻結晶得到的為復鹽,不作為最終產品,故冷卻方式不作討論,只要求冷卻析出復鹽后改變飽和溶液組成。
2.3.3 333.15 K條件下(NH4)2SO4蒸發結晶分離研究 在(c)階段中,二次母液蒸發過程中液相離子濃度、溶質析出率、產品純度與收率的變化規律見表6。根據表6繪制出蒸發率與產品純度、收率的關系,見圖6。
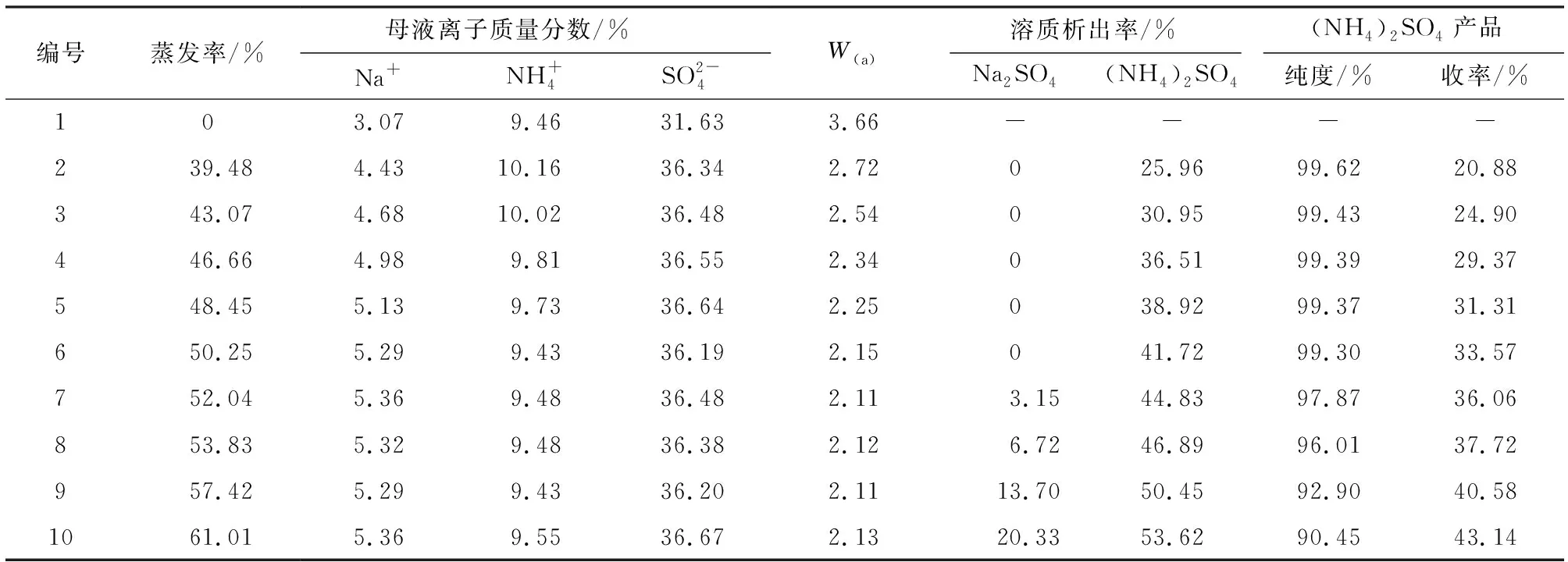
表6 蒸發過程中離子濃度、溶質析出率、產品純度與收率的變化規律Table 6 Variation of ion concentration,solute precipitation rate,product purity and yield during evaporation
由表6和圖6可知,當蒸發率達到52.04%時,產品純度開始大幅度下降。這是因為系統達到了共飽點,液相中的Na2SO4也開始大量析出,此時液相中(NH4)2SO4與Na2SO4質量比W約為2.11,而333.15 K條件下,Na2SO4-(NH4)2SO4-H2O三元體系共飽點處(NH4)2SO4與Na2SO4質量比W為2.26,結果有一定差距,其原因可能是隨著蒸發率的增大,液相中其他雜質離子的濃度也逐漸增大,此時整個體系已經不能被看做三元水鹽體系,其他一種或多種雜質離子濃度的增大導致體系析出更多(NH4)2SO4,說明雜質離子對(NH4)2SO4有顯著的鹽析作用,從而進一步導致共飽點液相中的(NH4)2SO4與Na2SO4質量比減小,低于理論值。由于(c)階段蒸發率較小,沒有出現由于體系粘度過大而導致的收率下降的問題,因此,在實驗范圍內,(NH4)2SO4收率隨蒸發率增大而增大。綜上考慮,選擇編號6作為最佳實驗條件,此時蒸發率為50.25%,液相W=2.15,(NH4)2SO4純度為99.30%,收率為33.57%。
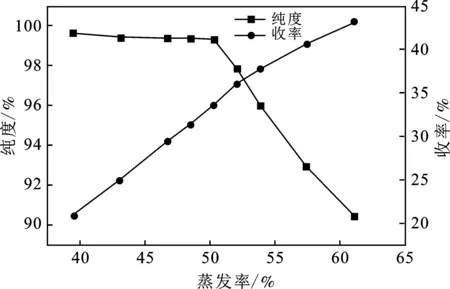
圖6 (NH4)2SO4收率與純度隨蒸發率的變化規律Fig.6 Variation law of(NH4)2SO4 quality with increasing evaporation ratio
3 結論
(1)運用等溫溶解平衡法測定了353.15 K條件下三元體系Na2SO4-(NH4)2SO4-H2O 的等溫溶解度數據,并繪制了相應相圖,含有一個共飽點,兩條溶解度曲線,三個結晶區,為簡單共飽和體系,無固溶體和復鹽形成。353.15 K體系的共飽點液相組成為W(Na2SO4)=14.73%、W[(NH4)2SO4]=38.17%、W(H2O)=47.10%。
(2)運用353.15,288.15,333.15 K的Na2SO4-(NH4)2SO4-H2O的相圖,對沉釩液中Na2SO4和(NH4)2SO4進行分離,Na2SO4純度和收率分別為98.95%,83.17%,(NH4)2SO4純度和收率分別為99.30%,33.57%。

