自噬在勞力性熱射病大鼠急性肺損傷中的作用
江利亞,張玉想,張志華,王佳興,毛漢丁
1河北北方學院研究生學院,河北張家口 075000;2解放軍總醫院第八醫學中心重癥醫學科,北京 100091;3河北北方學院附屬第一醫院呼吸內科,河北張家口 075000;4解放軍總醫院第一醫學中心重癥醫學科,北京 100853
熱射病(heat stroke,HS)是中暑最嚴重的一種疾病狀態,根據致熱因素不同可分為經典型(非勞力性)及勞力性兩種[1],其中勞力性熱射病(exertional heat stroke,EHS)是一種致死性疾病,主要為高溫環境下運動或勞作產生的內源性熱所致[2]。EHS導致機體產熱-散熱失衡,引起體溫迅速升高,甚至超過40 ℃。EHS是一種伴有中樞神經系統異常(主要為意識障礙)的多器官功能障礙(multiple organ dysfunction syndrome,MODS)致死性疾病,好發于夏季劇烈運動的青年人或在高溫環境中工作的建筑工人等[3]。急性肺損傷(acute lung injury,ALI)及急性呼吸窘迫綜合征(acute respiratory distress syndrome,ARDS)是EHS的常見并發癥[4-5],但目前EHS相關肺損傷的發病機制仍不明確。
自噬是指在細胞代謝過程中依賴溶酶體途徑將受損細胞器及異常蛋白質降解的過程,它受多種信號分子及信號通路的調節,是機體一種重要的自我防御及保護機制[6-7]。研究證實,自噬參與了膿毒癥肺損傷的發生,而上調自噬則能減輕膿毒癥小鼠的肺損傷[8-10]。在HS中,自噬與HS的心肌損傷及腦損傷有密切關系,適度上調自噬有助于減輕HS的心肌損傷及腦損傷[11-12]。但自噬改變是否參與了EHS肺損傷的發生目前鮮見報道。本研究通過建立EHS大鼠模型,探討了自噬在EHS肺損傷中的作用,以期為EHS相關ALI的防治提供理論依據。
1 材料與方法
1.1 主要儀器與試劑 六道小動物跑臺(XR-PT-10A,上海欣軟信息科技有限公司)放置于透明模擬高溫高濕環境實驗艙中[13],該艙能精準控制艙內溫度及濕度并維持恒定。巴弗洛霉素A1(bafilomycin A1,Baf A1)、伊文思藍(Evans blue,EB)均購自美國MCE公司;雷帕霉素(rapamycin,RAPA)購自美國APExBIO公司;二甲基亞砜(DMSO)購自美國Sigma公司;兔抗大鼠微管相關蛋白1輕鏈3 (microtubuleassociated protein 1 light chain 3,LC3)抗體購自美國CST公司;磷酸甘油醛脫氫酶(glyceraldehyde phosphatedehydrogenase,GAPDH)單克隆抗體及兔單克隆抗體p62均購自英國Abcam公司;原位末端轉移酶標記法(TdT-mediated dUTP nick-end labeling,TUNEL)試劑盒購自瑞士Roche公司;辣根過氧化物酶標記的山羊抗兔IgG、山羊抗小鼠IgG均購自北京中杉金橋生物技術有限公司;甲酰胺購自上海麥克林生化科技有限公司。
1.2 實驗動物 健康清潔級成年Wistar雄性大鼠60只,體重300~350 g,購自斯貝福(北京)生物科技有限公司,許可證編號:SCXK(京)2019-0010。動物飼養于解放軍總醫院第八醫學中心動物實驗室(SPF級),溫度25~26 ℃,相對濕度為50%~60%。實驗動物相關方案通過解放軍總醫院第八醫學中心動物倫理委員會批準。
1.3 研究方法
1.3.1 大鼠適應性跑步訓練 在進行熱打擊之前,實驗大鼠均在室溫(25~26 ℃)下采用階梯鍛煉法進行為期1周的適應性訓練。前3 d按以下程序進行:大鼠從飼養籠轉移至實驗艙后,以初始速度5 m/min開始跑步(坡度為0),每2 min增速1 m/min,20 min增速至15 m/min后維持勻速跑,直至出現疲勞狀態(經輕推、噪聲等無痛刺激驅趕后仍不能堅持跑步持續5 s以上),跑步時間不超過30 min。第4、5天,增速方案如前,但跑步時間延長至60 min。第6、7天為休息日,大鼠僅進行艙內環境適應,不進行跑步訓練。訓練期間大鼠自由進食、飲水。
1.3.2 EHS大鼠模型的建立 大鼠熱應激實驗前禁食12 h,飲水不限。在開始建模前30 min稱重并禁止飲水。當實驗艙溫度達到(39.5±0.3) ℃、相對濕度為(55%±5%)時,將大鼠放入跑臺[14-15],以5 m/min的初始速度開始跑步(坡度為0),每2 min增速1 m/min,20 min增速至15 m/min后保持恒定速度持續跑步,直到出現疲勞狀態(適當驅趕后仍無法繼續跑步)停止跑步。實驗全程嚴密觀察大鼠意識、精神變化,在大鼠達到EHS診斷標準后,將其從熱艙中取出,停止熱暴露,繼續監測大鼠精神狀態至建模后5 h。EHS的診斷標準為大鼠出現HS神經系統功能障礙表現,即無自主活動時間大于5 s(輕度無痛刺激不能驅趕動物爬行或改變位置)[16-17]。
1.3.3 實驗動物分組 將60只健康清潔級雄性Wistar大鼠按照隨機數字表法分為4組:正常對照組、EHS組、EHS+Baf A1組、EHS+RAPA組,每組15只。其中29只大鼠用于EB實驗(正常對照組、EHS組和EHS+Baf A1組,每組7只),EHS+RAPA組為8只;剩余31只大鼠用于其余實驗。正常對照組不做任何處理,EHS組建模成功后立即從熱艙中取出,于室溫(22~24 ℃)下放置自然降溫,嚴密觀察大鼠精神、意識變化。RAPA(規格:25 mg)、Baf A1(規格:1 mg)溶解于100% DMSO溶液中,配制濃度為2 g/L的原液,兩種藥物分別在大鼠建模前于每日同一時間點以1 mg/kg劑量連續腹腔注射4 d。各組大鼠均于建模后5 h處死,取肺等器官組織進行后續實驗。
1.3.4 大鼠肺組織大體形態學觀察 采用腹主動脈放血法處死大鼠,取大鼠雙肺組織,肉眼觀察雙側肺部的顏色、光澤、彈性、淤血及腫脹程度。
1.3.5 大鼠動脈血氣分析 建模后5 h,大鼠經腹腔麻醉后開腹,分離附著于腹主動脈上的結締組織,用肝素抗凝的1 ml動脈血氣針經腹主動脈采集0.5 ml血液,使用PREMIER 4000動脈血氣分析儀測定動脈血氧分壓(PaO2)、動脈血二氧化碳分壓(PaCO2)。
1.3.6 大鼠肺系數測定 采用腹主動脈放血法處死大鼠后取雙肺組織,PBS液反復漂洗,用濾紙吸干肺組織表面水分,稱量全重,計算肺系數(lung weight/body weight,LW/BW)。LW/BW=肺濕重(mg)/大鼠體重(g)。
1.3.7 大鼠肺血管通透性測定 采用EB染色檢測大鼠肺組織通透性[18]。將EB染料溶于生理鹽水配制為2%的溶液,以2 ml/kg劑量從大鼠尾靜脈注入,觀察到大鼠眼睛、耳朵變藍即可確認染料已被吸收并分布于大鼠體內。EB在體內循環2 h后,經腹腔麻醉開胸,剪開右心耳,經左心室注入10 ml PBS液,沖出循環系統中殘留的EB,直至右心房流出的液體呈無色清亮狀。取全肺組織,將肺組織及甲酰胺按照0.1 g∶1 ml的比例浸泡萃取,然后放置于60 ℃溫箱中孵育16 h,待組織中色素全部浸出,取出組織,1 500 r/min離心10 min后取上清液,用分光光度計在620 nm波長處進行比色,測量吸光度值(A),并計算肺組織中的EB含量。
1.3.8 大鼠肺組織病理學觀察 剪取各組大鼠右肺下葉組織小塊,置于4%甲醛溶液固定,經過乙醇梯度脫水、常規石蠟包埋后切片(厚度4 μm),HE染色,中性樹膠封片,光鏡下觀察肺組織病理學變化。根據Hong等[19]的標準進行肺組織病理學損傷評分,在倒置顯微鏡(200倍)下隨機選取10個視野,觀察肺組織病理學變化并進行評分。評分項目包括肺泡腔充血、中性粒細胞浸潤、纖維蛋白滲出、肺泡間隔增寬,每項按損傷程度評為0、1、2、3分,分別為無損傷及輕度、中度、重度損傷,計算平均得分。
1.3.9 TUNEL法檢測細胞凋亡情況 取肺組織石蠟切片,梯度乙醇脫蠟,自來水沖洗,滴入蛋白酶工作液,于37 ℃孵育20 min,PBS洗滌;滴加TUNEL溶液,于37 ℃孵育1 h,PBS洗滌;再滴加TUNEL溶液,室溫孵育20 min,PBS沖洗后進行二氨基聯苯胺(DAB)染色,蘇木精復染,梯度乙醇脫水,透明、封片,光鏡下觀察。陽性細胞即凋亡細胞呈棕黃色,正常細胞呈藍色。采用Image J圖像分析軟件對各組TUNEL染色切片圖像進行分析,每張切片顯微鏡下隨機選取5個視野(200倍),計算凋亡指數(apoptosis index,AI)。AI=陽性細胞數/總細胞數×100%。
1.3.10 Western blotting檢測大鼠肺組織中LC3及p62蛋白表達量 將肺組織按比例加入預冷的組織裂解液中裂解,BCA法測定蛋白濃度,行12% SDSPAGE電泳,然后轉移至PVDF膜,脫脂奶粉室溫封閉1 h,分別加入一抗兔抗大鼠LC3抗體(1∶1000)及兔抗大鼠單克隆抗體p62(1∶1000),4 ℃孵育過夜,TBS-T洗滌,分別加入二抗(辣根過氧化物酶標記的山羊抗兔及山羊抗小鼠IgG,1∶2000),化學發光法顯色。以GADPH作為內參照,采用IPP軟件對掃描圖像的目的條帶進行灰度分析,并計算蛋白相對表達量。
1.4 統計學處理 采用GraphPad Prism 9軟件進行統計分析。數據符合正態分布,均以±s表示,多組間比較采用單因素方差分析,兩兩比較采用Tukey檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 各組大鼠肺組織大體形態學觀察 正常對照組大鼠肺組織肉眼觀呈粉紅色,表面光滑,色澤光亮;EHS組大鼠肺組織腫脹明顯,色澤暗淡,呈暗紅色,且液體滲出較多。與EHS組比較,EHS+Baf A1組大鼠肺組織腫脹明顯加重,整肺發生嚴重水腫,肺組織間隙聚積過多液體,由于重力影響使肺部不能保持正常形狀,表面伴多處出血點,而EHS+RAPA組大鼠肺組織腫脹情況明顯減輕,表面顏色近似粉紅色,且滲出減少(圖1)。
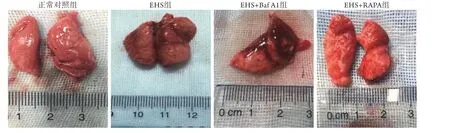
圖1 各組大鼠肺組織標本肉眼觀Fig. 1 Macroscopic view of lung tissue specimens of rats in each group
2.2 各組大鼠PaO2、PaCO2比較 與正常對照組比較,EHS組大鼠PaO2降低,PaCO2升高,差異有統計學意義(P<0.05)。與EHS組比較,EHS+Baf A1組PaO2下降,PaCO2升高,EHS+RAPA組PaO2升高,PaCO2降低,接近正常范圍,差異均有統計學意義(P<0.05,表1)。
表1 各組大鼠PaO2、PaCO2比較(mmHg,±s, n=15)Tab.1 Comparison of PaO2 and PaCO2 of rats in each group(mmHg, ±s, n=15)
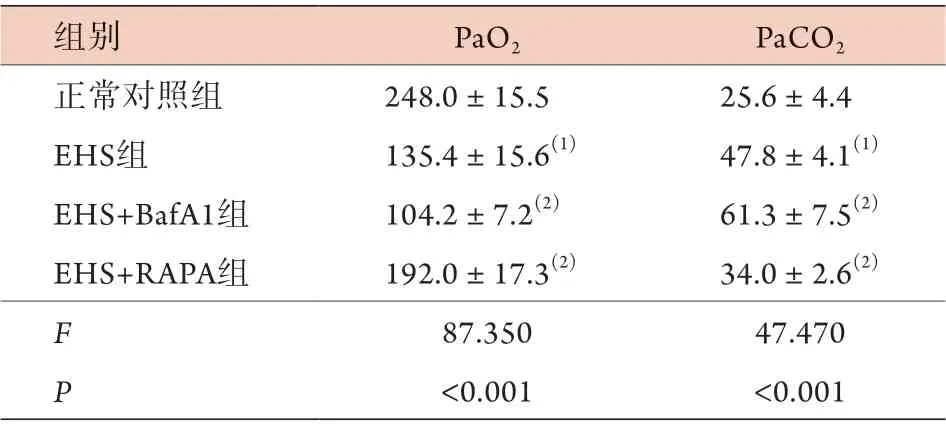
表1 各組大鼠PaO2、PaCO2比較(mmHg,±s, n=15)Tab.1 Comparison of PaO2 and PaCO2 of rats in each group(mmHg, ±s, n=15)
EHS. 勞力性熱射病;Baf A1. 巴弗洛霉素A1;RAPA. 雷帕霉素;PaO2. 動脈血氧分壓;PaCO2. 動脈血二氧化碳分壓;與正常對照組比較,(1)P<0.05;與EHS組比較,(2)P<0.05
組別 PaO2 PaCO2正常對照組 248.0±15.5 25.6±4.4 EHS組 135.4±15.6(1) 47.8±4.1(1)EHS+BafA1組 104.2±7.2(2) 61.3±7.5(2)EHS+RAPA組 192.0±17.3(2) 34.0±2.6(2)F 87.350 47.470 P<0.001 <0.001
2.3 各組大鼠肺系數變化 與正常對照組比較,EHS組大鼠的肺系數增高[(4.5±0.3) mg/gvs.(3.6±0.2) mg/g],差異有統計學意義(P<0.05)。與EHS組比較,EHS+Baf A1組大鼠肺系數[(5.3±0.7) mg/g]增高,而EHS+RAPA組肺系數[(3.7±0.1) mg/g]降低,差異均有統計學意義(P<0.05,圖2A)。
2.4 各組大鼠肺血管通透性的變化 與正常對照組比較,EHS組大鼠肺血管通透性明顯增加,EB滲出量增多[(72.0±5.4) μg/gvs. (18.4±1.6) μg/g],差異有統計學意義(P<0.05)。與EHS組比較,EHS+Baf A1組大鼠的血管通透性進一步增加,EB滲出量進一步增多[(80.0±4.9) μg/g];而EHS+RAPA組大鼠肺血管通透性則明顯下降,EB滲出量減少[(53.9±6.9) μg/g],差異均有統計學意義(P<0.05,圖2B)。
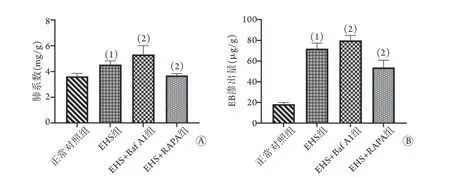
圖2 各組大鼠肺系數(A)及EB滲出量(B)比較Fig.2 Comparison of pulmonary index (A) and EB content (B) of rats in each group
2.5 各組大鼠肺組織的病理損傷 HE染色結果(圖3)顯示,在無熱打擊情況下,正常對照組大鼠肺組織肺泡壁光滑,結構正常無破壞,且肺泡腔無液體滲出;與正常對照組比較,EHS組大鼠肺泡間隔及
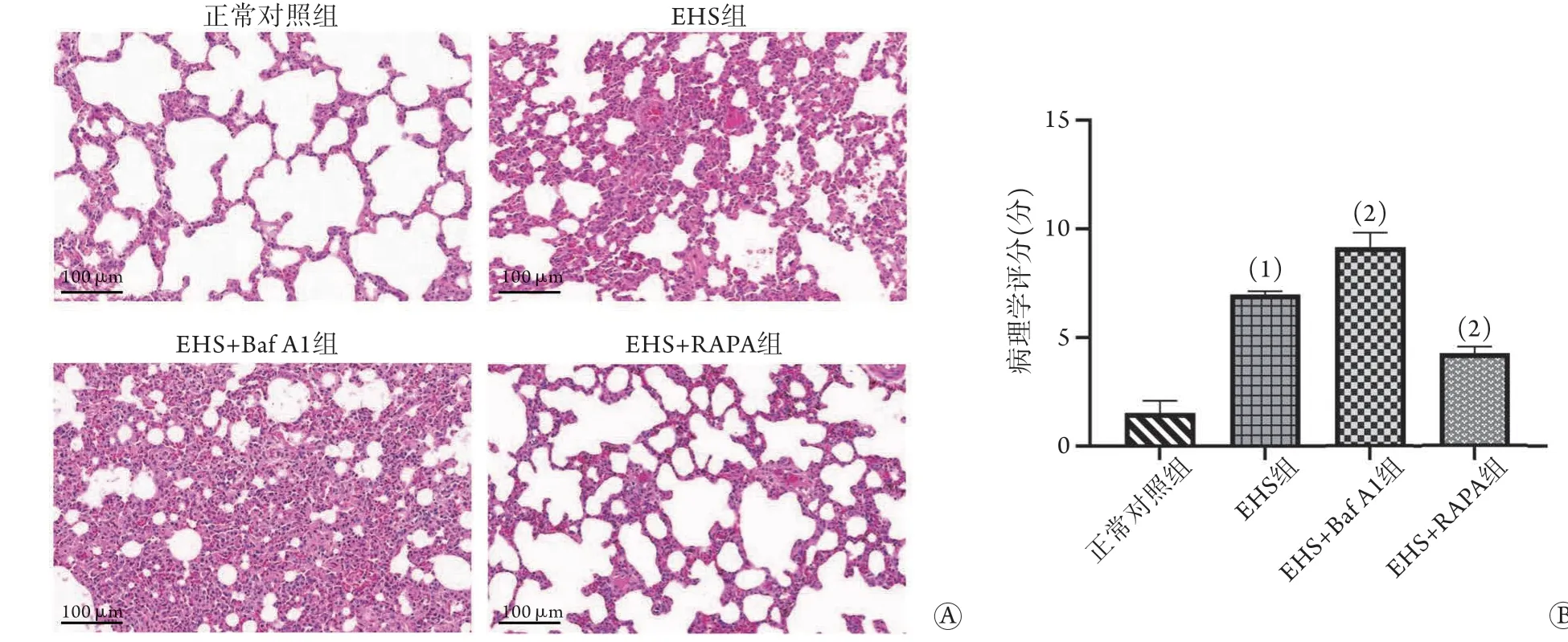
圖3 各組大鼠肺組織病理學變化Fig.3 Pathological changes of rat lung tissue in each group
肺泡壁明顯增厚不均,部分肺泡塌陷,肺泡腔出現大量紅細胞、炎癥細胞及血漿樣物質滲出,肺組織病理學評分明顯增加[(7.0±0.1)分vs. (1.5±0.6)分];與EHS組比較,EHS+Baf A1組大鼠肺組織液滲出、炎癥浸潤程度進一步加重,肺組織病理學評分明顯增加[(9.2±0.7)分],而EHS+RAPA組大鼠肺組織液滲出及炎癥浸潤嚴重程度均不及EHS組,且出血減少,肺泡結構逐漸恢復,肺組織病理學評分明顯降低[(4.3±0.3)分],差異均有統計學意義(P<0.05)。
2.6 各組大鼠肺組織細胞凋亡情況 與正常對照組比較,EHS組大鼠肺組織凋亡細胞數增多,AI明顯升高(50.8%±5.6%vs. 8.0%±1.0%);與EHS組比較,EHS+Baf A1組大鼠肺組織凋亡細胞數進一步增多,AI明顯升高(84.7%±3.4%),但EHS+RAPA組大鼠肺組織凋亡細胞數減少,AI明顯降低(33.8%±2.3%),差異均有統計學意義(P<0.05,圖4)。
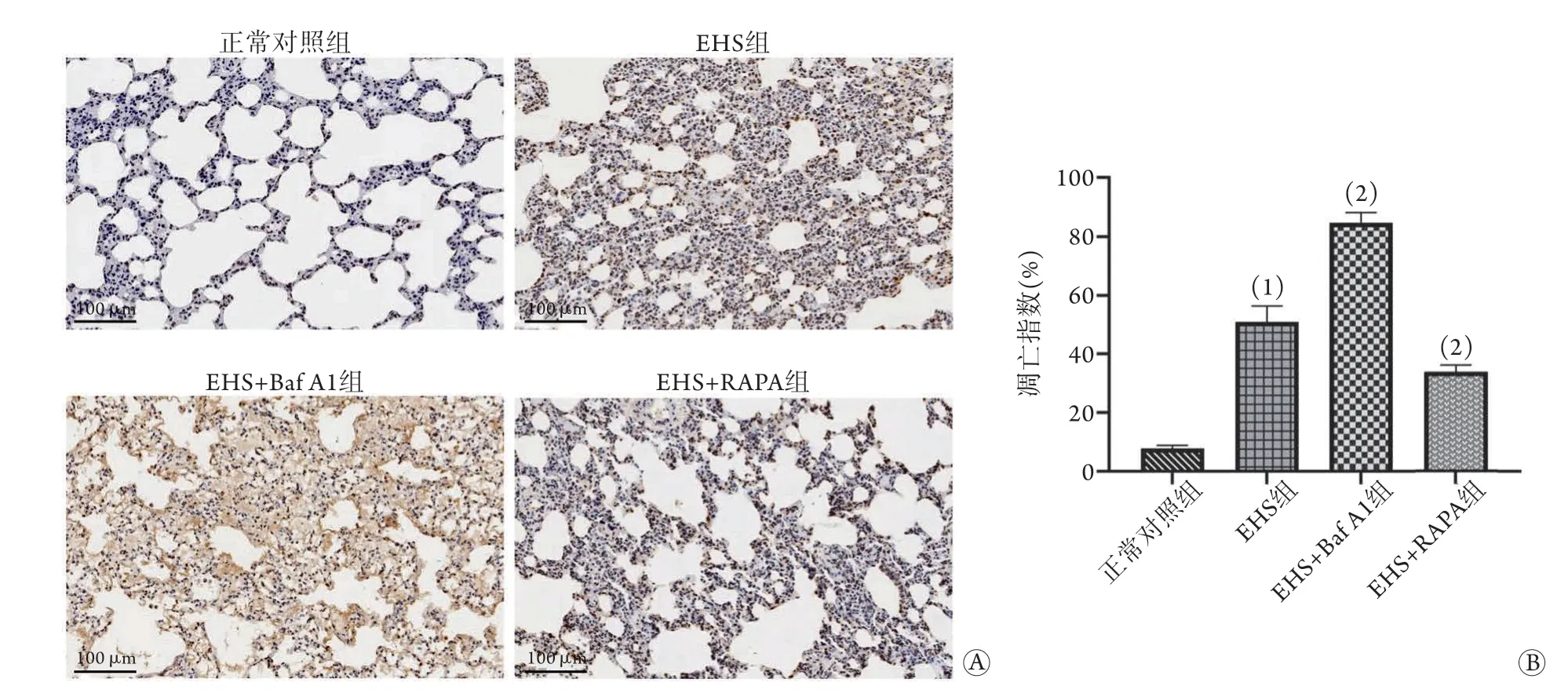
圖4 各組大鼠肺組織凋亡情況比較Fig.4 Comparison of apoptosis of lung tissue of rats in each group
2.7 各組大鼠LC3及p62蛋白表達 與正常對照組比較,EHS組大鼠肺組織LC3-Ⅱ/LC3-Ⅰ比值明顯降低(0.3±0.1vs. 1.0±0.1),p62表達水平明顯增高(1.4±0.2vs. 0.8±0.1)。與EHS組比較,EHS+Baf A1組大鼠肺組織LC3-Ⅱ/LC3-Ⅰ比值降低(0.10±0.04),p62表達水平進一步升高(1.7±0.1),而EHS+R APA組大鼠肺組織LC3-Ⅱ/LC3-Ⅰ比值明顯升高(0.5±0.1),p62表達水平明顯降低(1.1±0.1),差異均有統計學意義(P<0.05,圖5)。
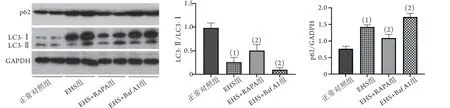
圖5 Western blotting檢測各組大鼠肺組織自噬水平Fig.5 Autophagy levels in lung tissues of rats in each group (Western blotting)
3 討 論
EHS是熱相關疾病最嚴重的一種表現,常導致多個臟器發生損傷,其中肺最易受累[3-4]。EHS引發的全身炎癥反應綜合征(systemic inflammatory response syndrome,SIRS)會引起肺內皮屏障功能障礙,誘導肺毛細血管通透性增加,最終導致肺組織結構破壞,部分肺泡呈實變狀,肺間質彌漫性水腫,肺功能受損[20-21]。上述既往研究結果與本實驗通過大鼠EHS模型觀察到的EHS組大鼠肺組織肺泡間隔及肺泡壁明顯增厚,肺泡腔出現大量的紅細胞、炎癥細胞及血漿樣物質滲出等ALI病理變化,以及肺系數、肺組織凋亡細胞數、肺血管通透性、肺水含量增加,PaO2下降的結果相一致,表明熱打擊可引起肺水腫及肺組織細胞凋亡,最終導致肺損傷,提示EHS損傷模型建立成功。
細胞凋亡是多種因素如盲腸結扎穿孔、脂多糖、缺血缺氧等誘發ALI的病理生理機制之一。研究證實,細胞凋亡是導致ALI的途徑之一,凋亡細胞越多,肺損傷越嚴重[22-23]。本研究結果顯示,EHS組大鼠肺組織凋亡細胞增多,AI升高,提示熱應激可促進細胞凋亡,而細胞凋亡可能是EHS肺損傷的發生機制之一。
自噬是存在于所有真核細胞中的一種高度保守的細胞生理學現象,能將體內受損的細胞器及各種錯誤折疊蛋白通過與溶酶體結合進行自我吞噬或降解,降解過程中產生的氨基酸及其他小分子物質可被機體再利用,維持細胞能量平衡,是機體在饑餓、創傷等多種應激條件下作出的適應性反應[24]。自噬可分為巨自噬、微自噬及分子伴侶介導的自噬3種類型,通常所說的自噬指巨自噬,也是目前研究最多的類型[25]。自噬與ALI的發生發展密切相關[26-27]。自噬與凋亡是細胞生命終點的不同表現形式,兩者之間的功能關系錯綜復雜。研究表明,自噬能抑制細胞凋亡及壞死,從而保護細胞[28]。機體在應對多種刺激時,細胞將首先啟動自噬機制,降解受損細胞器(如線粒體),從而防止觸發凋亡途徑,避免細胞凋亡或壞死[29]。EHS引起的病理生理變化類似于膿毒癥[30],EHS導致的肺損傷也與膿毒癥肺損傷極其相似。研究表明,激活自噬能減輕膿毒癥導致的肺組織細胞凋亡,緩解膿毒癥肺損傷[26,31],其激活機制可能與PI3K/Akt/mTOR信號通路及PINK1/Parkin信號通路有關[6]。本研究結果顯示,經Baf A1預處理后,大鼠肺組織細胞自噬水平下降,凋亡細胞數及AI與EHS組比較進一步增高,而RAPA預處理后,大鼠肺組織細胞自噬水平升高,凋亡細胞數及AI均明顯降低,表明熱打擊能促進細胞凋亡,降低大鼠肺組織細胞的自噬水平,從而加重肺損傷;通過上調自噬可以減輕此損傷。
此外,自噬還參與調節機體的炎癥反應,并與慢性阻塞性肺疾病、肺炎、膿毒癥等炎癥性疾病相關[31-32]。研究表明,上調自噬能減輕機體的炎癥反應,自噬可通過抑制炎癥相關信號轉導及T細胞分化、清除炎癥介質、抑制炎癥反應等減輕炎癥損傷[33-34]。
LC3分為Ⅰ型、Ⅱ型,是酵母自噬相關基因8(autophagy-related gene 8,Atg8)在哺乳動物中的同源基因。未發生自噬時,可溶性的LC3-Ⅰ型蛋白分布于細胞表面;當自噬發生時,位于細胞表面的LC3-Ⅰ與磷脂酰乙醇胺耦聯形成LC3-Ⅱ并附著在自噬體膜上,由于LC3-Ⅱ始終穩定地定位于自噬體膜上,直到與溶酶體融合,理論上可以通過計算LC3-Ⅱ或LC3-Ⅱ/LC3-Ⅰ的比值來評價自噬水平的高低。但有研究指出LC3-Ⅱ在自噬流受阻的情況下也可出現高表達[35],故單純通過LC3-Ⅱ水平來判斷自噬活性是非常武斷的,而LC3-Ⅱ/LC3-Ⅰ的比值更能反映自噬的真實強度。p62被認為是選擇性的自噬受體蛋白,能同時連接待降解的泛素化底物和LC3蛋白。當自噬被激活時,p62結合泛素化底物蛋白分子進入自噬小體,并與溶酶體結合形成自噬溶酶體,隨后被溶酶體中的水解酶降解。p62作為自噬降解底物,其表達量與自噬活性成反比,含量越低意味著自噬下游越通暢[36]。本研究通過Western blotting檢測了EHS相關ALI時自噬標志蛋白LC3及p62的表達情況,結果顯示EHS組大鼠肺組織LC3-Ⅱ/LC3-Ⅰ比值明顯低于正常對照組,而p62表達增高,提示EHS大鼠肺組織中自噬小體形成發生障礙,自噬水平降低。
Baf A1可通過抑制H+-ATP酶而阻止自噬體與溶酶體之間的融合,從而實現對自噬過程的抑制,是一種自噬抑制劑。RAPA通過抑制哺乳動物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)通路來實現對自噬過程的激活,是一種自噬增強劑。本研究分別使用Baf A1及RAPA預處理大鼠,結果顯示,與EHS組比較,Baf A1組大鼠肺組織損傷程度更嚴重,伴有肺水腫加重、肺血管通透性增加、肺細胞凋亡數增多等,病理學結果顯示肺組織中有大量炎癥細胞浸潤,肺部出現明顯的炎癥反應,LC3-Ⅱ/LC3-Ⅰ比值明顯降低,p62蛋白表達增加。相反,給予RAPA預處理后,大鼠肺部炎癥明顯緩解,肺組織凋亡細胞數減少,LC3-Ⅱ/LC3-Ⅰ比值明顯升高,p62蛋白表達水平降低,即抑制自噬會加重EHS大鼠肺損傷,上調自噬水平可能有利于減輕EHS肺損傷,提示EHS導致的肺損傷可能與自噬成熟障礙有關。
綜上所述,本研究證實EHS能導致肺損傷,肺組織自噬水平降低是EHS導致肺損傷發生的機制之一,上調自噬水平可減輕EHS大鼠的肺損傷,但其機制尚不清楚,未來仍需進一步深入研究。

