PTEN對糖尿病腎病腎間質纖維化的作用及其機制
劉興梅,沈燕,班曉霞,何玉,李紅梅,何曉蘭,張華*
1貴州省人民醫院檢驗科,貴陽 550002;2貴州省人民醫院腎內科,貴陽 550002;3貴州省人民醫院病理科,貴陽550002
據估計,全世界糖尿病的患病人數到2045年將高達7億[1]。糖尿病腎病(diabetic nephropathy,DN)是致死性最嚴重的糖尿病并發癥,也是導致腎功能不全的主要原因[2-3],隨著病情進展可發生腎小管間質纖維化。同源性磷酸酶-張力蛋白(phosphatase and tensin homolog,PTEN)可通過激活脂質磷酸酶使磷脂酰肌醇三磷酸去磷酸化轉變為磷脂酰肌醇二磷酸而失活,負性調控PI3K/Akt通路,同時可激活蛋白磷酸酶活性,負性調控黏著斑激酶/P130信號來抑制細胞的存活、增殖,從而延緩腫瘤生長[4],涉及血管[5]、心臟[6]、肺[7]和腎臟纖維化[8]等領域。已有研究發現,PTEN可通過不同信號通路影響腎臟纖維化的進程[9-13]。自噬為溶酶體降解途徑,可參與細胞質成分降解,以維持細胞功能和代謝的平衡[14-15]。微管相關蛋白1A/1B-輕鏈3(LC3)和P62分別是自噬起始和完成的標志物,且LC3 Ⅱ與LC3 Ⅰ的比值常用于監測自噬的激活[16]。激活轉錄因子4或嘌呤能受體可通過抑制自噬促進腎間質纖維化[17-18]。可見,PTEN、自噬均在DN的發病機制中扮演重要角色。然而,PTEN與自噬及腎間質纖維化三者間的相互作用機制尚不完全清楚。本研究旨在觀察PTEN在高糖環境下對大鼠近端腎小管上皮細胞的作用,并探討體外干預PTEN表達對自噬及腎間質纖維化的影響機制,以期為DN的臨床治療尋找新的有效靶點。
1 材料與方法
1.1 細胞及試劑 大鼠近端腎小管上皮細胞(NRK52E)購自美國ATCC細胞庫。ClarityTMWestern ECL substrate購自美國Bio-Rad公司,DMEM培養基、胎牛血清購自美國Gibco公司,雷帕霉素購自美國MedChem Express公司,鼠抗β-actin單克隆抗體購自中國普美生物科技公司,兔抗PTEN和兔抗P62單克隆抗體購自英國Abcam公司,兔抗LC3A/B單克隆抗體購自美國CST公司,兔抗Ⅰ型膠原和Ⅲ型膠原蛋白單克隆抗體購自美國Sigma公司。自噬雙標腺病毒mRFP-GFP-LC3質粒購自上海漢恒生物科技有限公司,過表達PTEN質粒(CKP04-PTEN)購自中國普美生物科技公司。
1.2 方法
1.2.1 細胞培養 大鼠近端腎小管上皮細胞N R K 5 2 E 用含1 0%胎牛血清及D M E M 培養基在37 ℃、5% CO2培養箱中培養,待細胞融合度達80%~90%時進行細胞傳代。吸掉原培養液,PBS清洗,吸干PBS后加入1 ml 0.25%胰蛋白酶消化細胞,1:4傳代。
1.2.2 Western blotting檢測PTEN、LC3、P62、Ⅰ型和Ⅲ型膠原蛋白表達水平 將對數生長期NRK52E細胞隨機分為3組:正常糖(NC,5.5 mmol/L葡萄糖)組、高糖(HG,30 mmol/L葡萄糖)組、高滲(MA,5.5 mmol/L葡萄糖+24.5 mmol/L甘露醇)組。培養48 h后,吸棄各組細胞培養基,PBS洗3次,吸干后加入細胞裂解液1 ml (含RIPA裂解液980 μl/ml,PMSF 10 μl/ml,磷酸酶抑制劑10 μl/ml),充分裂解,用細胞刮刀刮下細胞,將蛋白質上清轉至另一無菌1.5 ml EP管。BCA法進行蛋白樣品定量,根據測得的蛋白濃度,加入2×SDS-PAGE蛋白上樣緩沖液使各樣品濃度為3 μg/μl,充分混勻,沸水煮開10 min,進行蛋白樣品變性。然后依次進行制膠,電泳,轉膜,封閉,洗膜,分別加入一抗PTEN(1:1000)、LC3(1:1000)、P62(1:1000)、Ⅰ型膠原蛋白(1:1000)、Ⅲ型膠原蛋白(1:800)和抗β-actin(1:4000),4 ℃冰箱搖床孵育過夜,洗膜,然后加入二抗(1:4000)孵育,洗膜,ECL液浸泡顯色,Bio-Rad凝膠成像系統自動掃描膠片,檢測PVDF膜上的目的蛋白,ImageJ軟件分析條帶強度。
1.2.3 激光共聚焦顯微鏡觀察自噬流 將對數生長期NRK52E細胞隨機分為3組:正常糖對照(NG)組、高糖對照(HG)組和高糖過表達PTEN(HG+pPTEN)組,然后各組轉染自噬雙標腺病毒mRFP-GFP-LC3質粒16 h,吸棄細胞培養基,換成含10% FBS的DMEN培養基,在HG+pPTEN組細胞中使用LipofectamineTM3000轉染PTEN過表達質粒,同時每組細胞加入100 nmol/L的自噬誘導劑雷帕霉素,以提高整體自噬水平,便于觀察各組間自噬的差異,共培養48 h,以復溫的PBS(37 ℃)清洗2次,每孔加入200 μl 4%多聚甲醛,室溫固定30 min后冷PBS洗3次,DAPI染核,室溫10 min,冷PBS洗2次,留少許PBS,加入蓋玻片封片,激光共聚焦顯微鏡觀察自噬變化。采用自噬溶酶體(mRFP)標記及追蹤LC3,mRFP呈紅色斑點,紅綠熒光(RFP+GFP)合并后呈黃色斑點即自噬體,通過不同顏色斑點計數可清楚觀察自噬流。
1.2.4 熒光顯微鏡觀察Ⅰ型和Ⅲ型膠原表達的變化
細胞分組同1.2.3。HG組細胞采用LipofectamineTM3000轉染PTEN過表達質粒,6 h后去掉細胞培養基,換成含10% FBS的DMEN培養基,培養48 h,以復溫的PBS(37 ℃)洗2次,每孔加入200 μl 4%多聚甲醛,室溫固定30 min后,用冷0.2%聚乙二醇辛基醚洗3次,3% BSA封閉1 h,冷PBS清洗3次,加入最佳稀釋比例PTEN抗體(1:200)、Ⅰ型膠原蛋白抗體(1:200)和Ⅲ型膠原蛋白抗體(1:200),4 ℃孵育過夜,冷PBS清洗,加入二抗(Cy3標記羊抗兔,稀釋比例1:150)室溫孵育3 h,冷PBS清洗,DAPI染核,室溫10 min,冷PBS清洗,留少許PBS,加入蓋玻片封片,熒光顯微鏡下觀察膠原的染色變化。
1.3 統計學處理 采用SPSS 19.0軟件進行統計分析。數據符合正態分布,且通過方差齊性檢驗,均以±s表示,多組間比較采用單因素方差分析,進一步兩兩比較采用SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 高糖培養NRK52E細胞中P TEN的表達Western blotting檢測結果顯示,與NG組比較,HG組PTEN表達水平明顯降低(P<0.01),而MA組PTEN表達水平無明顯變化,因而排除了滲透壓對PTEN表達的影響(圖1)。
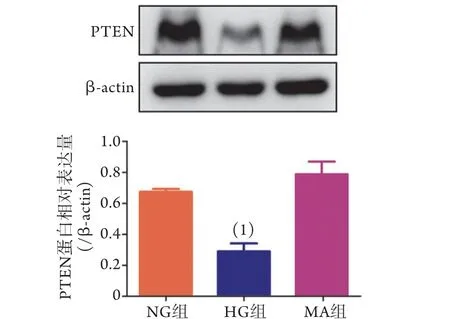
圖1 各組NRK52E細胞PTEN蛋白的表達水平(Western blotting,n=3)Fig.1 Protein expression levels of PTEN in NRK52E cells of each group (Western blotting)(n=3)
2.2 高糖培養NRK52E細胞中LC3、P62、Ⅰ型和Ⅲ型膠原蛋白的表達 Western blotting檢測結果顯示,與NG組比較,HG組LC3表達降低(P<0.05),P 6 2、Ⅰ型和Ⅲ型膠原蛋白表達水平明顯升高(P<0.05或P<0.01),而MA組LC3、P62、Ⅰ型和Ⅲ型膠原蛋白的表達水平差異無統計學意義(P>0.05)(圖2)。
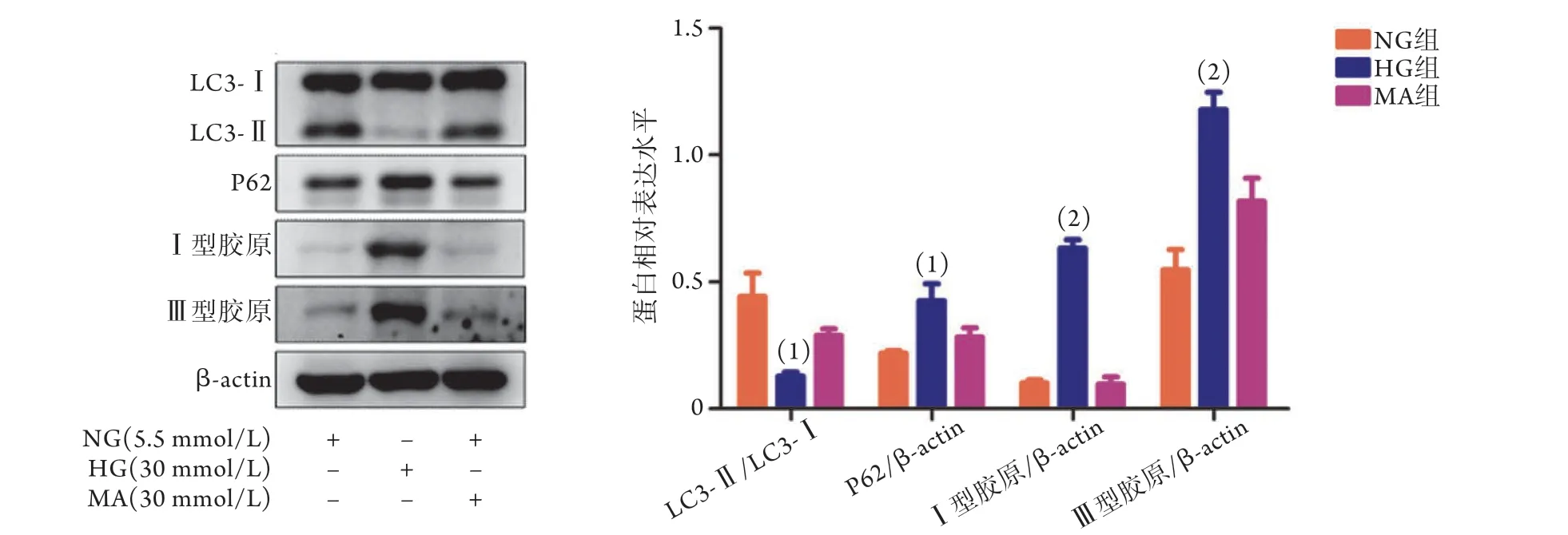
圖2 各組NRK52E細胞中LC3、P62、Ⅰ型和Ⅲ型膠原蛋白的表達水平(Western blotting, n=3)Fig.2 Protein expression levels of LC3, P62, collagen-Ⅰ and collagen-Ⅲ in NRK52E cells (Western blotting, n=3)
2.3 激光共聚焦顯微鏡觀察自噬流變化 激光共聚焦顯微鏡觀察結果顯示,與NG組比較,HG組紅色斑點和黃色斑點數減少,HG+pPTEN組紅色斑點變化不大,黃色斑點數有所增加。與HG組比較,HG+pPTEN組紅色斑點和黃色斑點數明顯增加(圖3)。
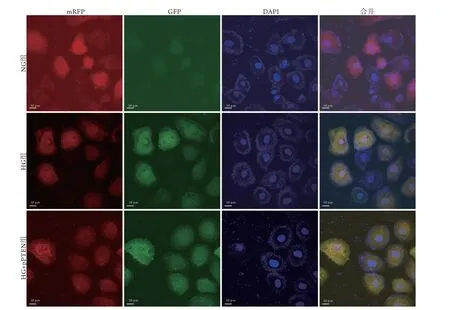
圖3 激光共聚焦顯微鏡檢測過表達PTEN后NRK52E細胞中自噬流變化Fig.3 Changes of autophagic flow in NRK52E cells analyzed by laser confocal microscopy, using pPTEN plasmid over-expressed PTEN
2.4 PTEN對膠原表達的影響 細胞熒光染色結果顯示,與NG組比較,HG組PTEN紅色熒光減弱,膠原熒光染色增強,HG+pPTEN組PTEN染色有所恢復,膠原染色無明顯變化。與HG組比較,HG+pPTEN組PTEN紅色熒光增強,膠原熒光染色減弱(圖4)。
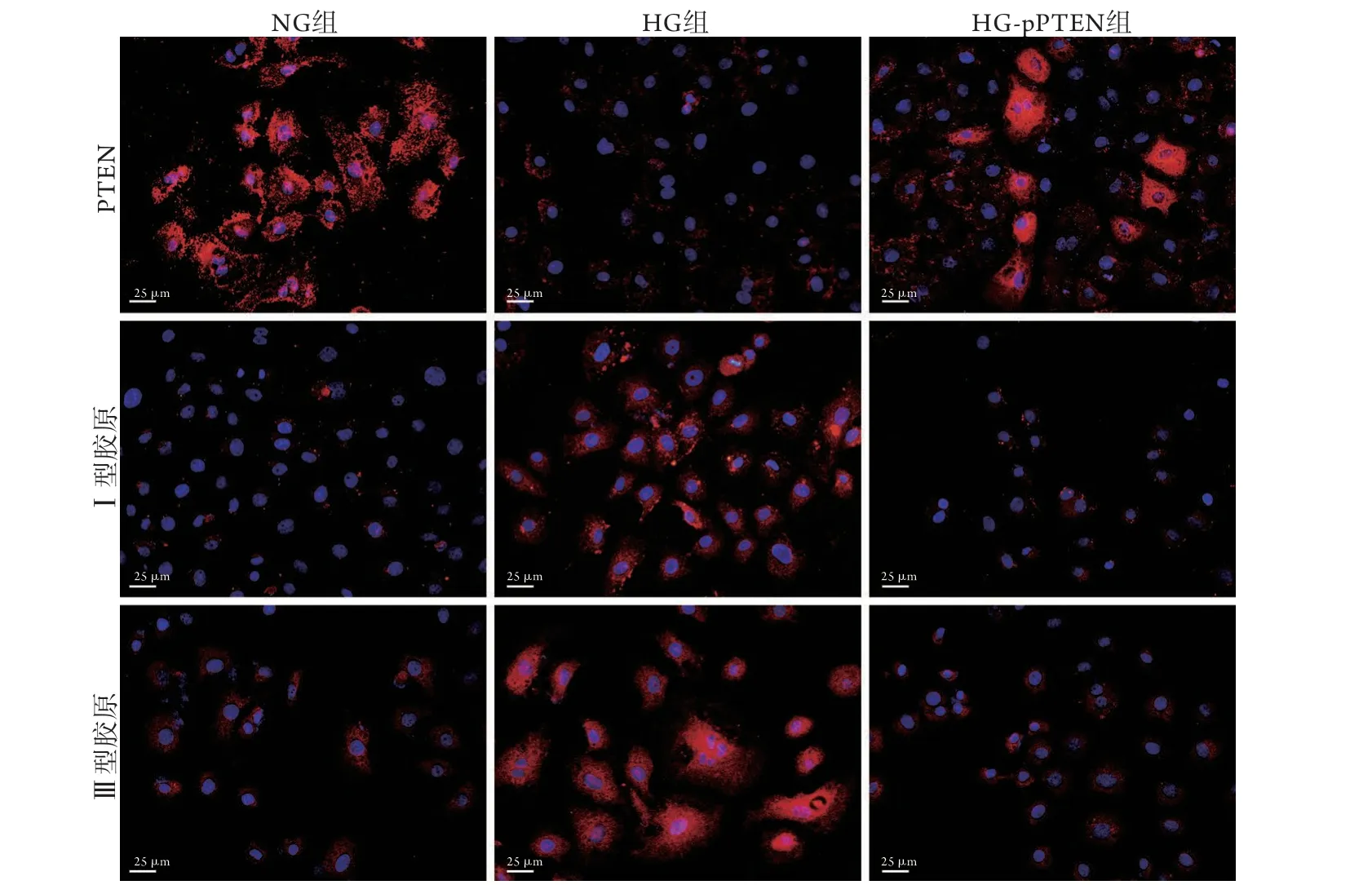
圖4 NRK52E細胞PTEN及Ⅰ型和Ⅲ型膠原蛋白免疫熒光染色Fig.4 PTEN, collagen-Ⅰ and collagen-Ⅲ protein in NRK52E cells(Immunofluorescence staining)
3 討 論
隨著病程進展,DN將發展為慢性腎臟病,是終末期腎病(end-stage renal disease,ESRD)的主要原因[19]。DN的特征之一為細胞外基質(extracellular matrix,ECM)蛋白如腎小球和基底膜的系膜和腎小管間質中的膠原、層黏蛋白和纖維連接蛋白(fibronectin,FN)的沉積;ECM表達增加可使腎小球和腎小管基底膜增厚,系膜基質增多,最終導致腎小球硬化和腎小管間質纖維化[20]。在DN中,腎小管間質病變和間質纖維化一直備受關注[21]。高糖、蛋白尿和晚期糖基化終末產物具有固有的腎小管毒性,均可能觸發間質性炎癥并引起纖維化反應,從而導致腎間質纖維化[22]。有研究發現,PTEN去磷酸化并激活肌動蛋白解聚因子cofilin-1,導致F-肌動蛋白形成,促進肥胖相關的腎小球足細胞損傷引起腎小球病變[23]。通過抑制TGF-β和Notch信號通路,進而維持PTEN的表達,可有效減緩UUO模型中的腎臟纖維化[24]。顯而易見,PTEN在腎臟纖維化過程中扮演著重要角色。本研究觀察到高糖刺激NRK52E細胞后,膠原的表達增加并伴隨PTEN的表達降低。以甘露醇作為高糖的滲透控制劑,結果顯示MA組PTEN蛋白表達水平與NG組比較無變化,排除了高滲的影響,提示PTEN與腎小管間質纖維化存在一定的內在聯系。有研究發現,鏈脲佐菌素誘導的糖尿病小鼠存在明顯的PTEN蛋白下調,蛋白尿以及FN、α-平滑肌肌動蛋白(α-smooth muscle actin,α-SMA)和Ⅰ型膠原等纖維化因子增加,腎臟間質纖維化加重;利用芒果苷治療可預防腎間質纖維化,表現為FN、Ⅰ型膠原和α-SMA陽性表達減少,同時上調PTEN,并降低PI3K和Akt的磷酸化,提示芒果苷可能通過上調PTEN,并降低PI3K和Akt的磷酸化途徑抑制Ⅰ型膠原、FN和α-SMA的升高,從而減輕DN中的炎癥和氧化應激,最終抑制腎間質的纖維化[25]。然而,PTEN在糖尿病腎間質纖維化病理機制中如何發揮作用仍然不完全清楚。
自噬是真核細胞周期中一個高度保守的過程,通過降解細胞質中的細胞器、蛋白質和大分子以及降解產物的循環,在細胞的生長、增殖和維持細胞環境的穩定性中發揮重要作用[26]。自噬功能失調可能參與DN的發生發展[27]。腎臟細胞中基本水平的自噬對維持腎臟內環境平衡必不可少,但在外界壓力下自噬將發生改變,一旦自噬失調,可誘導急性及慢性腎病的發生。足細胞自噬、近端腎小管上皮細胞中線粒體自噬的改變將導致腎功能變化[28]。UUO模型中特異性敲除遠端腎小管上皮細胞Atg7基因后,自噬受到明顯抑制,可進一步加重細胞凋亡與腎小管細胞纖維化[29]。用STZ誘導DN的動物研究中發現,敲除IL-17A可影響自噬形成過程,使細胞內穩態失衡,促進DN的發生發展[30]。本研究發現,高糖刺激近端腎小管上皮細胞后自噬被抑制,腎間質纖維化加重,提示在高糖環境下,PTEN介導的腎臟間質纖維化過程中自噬水平明顯降低。
研究發現,自噬在DN的發病機制中具有重要作用[31-32],但目前尚不清楚PTEN、自噬與腎間質纖維化間的關系。Sun等[33]證實,抑制DN模型中的miR-217可靶向調控PTEN表達,進一步恢復足細胞自噬,從而拮抗足細胞損傷及胰島素抵抗。Guo等[34]發現,二氫楊梅素在治療DN時,可通過抑制PI3K/Akt/mTOR通路增強自噬水平,調節miR-155-5p/PTEN表達,從而緩解腎間質纖維化。Chen等[35]在齊墩果酸治療DN的研究中也發現,齊墩果酸可通過抑制miR-142-5p促進PTEN表達和細胞自噬,進而抑制HG誘導的NRK52E細胞纖維化。可見,體外通過藥物靶向提高PTEN和自噬相關蛋白的表達是治療DN的關鍵點。本研究在高糖培養的近端腎小管上皮細胞中轉染PTEN過表達質粒,使用RFP-GFP-LC3雙標腺相關病毒感染NRK52E細胞,并在各處理組加入100 nmol/L的自噬誘導劑雷帕霉素以提高整體自噬水平,便于更好地觀察各組自噬流的動態變化,結果發現,與NG組比較,HG組紅色斑點和黃色斑點數減少,HG+pPTEN組紅色斑點變化不大,黃色斑點數有所增加,而與HG組比較,HG+pPTEN組紅色斑點和黃色斑點數明顯增加,提示高糖刺激使自噬受到抑制,而高糖刺激后過表達PTEN可恢復自噬水平。
PTEN是一種腫瘤抑制基因,可負性調控磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)/雷帕霉素(mTOR)途徑[36]。mTOR信號傳導圖譜表明,mTOR能通過調節關鍵細胞過程(包括蛋白質合成和自噬)來控制生物能量積累和代謝,而mTOR蛋白復合體1可影響自噬激活激酶1和ATG13,抑制細胞成分的自噬分解[37]。在DN腎間質纖維化過程中,PTEN可能通過PI3K/Akt/mTOR通路,靶向調控自噬的發生、發展。本研究發現,與NG組比較,HG組PTEN紅色熒光減弱,膠原熒光染色增強,HG+pPTEN組PTEN染色有所恢復,膠原染色無明顯變化,與HG組比較,HG+pPTEN組PTEN紅色熒光增強,膠原熒光染色減弱,提示高糖使細胞PTEN表達降低、膠原表達增加,而過表達PTEN可使高糖刺激下的自噬抑制被解除,并降低膠原的表達,因此,高糖培養近端腎小管上皮細胞轉染PTEN過表達質粒后,可通過改變自噬水平緩解DN的纖維化進程。
綜上所述,本研究發現,在DN的發生發展過程中,PTEN可通過恢復自噬緩解腎臟纖維化。然而,在高糖環境下過表達PTEN的干預實驗中,我們沒有進一步檢測具體的PTEN蛋白、自噬相關蛋白、膠原的定量表達,并探討更深層次的分子機制,因而存在一定的局限性。PTEN的調控機制復雜,今后需要有更多研究去揭示PTEN在DN中的調控作用,為PTEN用于DN的臨床治療提供理論基礎。

