同一來源不同惡性程度的Hepa1-6腫瘤細胞惡性相關基因表達、增殖能力及腫瘤微環境免疫細胞表型變化比較
徐夕冶 柳迪 唐麗
(1 青島大學基礎醫學院,山東 青島 266071; 2 軍事科學院軍事醫學研究院生命組學研究所)
惡性腫瘤起源于獲得特定遺傳改變的單個體細胞,其發生是一個復雜且不斷適應的過程[1],該過程涉及到許多腫瘤細胞本身功能的改變,包括細胞分化狀態、端粒維持、細胞增殖控制、營養環境變化適應、血管生成能力、避免細胞死亡等[2]。免疫系統的生理功能之一是在腫瘤形成后對其進行殺傷,在腫瘤細胞和免疫系統博弈的過程中有一部分腫瘤細胞可逃避免疫系統的殺傷,塑造免疫抑制性微環境,獲得免疫監視適應,最終產生一些原有腫瘤所不具備的生物學特性,促進腫瘤發生[3-7]。已有研究表明,體內已經產生的腫瘤,在外界藥物刺激下可逐漸進化[4],相較之下,機體自身因素對腫瘤進化的作用尚不十分清楚。本研究誘導相同腫瘤模型但惡性程度不同的腫瘤細胞,通過檢測特征基因的表達水平、體外增殖能力以及體內成瘤能力評價腫瘤細胞惡性程度,分析其惡性程度與腫瘤微環境免疫細胞表型的相關性,并首次探究機體自身因素導致的腫瘤細胞惡性化過程中,介導免疫抑制性微環境形成的關鍵免疫細胞亞群。現將結果報告如下。
1 材料和方法
1.1 動物來源
6~8周齡C57BL/6小鼠購自北京維通利華實驗動物技術有限公司,動物合格證號為SCXK(京)2021-0006,動物飼養于北京國家蛋白質科學中心動物房SPF級環境中。
1.2 主要試劑
CCK8檢測試劑盒購自金普來公司,RNA提取試劑盒購自德國QIAGEN公司,反轉錄試劑盒購買于日本TaKaRa公司,熒光定量PCR(qPCR)試劑盒購自日本TOYOBO公司,抗小鼠CD163-PerCP-eFlour710、Foxp3-FITC、IFNγ-PE、CTLA-4-APC、PD-1-APC-eFlour?780、Granzyme B-FITC抗體購買于美國Thermo Fisher公司,抗小鼠Ly6G-PE、CD11b-BUV395、CD3-BV421、NK1.1-BV510、CD4-PE-Cy7抗體購買于美國BD公司,抗小鼠CD16/CD32、F4/80-APC、CD11c-PE-Cy7、Ly6C-FITC、CD45-redFluorTM710抗體及死活染料購買于美國Tonbo公司,引物由北京六合華大基因科技有限公司合成。
1.3 細胞系來源、培養及傳代
原始Hepa1-6小鼠肝癌細胞系購自北京協和細胞資源中心。將5×105個原始Hepa1-6細胞種植到C57BL/6小鼠皮下,30 d后流式分選荷瘤小鼠瘤內腫瘤細胞,經體外培養后獲得一輪馴化細胞系Hepa1-6-A。將5×105個Hepa1-6-A細胞種植到C57BL/6小鼠皮下,30 d后流式分選荷瘤小鼠瘤內腫瘤細胞,經體外培養后獲得二輪馴化細胞系Hepa1-6-B。
將細胞置于37 ℃、含體積分數0.05 CO2的細胞培養箱中用含質量濃度100 g/L FBS的DMEM培養基培養。待細胞匯合度達到90%時,加入胰酶消化。消化2~3 min后顯微鏡下觀察細胞形態,細胞呈圓形時加入等體積含質量濃度100 g/L FBS的DMEM培養基終止消化。混勻成單細胞懸液后轉移至離心管,1 000 r/min離心5 min。棄上清液,加入適量含質量濃度100 g/L FBS的DMEM培養基重懸沉淀,按1∶2比例傳代培養。培養至對數生長期的細胞用于后續實驗。
1.4 采用qPCR法檢測3種細胞系當中己糖激酶2(HK2)、堿性螺旋環螺旋轉錄因子(Twist1)、波形蛋白(VIM)、B淋巴細胞瘤-2(BCL-2)、細胞周期蛋白B1(CCNB1)及巨噬細胞集落刺激因子(M-CSF)mRNA表達
通過QIAGEN RNA提取試劑盒和自動核酸提取儀分別提取3種細胞的RNA,按照反轉錄試劑盒提供的標準步驟進行反轉錄反應,獲取cDNA,以cDNA作為模板進行qPCR反應。以GPDH為內參分析目的基因表達。引物名稱及其序列見表1。

表1 引物名稱及其序列Tab.1 Primer names and sequences
1.5 CCK-8法檢測3種細胞增殖能力
收集處于對數生長期的細胞,計數后制備細胞懸液(2×108個/L),接種在96孔板中(0.1 mL/孔),培養4 h待細胞貼壁后,根據CCK-8試劑盒說明書要求,每孔中加入CCK-8試劑10 μL,繼續培養4 h后,以酶標儀測定波長450 nm處的吸光度值,以吸光度值代表細胞增殖能力。
1.6 小鼠腫瘤模型的建立
取對數生長期的細胞,胰酶消化成單細胞懸液,用DMEM培養基洗滌細胞2次后計數,于每只小鼠右側脅部皮下注射0.1 mL細胞懸液,細胞數量為1×106或5×105個,按照注入腫瘤細胞的不同對小鼠進行分組,Hepa1-6組8只,Hepa1-6-A組10只,Hepa1-6-B組13只,建模后定期觀察各組小鼠的狀態。
1.7 腫瘤體積及質量測定
建模當天為第0天,從第4天開始,每隔2天用游標卡尺測量小鼠皮下種植腫瘤的長徑(a)及與之垂直的短徑(b),計算腫瘤體積(V),V=a×b2/2 mm3,測量至第16天,繪制腫瘤生長曲線。建模第16天,小鼠脫頸處死,剖離腫瘤組織,剔除周圍脂肪和結締組織后進行稱量,記錄腫瘤質量。
1.8 腫瘤組織流式檢測樣本的制備
將1.7中剖離的腫瘤組織放至1 mL含1 g/L膠原酶和100 g/L FBS的DMEM培養基之中[5],將腫瘤組織剪碎,并置于37 ℃溫箱中進行消化。20 min后吹散組織,吸取少量上清液至培養皿中,置于顯微鏡下觀察消化情況,當鏡下出現大量大小不一的細胞時,則加入1 mL含有100 g/L FBS的 DMEM培養基終止消化。吹散組織,濾網過濾,在4 ℃下1 526 r/min離心5 min以后棄上清液,加入適量1×紅細胞裂解液裂解紅細胞,1 min以后用等體積含100 g/L FBS的DMEM培養基終止紅細胞裂解,再經1 526 r/min離心3 min后,用 PBS洗滌細胞2次后,棄上清液進行后續流式抗體標記。
1.9 流式細胞術檢測腫瘤組織免疫細胞亞群
用Fc-Shield封閉細胞上的Fc受體,防止后續熒光素偶聯抗體與細胞的非特異性結合。細胞與表面標記抗體在4 ℃下孵育30 min,按照說明書標記死活染料,排除死細胞。對于需要進行胞內抗體標記的標志物叉頭框蛋白P3(Foxp3)、Ⅱ型干擾素(IFNγ)、細胞毒性T淋巴細胞相關蛋白4(CTLA-4)和顆粒酶B(Granzyme B),先固定破膜后再加入抗體避光孵育30 min,孵育后用固定破膜Buffer洗滌細胞,1 526 r/min離心3 min后加0.2 mL Buffer重懸沉淀并轉移至流式上樣管。使用BD Fortessa流式細胞儀對1.2中所列流式抗體對應指標進行檢測,用FlowJo軟件對數據進行分析。
1.10 統計學處理
采用GraphPad Prism 7和SPSS 23.0軟件對數據進行統計分析,多組間比較采用單因素方差分析(任意兩組間比較采用q檢驗),兩組間比較采用t檢驗,多組不同時間比較采用重復測量設計的方差分析,兩變量之間的關系采用Pearson相關性分析,以P<0.05為差異具有統計學意義。
2 結 果
2.1 3組細胞系中各基因表達水平比較
qPCR結果顯示,各組間HK2、BCL-2 mRNA表達水平比較差異具有顯著性(F=22.557、34.604,P<0.05),與Hepa1-6細胞相比較,Hepa1-6-A和Hepa1-6-B細胞中以上基因表達水平顯著增高(q=6.658~12.327,P<0.05)。此外,各組間的VIM、Twist1、CCNB1和M-CSFmRNA表達水平比較差異具有顯著性(F=10.897~195.234,P<0.05),與Hepa1-6和Hepa1-6-A細胞相比,Hepa1-6-B細胞中以上基因表達水平均呈顯著增高(q=4.692~22.190,P<0.05)。見表2。

表2 3組細胞系中各基因表達水平比較Tab.2 Comparison of gene expression levels between the three groups of cells
2.2 3組細胞系增殖能力比較
CCK8檢測結果顯示,Hepa1-6、Hepa1-6-A和Hepa1-6-B細胞吸光度值分別為1.13±0.08、1.18±0.11、3.43±0.21,組間比較差異具有顯著意義(F=645.459,P<0.05),與Hepa1-6、Hepa1-6-A細胞相比,Hepa1-6-B細胞體外增殖能力更強(q=37.585、40.357,P<0.05),Hepa1-6和Hepa1-6-A細胞的增殖能力比較差異無顯著性(P>0.05)。
2.3 3組細胞系構建小鼠腫瘤模型后腫瘤生長情況比較
以小劑量腫瘤細胞(5×105)構建Hepa1-6腫瘤模型后,小鼠第6天荷瘤率為0,以大劑量腫瘤細胞(1×106)構建Hepa1-6腫瘤模型后,小鼠第6天荷瘤率可達90%,而小劑量腫瘤細胞(5×105)構建小鼠Hepa1-6-A、Hepa1-6-B腫瘤模型,小鼠第6天荷瘤率即達100%。重復測量設計方差分析結果顯示,時間、組別及時間與組別交互作用對腫瘤體積具有明顯影響(F時間=26.977,F組別=127.599,F交互=4.613,P<0.05),Hepa1-6-B組腫瘤生長從第6天起明顯快于Hepa1-6-A組(F=8.033~43.418,P<0.05)。見表3。Hepa1-6、Hepa1-6-A和Hepa1-6-B組第16天腫瘤質量分別為(0.29±0.12)、(0.36±0.20)、(0.72±0.19)g,組間腫瘤質量比較差異具有顯著性(F=18.898,P<0.05),Hepa1-6-B組腫瘤質量明顯高于Hepa1-6和Hepa1-6-A組(q=6.379、8.099,P<0.05)。

表3 不同時間點3組細胞系皮下種植腫瘤體積比較Tab.3 Comparison of the volume of subcutaneously implanted tumor between the three groups of cells at different time points
2.4 3組細胞系皮下種植腫瘤浸潤髓系細胞差異比較
流式細胞術檢測結果顯示,與Hepa1-6-A組腫瘤相比,Hepa1-6-B組腫瘤組織中性粒細胞和樹突狀細胞比例比較差異無統計學意義(P>0.05),單核細胞比例明顯降低(t=4.032,P<0.05),巨噬細胞比例明顯升高(t=2.929,P<0.05),發揮促腫瘤功能的M2型CD163+巨噬細胞和CD206+巨噬細胞比例明顯升高(t=2.619、2.870,P<0.05),詳見表4;Pearson相關性分析顯示,CD163+巨噬細胞與CD206+巨噬細胞比例和腫瘤體積呈正相關(r=0.669、0.736,P<0.05)。
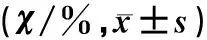
表4 3組細胞系皮下種植腫瘤浸潤髓系細胞比例比較Tab.4 Comparison of the percentage of tumor-infiltrating myeloid cells in subcutaneously implanted tumor between the three groups of cells
2.5 3組細胞系皮下種植腫瘤浸潤淋巴細胞差異比較
流式細胞術檢測結果表明,與Hepa1-6-A組相比,Hepa1-6-B組腫瘤組織中CD8+T細胞功能性標志物IFNγ、Granzyme B的表達水平均顯著降低(t=2.358、3.076,P<0.05),Treg細胞比例比較差異無顯著性(P>0.05),但IFNγ+CD8+T/Treg明顯降低(t=2.430,P<0.05)。Hepa1-6-B組腫瘤組織中CD8+T細胞抑制性標志物CTLA-4表達水平與Hepa1-6-A組比較差異無顯著性(P>0.05),但程序性死亡受體1(PD-1)表達水平呈顯著升高(t=3.693,P<0.05)。見表5。無論是Hepa1-6-A組腫瘤還是Hepa1-6-B組腫瘤,PD-1+CD8+T細胞比例與腫瘤體積均無明確相關性(P>0.05)。
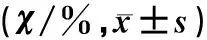
表5 3組細胞系皮下種植腫瘤浸潤淋巴細胞比例比較Tab.5 Comparison of the percentage of tumor-infiltrating lymphocytes in subcutaneously implanted tumor between the three groups of cells
3 討 論
機體的免疫系統可以對腫瘤細胞發揮監視作用,并對其進行特異性清除,然而當腫瘤細胞在各種因素的作用下逃脫機體免疫系統的監視時,腫瘤的惡性化會進一步加快,從而促進腫瘤的增殖、侵襲和轉移[6,8]。目前關于機體自身因素介導的腫瘤惡性化與免疫抑制性形成的相關性報道尚少,同時,腫瘤細胞惡性化過程中發揮關鍵作用的免疫細胞亞群也未見相關研究。
本研究通過構建小鼠腫瘤模型誘導腫瘤細胞發生惡性化,原始Hepa1-6腫瘤細胞經一輪體內建模獲得Hepa1-6-A細胞系,Hepa1-6-A細胞系經二輪建模獲得Hepa1-6-B細胞系。糖酵解關鍵酶HK2的表達與活性可影響腫瘤細胞糖酵解,進而影響腫瘤細胞增殖[9-10]。BCL-2可抑制細胞凋亡,其過度表達可以增強腫瘤細胞對大多數細胞毒素的抵抗性[11-12]。本研究的結果顯示,與Hepa1-6細胞相比較,Hepa1-6-A和Hepa1-6-B細胞中HK2、BCL-2 mRNA表達水平均顯著增高,提示體內成瘤提升腫瘤細胞的生存能力。EMT是上皮細胞來源的惡性腫瘤細胞獲得遷移和侵襲能力的重要生物學過程,Twist1通過調節間質叉頭蛋白1促進EMT的發生[13-14],VIM表達上調并通過改變細胞形狀和運動促成EMT[15];CCNB1是在有絲分裂過程中起調控作用的周期蛋白[16],并且在原發性肝癌組織中表達上調,其mRNA表達水平是影響肝癌患者總生存期和無病生存期的獨立危險因素[17]。本研究表明,與Hepa1-6和Hepa1-6-A細胞相比,Hepa1-6-B細胞中VIM、Twist1、CCNB1 mRNA表達水平顯著增高。同時,Hepa1-6-B細胞體外增殖能力與體內成瘤速度均顯著高于Hepa1-6及Hepa1-6-A細胞。以上數據表明,經體內二次成瘤后,Hepa1-6-B細胞的惡性程度顯著增強。上述體內成瘤介導的腫瘤惡性化反映了相同來源的腫瘤細胞在體內由低惡性轉變為高惡性的自然變化過程,因此利用該模型有可能從機體自身角度探討腫瘤細胞惡性化的機制。
腫瘤微環境中免疫細胞的表型和功能與腫瘤惡性程度直接相關。單核細胞可從脈管系統外滲到原發腫瘤部位,通過細胞因子介導的細胞死亡和吞噬作用直接殺死腫瘤細胞從而發揮抗腫瘤作用[7]。微環境因素同時促使單核細胞分化為腫瘤相關巨噬細胞(TAM),繼而形成抗腫瘤型TAM以及促腫瘤型TAM[18],后者通常以CD163或者CD206作為標志物[19-21]。本研究結果顯示,Hepa1-6-B組腫瘤組織中單核細胞比例明顯降低,巨噬細胞特別是促腫瘤型CD163+巨噬細胞和CD206+巨噬細胞比例顯著增高。更為重要的是,在Hepa1-6-B細胞腫瘤模型中,CD163+巨噬細胞和CD206+巨噬細胞比例與腫瘤體積呈正相關,但在Hepa1-6-A細胞腫瘤模型中,兩者卻無明確相關性。此外,本研究結果顯示,與Hepa1-6和Hepa1-6-A細胞相比,Hepa1-6-B細胞中促進巨噬細胞存活及分化的M-CSFmRNA表達水平顯著升高[22],初步提示腫瘤細胞與巨噬細胞形成的細胞間動態相互作用環路可能是影響腫瘤惡性程度的重要因素。
腫瘤抗原經抗原提呈細胞呈遞后,T細胞成為腫瘤殺傷功能的主要執行者[23-25]。本研究結果表明,Hepa1-6-B腫瘤組織中細胞毒性IFNγ+CD8+T細胞、Granzyme B+CD8+T細胞比例以及IFNγ+CD8+T/Treg均顯著降低,說明腫瘤惡性進展中CD8+T細胞逐步喪失活性。PD-1作為免疫檢查點與其配體結合后抑制CD8+T細胞增殖、活化和細胞毒性因子的分泌,促進T細胞耗竭[26-27],其表達水平是微環境免疫抑制性的重要評價指標[28-30]。本研究結果顯示,與Hepa1-6-A組腫瘤組織相比,Hepa1-6-B組腫瘤組織中CD8+T細胞高表達PD-1,但無論是Hepa1-6-A組腫瘤還是Hepa1-6-B組腫瘤,PD-1+CD8+T細胞比例與腫瘤體積均無明確相關性。PD-1表達的增高可能是腫瘤惡性進展的結果而不是原因,但促腫瘤型CD163+巨噬細胞和CD206+巨噬細胞可能是機體自身因素導致腫瘤惡性化的原因之一。
綜上所述,本研究結果顯示,經二次體內成瘤后,Hepa1-6-B腫瘤細胞惡性相關基因表達水平顯著增高,體外增殖能力與體內成瘤速度明顯提升,體現出機體自身因素導致的腫瘤惡性化過程,在腫瘤惡性化的同時可增強腫瘤微環境的免疫抑制性,其中促腫瘤型CD163+巨噬細胞和CD206+巨噬細胞與免疫抑制性的形成存在顯著相關性。后續還需對體內成瘤介導的腫瘤惡性化的原因及其調控促腫瘤型CD163+巨噬細胞和CD206+巨噬細胞的具體機制進行更深入探究。
利益沖突聲明:所有作者聲明不存在利益沖突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
倫理批準和動物權利聲明:本研究涉及的所有動物實驗均已通過國家蛋白質科學中心動物倫理委員會的批準(文件號IACUC202002-27-05M)。所有動物飼養和實驗過程均嚴格按照3R原則進行。
EthicsApprovalandAnimalRight: All experimental animal protocols in this study were reviewed and approved by National Center for Protein Sciences·Beijing (Approval Letter No. IACUC-20200227-05M), and all experimental animal protocols were carried out by following the guidelines of 3R.
作者貢獻:徐夕冶、柳迪參與了研究設計;徐夕冶、柳迪和唐麗參與了論文的寫作和修改。所有作者均閱讀并同意發表該論文。
Contributions: The study was designed byXUXiyeandLIUDi. The manuscript was drafted and revised byXUXiye,LIUDi, andTANGLi. All the authors have read the last version of the paper and consented submission.

