肺癌免疫治療相關肝毒性的影響因素分析
金萌 楊光杰 王振光
(青島大學醫學部基礎醫學院,山東 青島 266100)
近年來,基于程序性細胞死亡蛋白1(PD-1)/程序性細胞死亡蛋白配體1(PD-L1)的免疫檢查點抑制劑(ICIs)被廣泛用于肺癌患者的治療,其不僅成為改善晚期肺癌患者預后的重要治療方式之一,還被應用于早期肺癌的臨床干預中[1-5]。隨著ICIs在肺癌等惡性腫瘤患者治療中的逐步應用,其所誘發的不良事件也逐漸引起重視。肝臟在免疫治療中常常發生損傷,一般表現為免疫相關性肝炎或膽管損傷,該類損傷被稱為免疫相關肝毒性(IMH)。IMH一般可被有效控制,但嚴重時也可導致患者死亡。一項回顧性分析發現,接受免疫治療的腫瘤患者中有2%出現致命性免疫相關不良事件,其中0.4%為重度IMH患者[6]。因此,早期識別IMH,尤其是重度IMH,對患者十分重要。目前,IMH發生的危險因素尚不明確,相關研究較少[7],本研究旨在探討肺癌患者PD-1/PD-L1免疫治療誘發IMH的相關影響因素,指導臨床醫生對PD-1/PD-L1抑制劑治療后的IMH進行早期預防。
1 資料與方法
1.1 一般資料
回顧性分析2016年1月1日—2020年12月31日于我院接受PD-1/PD-L1抑制劑治療的123例肺癌患者的臨床資料,一般指標包括性別、年齡、體質量指數(BMI)、是否為脂肪肝、是否為乙型肝炎、PD-1/PD-L1抑制劑治療線數(一線、二線及以上)、免疫治療藥物種類(PD-1抑制劑、PD-L1抑制劑)、免疫治療方案(PD-1/PD-L1抑制劑單藥、PD-1/PD-L1抑制劑聯合其他藥物)、腫瘤淋巴結轉移情況、腫瘤遠處轉移(肝、肺、腦、骨轉移)情況、腫瘤組織學類型(鱗癌、腺癌、小細胞癌)及晚期肺癌炎癥指數(ALI)。實驗室生化指標包括免疫治療開始前1周的嗜酸性粒細胞計數(EOS)、嗜酸性粒細胞百分比(EO%)、淋巴細胞計數(LCC)、中性粒細胞計數與淋巴細胞計數比值(NLR)、血小板計數與淋巴細胞計數比值(PLR)、乳酸脫氫酶(LDH)水平、營養預后指數(PNI)以及免疫治療前后EO%變化率(△EO%)。患者納入標準:①病理證實為肺癌者;②采用PD-1/PD-L1抑制劑治療者;③臨床及隨訪資料完整者。排除標準:①未進行病理檢查或病理檢查證實非肺癌者;②既往有其他惡性腫瘤病史者。根據患者是否發生IMH將患者分為IMH組(45例)和非IMH組(78例)。另根據2019年美國臨床腫瘤學會聯合美國國家綜合癌癥網絡發表的《免疫檢查點抑制劑治療相關毒性的管理指南》[8]將IMH患者分為G1~G4級,其中G1~G2級及非IMH患者設為非重度IMH組(112例),G3~G4級患者設為重度IMH組(11例)。
1.2 統計分析
采用SPSS 20.0軟件進行統計學分析。計量資料使用受試者工作特征曲線(ROC)選擇其最佳截斷值,將其轉化為二分類資料。計數資料和轉換為二分類資料的計量資料均采用例(χ/%)表示,組間比較采用卡方檢驗。將單因素分析有差異的臨床資料采用Enter法進行多因素的Logistic回歸分析。以P<0.05為差異有統計學意義。
2 結 果
2.1 IMH組與非IMH組患者臨床資料比較
IMH組患者性別及免疫治療前血清中EOS、EO%、PLR、LDH水平與非IMH組比較差異有顯著性(χ2=4.034~13.493,P<0.05)。見表1。

表1 IMH組與非IMH組患者臨床資料比較[例(χ/%)]

續表1
2.2 影響肺癌患者IMH多因素Logistic回歸分析
Logistic分析顯示,性別是影響肺癌患者IMH發生的獨立的危險因素(OR=4.770,95%CI=1.808~12.585,P<0.05)。見表2。計算得到其ROC曲線下面積(AUC)為0.642,靈敏度為0.400,特異度為0.885。
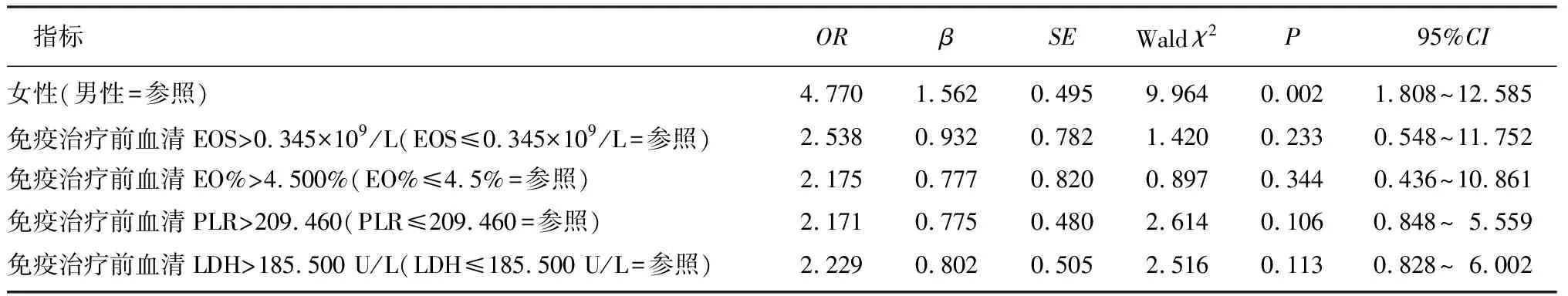
表2 影響IMH的多因素Logistic回歸分析
2.3 重度IMH組與非重度IMH組患者臨床資料比較
重度IMH組患者的△EO%及免疫治療前血清EOS、PNI與非重度IMH組相比較差異均有統計學意義(χ2=4.327~7.094,P<0.05)。見表3。

表3 重度IMH組與非重度IMH組患者臨床資料比較[例(χ/%)]

續表3
2.4 重度IMH影響因素的ROC曲線分析
繪制ROC曲線對重度IMH的影響因素進行分析,以△EO%判斷重度IMH的AUC為0.642,95%CI=0.493~0.821,靈敏度為0.727,特異度為0.587;以免疫治療前血清EOS判斷重度IMH的AUC為0.585,95%CI=0.391~0.780,靈敏度為0.273,特異度為0.947;以免疫治療前的PNI判斷重度IMH的AUC為0.580,95%CI=0.436~0.723,靈敏度為0.909,特異度為0.411。結果詳見圖1。△EO%聯合免疫治療前血清EOS判定重度IMH的AUC為0.767,靈敏度為0.909,特異度為0.545。
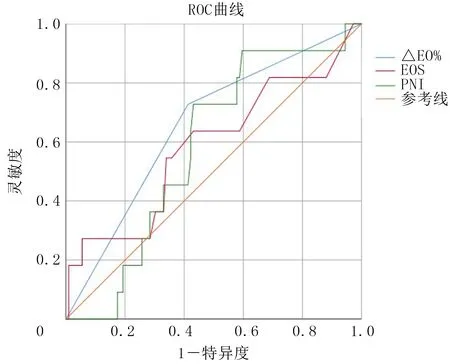
圖1 重度IMH影響因素的ROC曲線
3 討 論
PD-1/PD-L1抑制劑治療改變了肺癌患者抗腫瘤治療的前景,是肺癌有效的治療方法之一。PD-1/PD-L1抑制劑通過激活T細胞,可增強其識別和殺傷腫瘤細胞的能力[9],然而這一過程往往伴隨著機體自身組織損傷。IMH是PD-1/PD-L1抑制劑常見的治療相關不良反應之一[10]。IMH的發生可能會影響PD-1/PD-L1抑制劑的治療策略,發生重度IMH的患者被禁止再次使用PD-1/PD-L1抑制劑。因此在臨床工作中需早期識別發生IMH的高危患者,以預防IMH發生。
多項研究表明,血清EOS、EO%可作為免疫相關不良反應的有用預測指標。DIEHL等[11]的研究表明,在使用免疫治療的實體腫瘤患者中,免疫相關不良反應與免疫治療前較高的血清EOS間存在關聯,但其并未報告血清EOS與各具體類型免疫相關不良反應間的相關性。NAKAMURA等[12]的研究表明,在接受PD-1抑制劑治療的黑色素瘤患者中,免疫治療前較高的血清EOS和EO%與內分泌免疫相關免疫不良反應的發生有關。另有研究顯示,在帕博利珠單抗作為一線治療的晚期非小細胞肺癌患者中,免疫治療前較高的血清PLR與免疫相關不良反應的風險增加顯著相關[13]。本研究在上述研究結果的基礎上探究了免疫治療前各項生化指標與IMH關系,結果示免疫治療前血清EOS、EO%、PLR較高與肺癌患者IMH發生相關。
CORTELLINI等[14]報道,在接受抗PD-1單藥治療的晚期癌癥患者中女性免疫相關不良反應發生率均顯著高于男性。本研究對IMH組和非IMH組患者的多因素Logistic回歸分析顯示,性別是影響IMH發生的獨立危險因素,該結論從一定程度上對上述報道進行了印證。本研究結果還顯示,△EO%、免疫治療前血清EOS和PNI是重度IMH發生的相關影響因素。既往研究表明,免疫治療前血清EOS偏高和免疫治療1月后EO%升高均與IMH發病風險的增加相關[12]。此外,一項對晚期非小細胞肺癌患者進行的回顧性分析顯示,免疫治療前PNI較高與免疫相關不良反應的發生相關[15]。
有報道指出,相比于PD-1/PD-L1抑制劑單藥治療,PD-1/PD-L1抑制劑與其他ICIs聯合使用時,可促使各類免疫相關不良反應(尤其是重度不良反應)發生[16],而PD-1/PD-L1抑制劑聯合化療則較少導致免疫相關不良反應發生[17]。本研究中,使用PD-1/PD-L1抑制劑單藥治療的患者與使用PD-1/PD-L1抑制劑聯合化療或血管生成抑制劑治療的患者間發生IMH的情況無顯著差異,與上述結論相符。有報道顯示,乙型病毒性肝炎患者經PD-1/PD-L1抑制劑治療后發生IMH情況無異于未感染乙型病毒性肝炎患者[18-19],本研究同樣證明了乙型病毒性肝炎對使用PD-1/PD-L1抑制劑的肺癌患者IMH及重度IMH的發生無顯著影響。此外,非小細胞肺癌患者在免疫治療前若存在肺癌肝轉移,會使IMH的發生率增高[20-21]。本研究中IMH發生率在肝轉移與非肝轉移患者間差異無統計學意義,可能與本研究樣本數量較少有關。
總之,本研究闡明了肺癌患者接受PD-1/PD-L1抑制劑治療后發生IMH和重度IMH的影響因素,可以幫助臨床篩選IMH發生的高危人群,完善肺癌患者免疫治療的個性化決策,并對高危人群的IMH發生進行合理預防。

