ELK1調控PI3K/Akt信號通路促進骨肉瘤細胞增殖及其機制研究
徐永軍,董舒,王昊
(咸陽市中心醫院1.骨一科,2.骨四科,陜西 咸陽 712000)
骨肉瘤是常見的原發性惡性骨腫瘤,具有青少年兒童發病率高、疾病進展快、惡性程度高及遠處轉移和復發率高的特點[1]。盡管手術治療與化療相結合可以提高骨肉瘤患者的生存率,但骨肉瘤患者的預后仍然不能令人滿意,尤其是在初次檢查時出現臨床轉移的患者中[2]。表觀遺傳學領域的新證據表明,骨肉瘤是由遺傳改變和遺傳積累引起的。腫瘤的惡性進展取決于基因的調控,因此尋找與骨肉瘤惡性表型顯著相關及在骨肉瘤中發揮關鍵作用的基因至關重要[3]。E26轉錄因子1(E-twenty six transcription factor 1,ELK1)是屬于ETS家族和三元復合因子(ternary complex factor,TCF)亞家族的轉錄因子,在調節細胞生長、分化及存活中起關鍵作用[4]。ELK1在結直腸癌、骨肉瘤、胃癌等多種惡性腫瘤中表達升高,促進惡性腫瘤的發生、發展[5-7],而ELK1在骨肉瘤中發揮的具體生物學功能未知。PI3K/Akt信號通路是與腫瘤發生、發展密切相關的重要調控途徑[8],抑制其激活可作為抗腫瘤治療的有效策略[9]。因此,本文對ELK1在骨肉瘤中發揮的生物學功能及其通過調控PI3K/Akt信號通路的作用機制進行了初步研究,旨在獲得ELK1作為骨肉瘤治療潛在分子靶點的重要實驗室依據。
1 材料與方法
1.1 細胞與主要試劑
骨肉瘤細胞系U2OS、MG-63、HOS及正常成骨細胞hFOB11.9(中國科學院細胞庫提供),培養基、胎牛血清和胰酶(美國Hibco公司);6孔板、96孔板及培養瓶(美國Coring公司),RIPA(北京索萊寶試劑有限公司),BCA蛋白檢測試劑盒(上海碧云天生物技術有限公司),PVDF膜(美國Promega公司),ECL發光液(美國millipore公司),ELK1 siRNA(廣州銳博生物生物技術有限公司),MTS增殖檢測試劑盒(中國北京百奧萊博科技有限公司),吉姆薩染色(上海歌凡生物科技有限公司),ELK1、pPI3K和pAkt抗體(英國Abcam公司)。
1.2 細胞培養
骨肉瘤細胞系U2OS、MG-63、HOS及正常成骨細胞hFOB11.9復蘇后重懸至含有10%胎牛血清的培養基中,全濕度條件下放置在37℃、5%二氧化碳培養箱中培養。觀察培養基的顏色,變為黃色時更換新鮮培養基,細胞融合度為95%左右時,以1∶2進行細胞傳代。
1.3 Western blotting檢測ELK1蛋白相對表達量
骨肉瘤細胞系U2OS、MG-63、HOS及正常成骨細胞hFOB11.9長滿后,胰酶進行消化后收集細胞,PBS洗3次,獲得細胞斑塊,加入RIPA混勻于冰上裂解細胞10 min,4℃高速離心30 min。取4μL上清液檢測ELK1蛋白,其余的上清液移至新的EP管中,加入上樣緩沖液煮沸蛋白變性。蛋白加至SDS-PAGE凝膠中,電泳儀80 V分離蛋白,100 V轉膜(PVDF膜),PVDF膜放至8%脫脂牛奶中室溫孵育1 h,TBST洗3次,加入ELK1和內參GAPDH一抗稀釋液4℃孵育過夜,TBST洗3次后,加入兔二抗室溫孵育1 h,ECL試劑盒顯示蛋白條帶。Image J軟件分析各組細胞中ELK1的相對表達量。
1.4 細胞轉染
對常規培養中ELK1蛋白相對表達量最高的骨肉瘤細胞進行ELK1 siRNA感染。細胞呈對數生長時,胰酶進行消化后收集細胞數,以1×105個/孔接種至6孔板中,分為si-NC組(對照)、si-ELK1-1組(ELK1干擾siRNA序列1)及si-ELK1-2組(ELK1干擾siRNA序列2)。細胞貼壁后采用Lipofectamine 2000進行各組siRNA轉染,全濕度條件下放置在37℃、5%二氧化碳培養箱中培養12 h后更換新鮮培養基,轉染48 h后,按照1.3中方法檢測各組細胞中ELK1蛋白相對表達量,驗證各組ELK1 siRNA轉染效率。
1.5 MTS實驗
對常規培養中ELK1蛋白相對表達量最高的骨肉瘤細胞進行MTS實驗。細胞呈對數生長時,胰酶進行消化后收集細胞數,以1 000個/孔接種至96孔板中,分為si-NC組、si-ELK1-1組及si-ELK1-2組,按照1.4細胞轉染的方法進行轉染。轉染48 h后,向96孔板中加入30μL/孔MTS試劑,全濕度條件下放置在37℃、5%二氧化碳培養箱中孵育2 h后,檢測各孔在490 nm波長處的OD值。細胞增殖率=實驗組OD值/對照組OD值×100%。
1.6 平板克隆實驗
對常規培養中ELK1蛋白相對表達量最高的骨肉瘤細胞進行平板克隆實驗。細胞呈對數生長時,胰酶進行消化后收集細胞數,以500個/孔接種至6孔板中,分為si-NC組、si-ELK1-1組和si-ELK1-2組,按照1.4細胞轉染的方法進行轉染。全濕度條件下放置在37℃、5%二氧化碳培養箱中培養2周左右,肉眼可見克隆團形成時終止細胞培養,培養過程中培養基變黃時更換新鮮培養基。PBS洗3次,加入甲醇固定10 min,加入吉姆薩染液進行細胞染色,掃描拍照計數各組細胞克隆團形成數目,檢測各組細胞克隆形成能力。
1.7 PI3K/Akt信號通路檢測
收集轉染的各組細胞,按照1.3中Western blotting檢測si-NC組、si-ELK1-1組及si-ELK1-2組中PI3K/Akt信號通路關鍵蛋白pPI3K和pAkt的相對表達量。
1.8 SC79處理骨肉瘤細胞進行功能回復實驗
對常規培養中ELK1相對表達最高的骨肉瘤細胞進行功能回復實驗。細胞呈對數生長時,胰酶進行消化后收集細胞數,以1×105個/孔接種至6孔板中,分為si-NC組、si-ELK1組及si-ELK1+SC79組,細胞貼壁后si-NC組轉染對照siRNA、si-ELK1組轉染干擾ELK1表達效果較好的ELK1 siRNA,si-ELK1+SC79組轉染ELK1 siRNA的同時加入5μmol SC79作用48 h,采用MTS實驗和平板克隆實驗檢測各組細胞的增殖率和克隆形成能力。
1.9 統計學方法
數據分析用SPSS 17.0統計軟件。計量資料以均數±標準差(±s)表示,多組間的比較用單因素方差分析,進一步兩兩比較采用Dunnett-t法,P<0.05為差異有統計學意義。
2 結果
2.1 ELK1在骨肉瘤細胞系中的相對表達量
Western blotting結果顯示,ELK1在骨肉瘤細胞系U2OS、MG-63、HOS中 的 表 達 分 別 為(6.12±1.05)、(2.51±0.11)和(2.99±0.13),在正常成骨細胞hFOB11.9中的表達為(0.98±0.07),多組間比較差異有統計學意義(F=49.155,P=0.000),與正常成骨細胞比較,ELK1在骨肉瘤細胞系中的相對表達量均升高(P<0.05),其中,在U2OS細胞中的相對表達量最高(P<0.05)。見圖1。
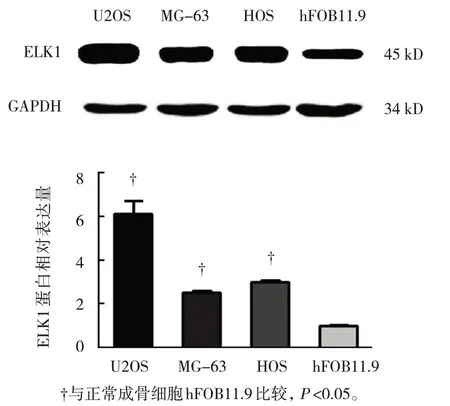
圖1 ELK1在骨肉瘤細胞系和正常成骨細胞中的相對表達量比較(±s)
2.2 ELK1 siRNA轉染效果
選擇ELK1相對表達量最高的骨肉瘤細胞U2OS進行ELK1 siRNA轉染,Western blotting結果顯示,ELK1在si-NC組、si-ELK1-1組及si-ELK1-2組U2OS細胞中的相對表達量分別為(1.95±0.35)、(0.85±0.08)和(0.62±0.09),3組比較,差異有統計學意義(F=33.195,P=0.001);與si-NC組比較,si-ELK1-1組和si-ELK1-2組U2OS細胞中ELK1蛋白的相對表達量降低(P<0.05),si-ELK1-2組的干擾效果較好,可進行后續的功能回復實驗。見圖2。
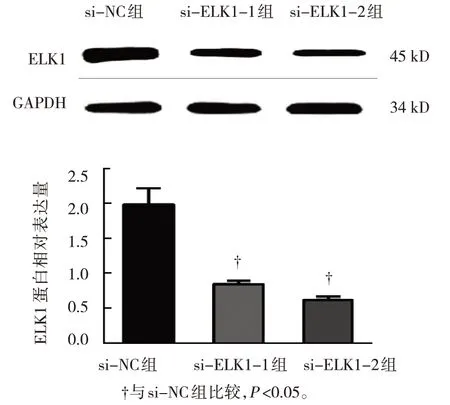
圖2 ELK1 siRNA轉染效果
2.3 干擾ELK1對U2OS細胞增殖率的影響
MTS實驗結果顯示,si-NC組、si-ELK1-1組及si-ELK1-2組U2OS細胞增殖率分別為(100.00±0.00)%、(47.22±6.22)%和(35.42±5.44)%,3組比較,差異有統計學意義(F=311.746,P=0.000);與si-NC組比較,si-ELK1-1組和si-ELK1-2組U2OS細胞增殖率降低(P<0.05)。見圖3。

圖3 干擾ELK1對U2OS細胞增殖率的影響
2.4 ELK1對U2OS細胞克隆形成能力的影響
平板克隆形成實驗結果顯示,si-NC組、si-ELK1-1組及si-ELK1-2組U2OS細胞克隆形成數目分 別 為(116.33±13.54)個、(69.67±6.29)個 和(36.67±8.42)個,3組比較,差異有統計學意義(F=49.075,P=0.000);與si-NC組比較,si-ELK1-1組和si-ELK1-2組U2OS細胞克隆形成能力降低(P<0.05)。見圖4。
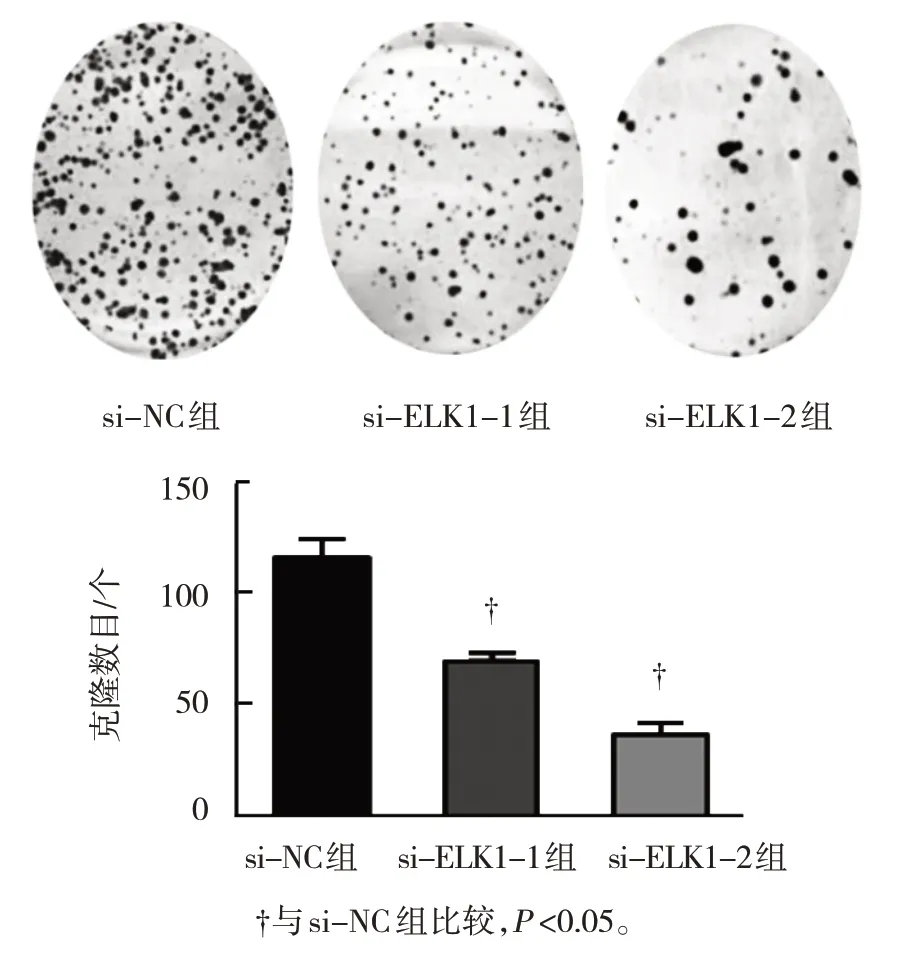
圖4 干擾ELK1對U2OS細胞克隆形成能力的影響
2.5 ELK1對U2OS細胞中PI3K/Akt信號通路的影響
Western blotting實驗結果顯示,si-NC組、si-ELK1-1組及si-ELK1-2組U2OS細胞中PI3K和Akt蛋白相對表達量比較,差異無統計學意義(P>0.05);si-NC組、si-ELK1-1組及si-ELK1-2組U2OS細胞中pPI3K和pAkt蛋白相對表達量比較,差異有統計學意義(P<0.05),si-ELK1-1組和si-ELK1-2組的pPI3K和pAkt蛋白相對表達量較si-NC組降低(P<0.05)。見表1和圖5。
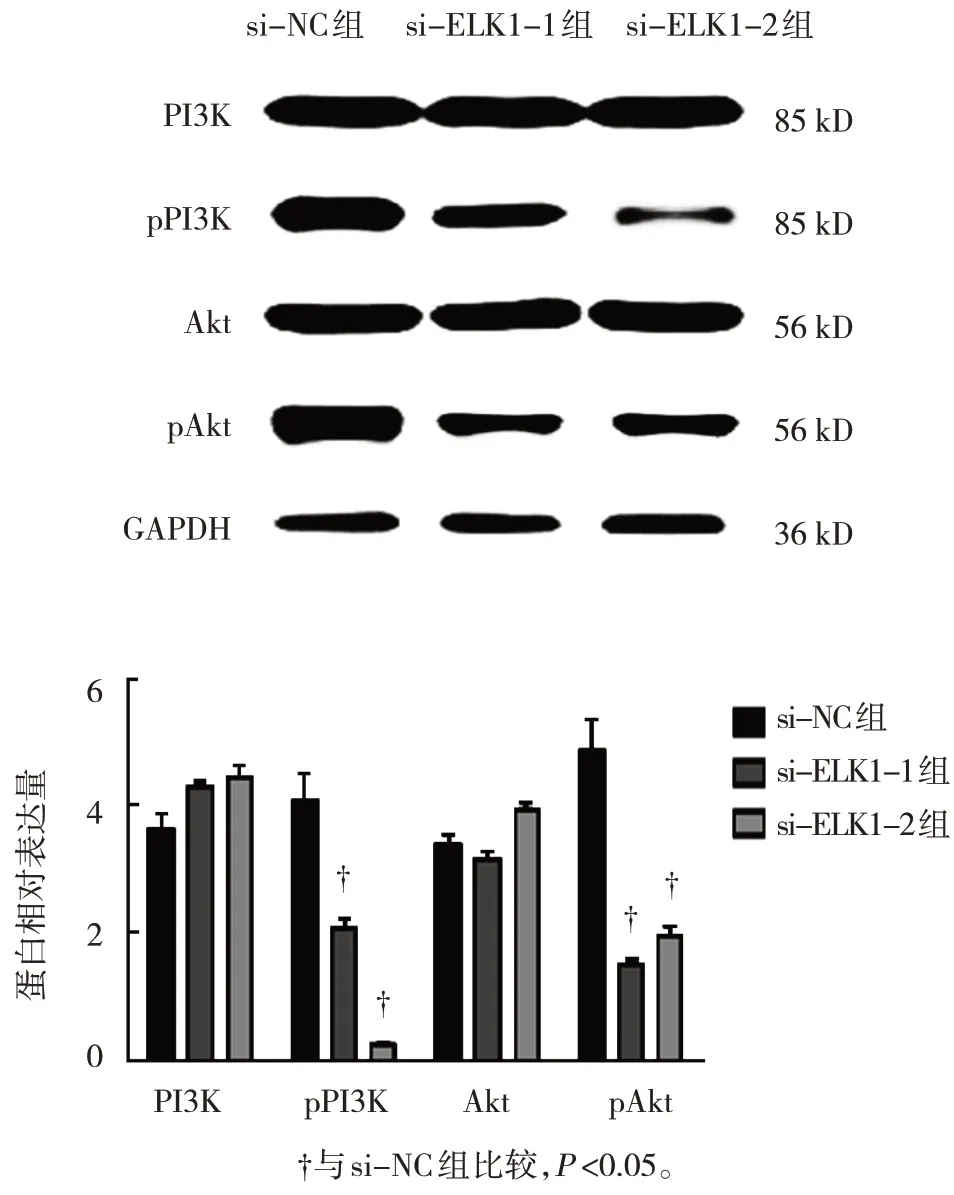
圖5 干擾ELK1對U2OS細胞PI3K/Akt信號通路的影響
表1 干擾ELK1對PI3K/Akt信號通路的影響(±s)
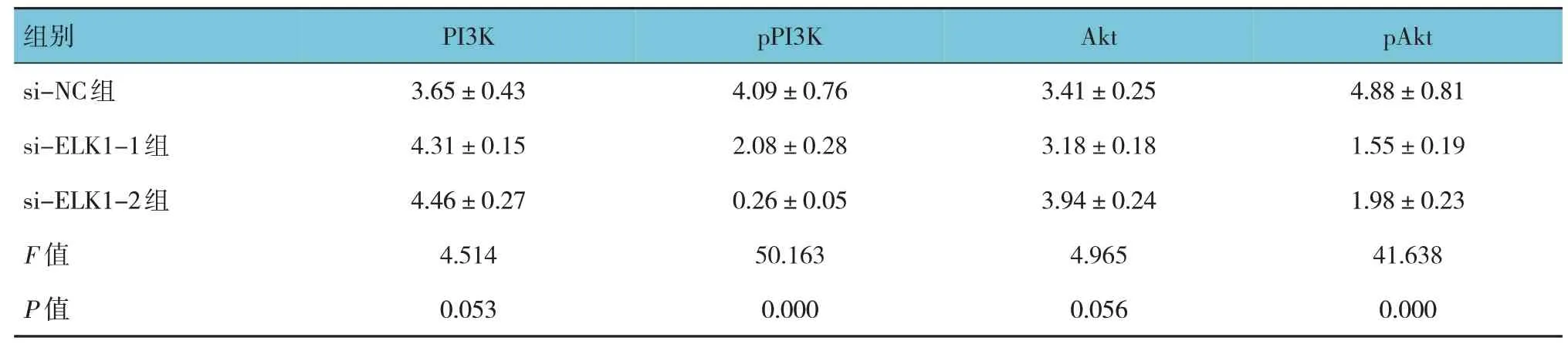
表1 干擾ELK1對PI3K/Akt信號通路的影響(±s)
組別si-NC組si-ELK1-1組si-ELK1-2組F值P值PI3K 3.65±0.43 4.31±0.15 4.46±0.27 4.514 0.053 pPI3K 4.09±0.76 2.08±0.28 0.26±0.05 50.163 0.000 Akt 3.41±0.25 3.18±0.18 3.94±0.24 4.965 0.056 pAkt 4.88±0.81 1.55±0.19 1.98±0.23 41.638 0.000
2.6 ELK1調控PI3K/Akt信號通路影響U2OS細胞增殖和克隆形成能力
采用PI3K/Akt信號通路激活劑SC79處理ELK1 siRNA轉染的細胞進行功能回復實驗的研究。MTS實驗結果顯示,si-NC組、si-ELK1組和si-ELK1+SC79組U2OS細胞增殖率分別為(100.00±0.00)%、(37.36±6.44)%、(56.14±7.19)%,3組比較,差異有統計學意義(F=99.820,P=0.000),與si-NC組比較,si-ELK1組和si-ELK1+SC79組U2OS細胞增殖率降低(P<0.05)。與si-ELK1組比較,si-ELK1+SC79組U2OS細胞增殖率增加(P<0.05),SC79減弱ELK1對細胞增殖率的抑制作用。
平板克隆實驗結果顯示,si-NC組、si-ELK1-1組和si-ELK1-2組U2OS細胞克隆形成數目分別為(109.67±18.66)個、(35.33±6.85)個、(72.67±5.22)個,3組比較,差異有統計學意義(F=29.44,P=0.001);與si-NC組比較,si-ELK1-1組和si-ELK1-2組U2OS細胞克隆形成數目減少(P<0.05)。與si-ELK1-1組比較,si-ELK1-2組U2OS細胞克隆形成數目增加(P<0.05),SC79減弱ELK1對細胞克隆形成能力的抑制作用。見圖6。
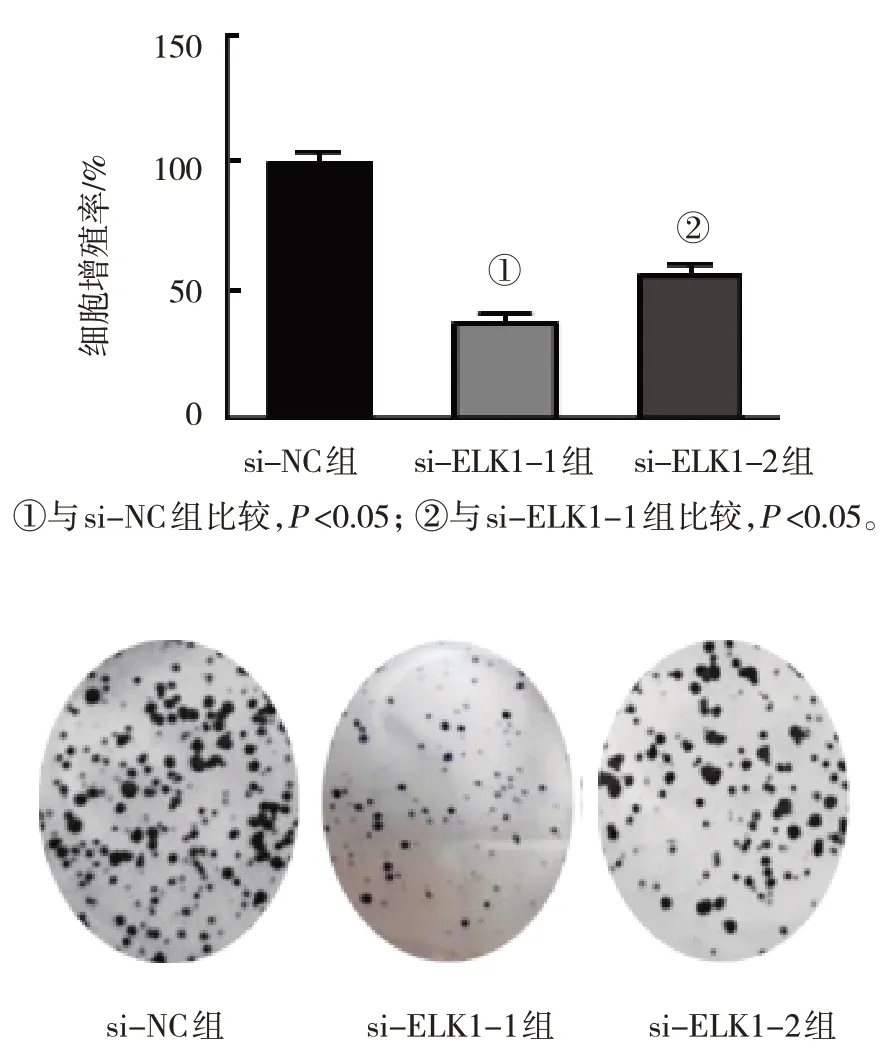
圖6 ELK1調控PI3K/Akt信號通路影響U2OS細胞增殖和克隆形成能力
3 討論
骨肉瘤的發病率為3/100萬,是骨組織中最常見的惡性腫瘤[1]。骨肉瘤最常見的發病部位是股骨遠端,其次是脛骨近端和肱骨長骨的干骺端。骨肉瘤通常發生在青少年中,0~24歲骨肉瘤患者的發病率為2.0%~7.6%,在所有兒童和青少年骨惡性腫瘤死亡者中,約有8.9%是由骨肉瘤引起的[10]。手術聯合放化療是骨肉瘤患者的主要治療方法,對早期患者療效較好,但是約有20%的骨肉瘤患者在初次檢查時就出現了肺部臨床轉移癥狀,長期生存率較差,骨肉瘤患者的5年生存率僅為60%左右[10]。骨肉瘤的復發和轉移導致病死率升高,研究報道局限性早期骨肉瘤患者5年生存率為80%,而晚期骨肉瘤患者的5年生存率僅為15%~30%[11]。因此研究骨肉瘤進展的分子機制對改善患者預后具有重要意義。骨肉瘤的發病機制是錯綜復雜的,主要由遺傳和環境因素組成[3]。針對腫瘤發生、發展中關鍵基因的治療是新近發現的抗腫瘤治療,即分子靶向治療,骨肉瘤的分子靶向治療仍處于研究階段,在分子水平研究骨肉瘤的惡性進展機制是尋找抗骨肉瘤治療的關鍵途徑[12]。
E26(E-twenty six,ETS)家族是較大的細胞內轉錄因子調控家族之一,該家族大多數的成員在生理和病理過程中具有重要的作用,包括胚胎發育、細胞分化、細胞增殖與凋亡、細胞與細胞間的相互作用等,在包括惡性腫瘤在內的人類疾病中發揮重要調控作用[13]。ETS家族重要調控轉錄因子之一的ELK1同樣在調控細胞增殖、分化及存活過程中發揮關鍵作用,研究報道[14]ELK1是新型的腫瘤促癌基因,在前列腺癌中ELK1表達與較高的臨床T期、病理T期,格里森評分、預后等級及陽性淋巴結狀態相關,并是前列腺癌疾病復發的獨立預后因子。在宮頸癌中ELK1誘導GPC3-AS1/GPC3軸促進宮頸癌細胞的增殖和遷移[15]。而SU等[6]研究報道長鏈非編碼RNA(lncRNA)MIR100HG在骨肉瘤組織和細胞系中高表達,其高表達是骨肉瘤患者預后不良因素,干擾MIR100HG的表達可抑制骨肉瘤細胞增殖和細胞周期的進程,并促進細胞凋亡,其作用機制是被轉錄因子ELK1上調。因此ELK1上調促進骨肉瘤的進程。而本文對ELK1在骨肉瘤中的直接生物學作用進行研究。首先Western blotting檢測發現,ELK1在骨肉瘤細胞系中的相對表達量高于其在正常成骨細胞中的相對表達量,并選擇ELK1相對表達最高的骨肉瘤細胞進行干擾,MTS和平板克隆實驗發現骨肉瘤細胞的增殖能力下降,表明ELK1在骨肉瘤細胞中高表達促進細胞的增殖。由于組織樣本的限制,本文未在骨肉瘤組織水平對ELK1的表達水平進行驗證,仍需在后續實驗中進行補充。
ELK1在骨肉瘤中發揮作用的分子機制需進一步研究。研究報道ELK1作為轉錄因子,通過激活有絲分裂原激活的蛋白激酶(MAPK)/細胞外信號調節激酶(ERK)途徑而被磷酸化并轉移到細胞核,從而導致包括原癌基因c-fos下游靶點的調控發揮生物學功能[16]。WANG等[17]發現在腎透明細胞癌中ELK1可以調節NDUFA4L2的表達,參與細胞生長和死亡過程,而NDUFA4L2可能與PI3K/Akt發揮相互作用。PI3K/Akt激活可促進腫瘤的惡性增殖,由于其密切參與多種腫瘤的各種惡性生物學行為[18-19],PI3K/Akt可作為抗腫瘤治療的分子靶點,PI3K/Akt信號通路抑制劑已經在抑制腫瘤的進展中取得了一定的療效[20]。研究報道在骨肉瘤中PI3K/Akt信號通路也處于異常激活狀態,PI3K/Akt信號通路關鍵蛋白PI3K和Akt發生磷酸化,促進或抑制其下游通路分子的表達,以促進腫瘤的發生、發展[21-22]。本文采用Western blotting檢測ELK1的表達對骨肉瘤細胞中PI3K/Akt信號通路的影響,結果發現干擾ELK1的表達后,骨肉瘤細胞中PI3K/Akt信號通路關鍵蛋白pPI3K和pAkt蛋白表達降低,表明ELK1可能通過調控PI3K/Akt促進骨肉瘤細胞增殖。并進一步采用PI3K/Akt信號通路激活劑SC79進行功能回復實驗,結果顯示SC79恢復si-ELK1組部分增殖能力,表明ELK1通過激活PI3K/Akt信號通路促進骨肉瘤細胞的增殖。
綜上所述,ELK1在骨肉瘤細胞中高表達,通過激活PI3K/Akt信號通路促進骨肉瘤細胞增殖的能力,ELK1可作為治療骨肉瘤的潛在靶點。

