氧化石墨烯對甲烷水合物生成影響的分子動力學模擬
王蕊蕊,楊保亞,周 航,趙偉龍,宋 軍,盛 偉
(河南理工大學 機械與動力工程學院,河南 焦作 454003)
甲烷水合物是甲烷(CH4)氣體和液態水在特定的環境下,通過足夠的壓力驅動力和較高的過冷度生成的外觀似冰包絡型化合物。其中水分子利用氫鍵彼此結合,組成不同的空腔結構,CH4分子被包裹在這些空腔之中,主體空腔與氣體分子之間受到范德華力的作用[1]。在標準狀況下,1 m3水合物可儲存160~180 m3CH4,儲氣密度極高,并且CH4在燃燒時熱值高,污染少,因此甲烷水合物可作為未來的新興能源之一。然而生成速率低、生成過程中誘導時間長和生成條件苛刻等問題,嚴重制約了甲烷水合物的工業化應用。
為了解決以上問題,已經有了相應的解決對策,如使用熱力學促進劑四氫呋喃(THF)[2]、四丁基氯化銨(TBAB)[3]和四丁基溴化銨(TBAC)[4]等,這些添加劑分子通過占據水合物中較大的空腔,或者與水分子結合成半籠的方式,使其相平衡曲線朝著壓力降低溫度升高的方向移動,導致水合物在較緩和的工況下就能生成。動力學促進劑十二烷基硫酸鈉(SDS)[5]和十二烷基苯磺酸鈉(SDBS)[6]通過減小氣液界面的表面張力,使更多的氣體分子進入液相,增大了傳質速率進而直接影響氣體消耗量、氣體吸收速率、誘導時間和水合物儲存容量,大大提高了水合物生成速度和動力學特性。雖然傳統的添加劑在促進水合物的生成方面已經取得了不錯的效果,但會對環境造成一定危害。近些年來,高效且對環境無污染的納米粒子已經成為水合物促進劑研究的新方向。氧化石墨烯(GO)作為一種新型的納米粒子,在極性溶液中分散效果良好,并且保留了原本石墨烯中的炭網結構,導熱效果優異[7],可以快速的轉移水合物生成過程中的熱量,巨大的比表面積也為水合物提供了更多的成核位點。LIU等[8]研究了在靜態條件下GO以及SDS和THF混合添加劑對二氧化碳水合物形成的影響。結果發現,加入一定量GO有效縮短了二氧化碳水合物形成誘導時間,相較于純水縮短了74%。同時,在含有SDS/THF/GO混合添加劑的體系中,水合物發生二次成核,很大程度上增強了水合物的儲氣能力,最高可達到152%。此外,GO也被廣泛用于CH4[9]、乙烯[10]和丙烷[11]水合物的生成中。
目前關于GO促進水合物的研究多局限于宏觀的實驗現象方面,對于從微觀尺度分析其對水合物生成的研究較少。分子動力學(MD)模擬是從微觀層面研究系統體系的一種方式,利用牛頓經典力學計算分子在不同時刻的相空間軌跡,模擬出系統隨時間演變的過程。實驗上達不到的條件可以通過模擬表示其物理現象和過程,并且可以從分子層面探究作用機理,已經有不少學者將MD模擬應用到水合物的研究中,LIAO等[12]模擬了蠟分子對甲烷水合物生長階段的作用,發現蠟分子的加入給水合物提供了更多的成核位點,從而促進其生成。劉庭崧等[13]利用MD模擬的方法研究了不同因素(溫度、壓力和電解質溶液)對甲烷水合物生長速率的影響,發現在一定壓力范圍內,提高壓力有助于水合物生長,而一定濃度的電解質溶液反而會抑制水合物生成。但是在已有水合物模擬的研究中,對添加劑分子的建模以及添加劑存在時整個模擬體系的搭建,尚存在不足。
本文采用MD模擬的方法,建立了在不同時期含有GO的模擬體系,從最終構象、均方位移和結合能的角度分析了GO對甲烷水合物的影響,為GO用做甲烷水合物生成的高效促進劑提供理論依據。
1 模型構建與參數設定
1.1 GO模型的構建
GO由氧化石墨剝離得到,主基面是單層的炭網結構,并負載了大量的環氧基團,在邊緣處又引入了羧基以及羥基。由于制備過程以及實驗條件等方面差異,迄今為止GO的精確結構還無法確定,根據Lerf-Klinowski結構(圖1(a))[14]與理論結構(圖1(b)),使用MS 8.0 軟件建立兩種GO的模型,聯合 Forcite模塊,采用最速下降法和共軛梯度法進行模型的結構優化。優化后的模型不再是平整的單層結構,模型表面發生波浪形的卷曲,如圖1(c)和圖1(d)所示。

圖1 GO結構和模型示意Fig. 1 Structures and models of GO
圖中黃色虛線代表GO所負載的羥基羧基等基團,這些含氧基團能夠與水分子結合形成O─H…O氫鍵,用于組成水合物籠,GO的加入能夠與自由水結合提供更多的氫鍵,加速水合物籠的形成,目前在實驗研究[8,15-16]中也已經證明GO能夠大大縮短水合物的生成時間。由圖1 可知,兩種模型都包含相同的結構,可根據所需構建模擬體系的大小,選擇合理的結構模型,便于簡化計算。此外,兩種GO模型都具有較大的比表面積,在實際實驗過程中能夠提供更多的成核位點[15],能夠促進水合物成核。
1.2 誘導生成時期模擬體系的構建
由于誘導生成時期的模型包含大量CH4和水分子,即構建的模擬體系尺寸較大,因此采用如圖1(c)所示的GO模型建立了誘導生成時期CH4-GO-H2O模擬體系,如圖2(a)所示。為了對照分析,另建立了未添加GO時的模型,如圖2(b)所示。

圖2 誘導生成時期添加GO和未添加GO的模擬體系Fig. 2 System models with GO and without GO in induction period
在模擬之前,需對整個體系進行優化,所采取的方法同上文1.1 節,最終得到體系最優的結構。整個模擬體系在COMPASS力場中進行計算,分子間的相互作用利用Lennard-Jones勢函數表示。體系內分子存在的靜電力采用Ewald求和法進行計算,Berendsen法控制體系壓力[17],Nose熱溶法控制體系溫度[18]。體系內所有分子間相互作用在1.5 nm的球形半徑截止處被截斷。完成以上工作后,為使整個體系達到平衡,選擇NVT系綜,在溫度為278 K條件下先進行100 ps的弛豫計算。設置合理的時間步長,另規定運行1000 步輸出1 次圖片。之后在NVT系綜下再進行600 ps的動力學計算,溫度依舊設置為278 K ,模擬結果用于統計和機理分析。
1.3 快速生成時期模擬體系的構建
GO對甲烷水合物快速生成過程的影響,可以通過構建水合物切面與GO結合的模型來表示。使用MS軟件中的Build模塊,對結構優化后的I型甲烷水合物模型進行切割處理,目的是通過暴露不同的切面,來反應甲烷水合物的快速生成過程。由于水合物切面尺寸較小,為使模型構建的更加合理也為了節約時間減少運算量,使用圖1(d)GO模型,借助Layer工具搭建模擬體系,如圖3 所示。切面1 表示甲烷水合物已經開始生長但結構尚未完整;切面2表示水合物生長進行了一段時間,結構相對完整;切面3 表示水合物開始大量生成進入循環生成階段。模擬步驟以及模擬參數的選擇同上文1.1 節和1.2 節。

圖3 甲烷水合物快速生長時期模擬體系Fig. 3 Simulation system of methane hydrate rapid growth period
2 結果與討論
2.1 平衡態的判定
為減少計算誤差,通常在正式MD模擬之前,要對弛豫后的模型進行平衡狀態的判定,包括能量平衡和溫度平衡。誘導生成時期弛豫過程中模擬體系的能量和溫度隨時間變化的曲線如圖4 和圖5所示。在初始階段,整個體系的動能、勢能、非鍵能以及總能量波動較大,模擬過程運行14 ps左右,所有能量曲線在某一固定值附近上下變化且變化較小,此時體系的能量已經達到平衡。體系的溫度變化和能量變化趨勢相似,并且最終的溫度變化偏差低于10 K,表明體系已處于平衡狀態。
圖4 弛豫過程能量變化曲線Fig. 4 Energy curve of relaxation process

圖5 弛豫過程溫度變化曲線Fig. 5 Temperature curve of relaxation process
2.2 誘導生成時期構象及均方位移分析
水合物的形成包括氣體溶解、誘導生成和快速生成階段,目前本文模擬方法不能表示氣體溶解的過程,主要通過添加劑對誘導生成時期和快速生成時期晶體構象的影響來分析GO對水合物生成的促進作用。誘導生成時期模擬體系的最終構象如圖6所示,當模擬計算50 ps左右,氣體分子朝著溶液層的方向擴散劇烈程度開始增大,直至計算結束大量的CH4分子進入到溶液中;另外通過對比發現水分子與GO表面基團結合,形成較強的氫鍵鍵能導致GO分子發生了一定程度的變形。

圖6 誘導生成時期模擬體系最終構象Fig. 6 Final conformations of simulated system in induction period
同時,氫鍵會對溶液層的水分子產生“約束力”,影響水分子的擴散能力,使大量的自由水轉化為結合水,然而從圖6(a)并不能直觀的看出這一過程。在動力學計算中可以通過分析均方位移(MSD,m2)[19]來表示水分子擴散的劇烈程度,其定義式如式(1)所示。

式中,Ri(0)和Ri(t)為分子i在初始時刻和不同時刻的位置;N為系統分子總數。
誘導生成時期甲烷水合物模擬體系的水分子MSD如圖7 所示。
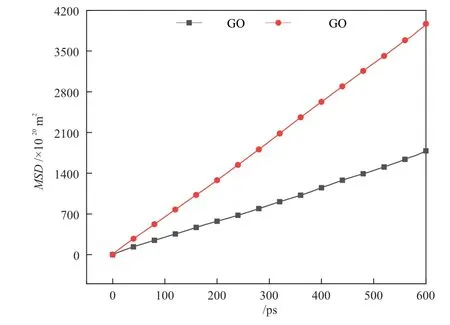
圖7 不同甲烷水合物體系水分子的MSDFig. 7 MSD of water molecules in different methane hydrate systems
由圖7 可知,相同模擬時長和工況條件下,未添加GO的模擬體系,水分子的MSD更大,約為添加GO時體系的2 倍,表明此時體系中自由水的含量較多,水分子運動也更加劇烈。由于水合物籠是依靠水分子之間氫鍵的彼此約束形成的,當水分子運動越劇烈,水合物籠越不易形成,進而影響整個水合物的生成速率,而GO通過表面基團與水分子結合成鍵的方式,在一定程度上約束了水分子運動,同時結合而成的大量氫鍵也更加有利于水合物籠的形成,可大大提高生成速率。
2.3 快速生成時期構象及結合能分析
快速生成時期模擬體系的最終構象如圖8 所示。
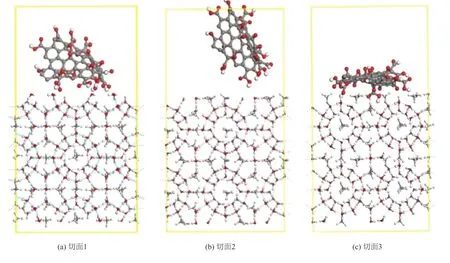
圖8 快速生成時期甲烷水合物不同切面模擬體系的最終模擬構象Fig. 8 Final conformations of methane hydrate in different sections during rapid growth
由圖8 可知,3 個不同水合物切面下GO都發生了一定程度的變形,由于切面1 暴露了半籠型的結構,在氫鍵的吸引下,使得GO表面的邊緣基團逐漸向表面貼近。而切面2 表示的是水合物快速生成時期已經進行了一段時間,結構相對完整,導致GO變形程度較小。對于切面3 來說,已經經歷一個完整的水合物生成過程,并且即將進入循環生成階段,此過程需要再次進行成核成籠。此時GO分子發生較大的形變,原因是GO能夠為氣體分子提供大量的成核位點,甲烷水合物傾向于在GO表面成核,此外水分子和含氧基團互相吸引形成氫鍵使得GO更加貼近于水合物切面。
從圖8 所示的甲烷水合物晶體構象不能看出加入GO之后不同切面結合模型的結合能大小,需要通過進一步的計算來確定,其詳細計算公式如式(2)和式(3)所示。

式中,Einteraction為相互作用能,kJ/mol;Etotal為模型總能量,kJ/mol;Ehdyrate為水合物切面的能量,kJ/mol;EGO為GO的能量,kJ/mol;Ebinding為結合能,kJ/mol。
不同甲烷水合物晶體切面模擬體系的相互作用能示意如圖9 所示,作為對比,分析了未添加GO時不同切面的能量。

圖9 不同甲烷水合物晶體切面模擬體系的相互作用能Fig. 9 Interaction energy of different methane hydrate crystal sections simulation systems
由圖9 可知,添加GO大幅提升了不同甲烷水合物切面的相互作用能,意味著GO的加入增強了水合物之間所受力的作用,影響了水合物的結構進而影響了水合物生成速率。由于結合能和相互做用能互為相反數,從圖中數據可以得出,不同切面模擬體系的結合能均為正值,說明GO和不同切面之間是引力作用,有利于GO參雜到水合物的結構中,進而導致甲烷水合物在GO表面進行異相成核,降低了在溶液中進行均相成核的能壘,加快了生長速率。
3 結論
本文利用MD模擬方法,模擬了GO對甲烷水合物誘導生成時期以及快速生成時期的影響,得到以下結論。
(1)GO表面以及邊緣負載的含氧基團與水分子結合形成氫鍵,有利于水合物籠的形成,提高了生成效率。
(2)結合誘導生成時期模擬體系的最終構象以及水分子MSD的變化,發現當加入GO之后會束縛水分子的運動,此時大量的自由水轉化為結合水,更易形成水合物的籠型結構。
(3)GO對甲烷水合物快速生成時期也有一定的促進作用,添加GO增強了與水合物切面之間所受力的作用,并且二者之間的引力,利于甲烷水合物在GO表面進行異相成核,達到快速生成的目的。

