miR-363在脆性骨折患者血中的表達及對MC3T3-E1細胞成骨分化及增殖的影響
張愛新, 張 卓, 張 杰
(北京市平谷區醫院急診科,北京市101200)
脆性骨折又稱骨質疏松性骨折,是指輕微外傷所導致的非暴力性骨折[1]。盡管目前有許多方法可以改善脆性骨折的治療,并加快骨折愈合過程,但治療前景仍不能十分滿意[2]。微小RNA(microRNA,miRNA)是一類小的非編碼RNA,通過與信使RNA(messenger RNA,mRNA)的3′-非翻譯區(3′-untranslated region,3′-UTR)特異性結合而調節目的基因表達[3-4]。研究發現,骨折愈合過程中一些miRNAs通過調節軟骨細胞、成骨細胞和破骨細胞分化,在骨形成、吸收、重塑和修復中起重要的調節作用[5]。miR-363可通過減少多發性骨髓瘤患者骨溶解而抑制腫瘤進展[6],而其在成骨分化中的研究尚未見相關報道。本實驗旨在研究miR-363在脆性骨折患者血中的表達及對小鼠胚胎成骨細胞前體細胞(mouse embryonic osteoblast precursor cells,MC3T3-E1)成骨分化及增殖的影響,并探討其對Dickkopf相關蛋白1(Dickkopf-1,DKK1)與Wnt/β-catenin信號通路的調節作用。
1 資料和方法
1.1 儀器和試劑
普通PCR儀購自美國BIO-RAD公司;LightCycler480熒光定量PCR儀購自瑞士Roche公司。Trizol試劑、反轉錄與熒光定量PCR試劑均購自日本Takara公司;RIPA裂解液與Lipofectamine 2000轉染試劑購自美國Life technology公司;雙熒光素酶報告基因試劑購自美國Promega公司;模擬物及陰性對照購自蘇州GenePharma公司;杜爾貝科改良伊格爾培養基(dulbecco's modified eagle medium,DMEM)、胎牛血清與Opti-MEM均購自美國Gibco公司;兔抗人DKK1與甘油醛-3-磷酸脫氫酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗體購自美國Abcam公司;噻唑藍(MTT)與二甲亞砜購自美國Sigma-Aldrich公司;MC3T3-E1細胞購自中科院上海細胞庫。
1.2 外周血標本收集
收集2015年1月—2018年12月本院急診科就診的34例脆性骨折患者外周血標本各5 mL,其中男20例,女14例,年齡32~74歲,平均(58.22±7.09)歲;收集11例本院體檢的正常健康者外周血標本各5 mL,其中男6例,女5例,年齡40~76歲,平均(56.67±5.84)歲;同時收集上述患者術后1周、2周及4周外周血標本各5 mL。采集后的新鮮外周血標本立即放入抗凝管中,并置于-80 ℃冰箱中冷凍保存以備后續實驗使用。納入標準:臨床表現為脆性骨折患者,影像學診斷明確。排除嚴重肝腎功能障礙、凝血功能障礙、關節炎、全身免疫系統疾病。本實驗經過本院醫學倫理委員會批準,并獲得全部參與者的知情同意。
1.3 熒光定量PCR檢測基因表達
按照Trizol試劑常規提取標本中總RNA,參照試劑盒說明書以RNA為模版進行反轉錄合成cDNA,以cDNA為模版進行熒光定量PCR反應。反應體系如下:模版cDNA 1 μL,上下游引物各0.5 μL,2×SYBR Green PCR Master Mix 10 μL,去離子水8 μL。反應條件為:95 ℃ 10 min,隨后98 ℃ 10 s,59 ℃ 30 s,72 ℃ 30 s,共40個循環。U6與GAPDH為內參基因,人miR-363、DKK1、矮小相關轉錄因子2(runt-related transcription factor 2,RUNX2)、骨鈣素(osteocalcin,OCN)、細胞周期蛋白D1(cyclin D1,CCND1)、連環蛋白β1(catenin beta 1,CTNNB1)和骨髓細胞瘤癌基因(myelocytomatosis oncogene,MYC)引物序列見表1。每組設計3個復孔,獨立重復3次,并通過2-ΔΔCt法分析各基因的表達水平。

表1 引物序列
1.4 細胞培養及轉染
MC3T3-E1細胞復蘇后,采用DMEM培養基與10%胎牛血清在37 ℃、含5%CO2細胞培養箱中進行培養。取對數期生長的細胞進行細胞鋪板,當細胞融合度達90%左右時,按照Lipofectamine 2000轉染試劑說明書進行細胞轉染,分別轉染模擬物與陰性對照,6 h后采用熒光顯微鏡觀察轉染情況。
1.5 MC3T3-E1細胞誘導成骨分化實驗
將轉染后的細胞使用6孔板進行細胞鋪板,每孔細胞數約為6×106個,當細胞融合度達到80%左右時,使用添加10 mmol/L β-甘油磷酸和50 mg/L抗壞血酸的DMEM培養基與10%胎牛血清開始誘導分化,分化培養基每3天更新一次,持續分化處理28天。
1.6 茜素紅S染色實驗檢測MC3T3-E1細胞成骨分化
收集約1×106個誘導成骨分化28天MC3T3-E1細胞,用PBS緩沖液洗滌細胞3次,每次5 min。將細胞用冷卻的0.05%戊二醛固定10 min,并用PBS緩沖液洗滌細胞3次,每次5 min。37 ℃下用40 mmol/L茜素紅S染色5 min。將細胞用蒸餾水洗滌3次,每次5 min,然后用PBS緩沖液沖洗10 min。采用倒置顯微鏡下觀察細胞顯色情況。
1.7 MTT實驗檢測MC3T3-E1細胞增殖
將轉染后的細胞使用96孔板進行細胞鋪板,每孔細胞數約為4×103個,每孔每天加入16 μL MTT(5 g/L)并室溫孵育4 h后去上清,連續3天,之后加入130 μL二甲亞砜孵育15 min溶解結晶。測定各孔450 nm波長時的光密度(optical density,OD),并繪制細胞增殖曲線。
1.8 雙熒光素酶報告基因實驗
通過microRNA.org生物信息學數據庫預測miR-363靶基因。以psiCHECK2為基礎載體,構建psiCHECK2-DKK1-wt野生型報告載體與psiCHECK2-DKK1-mut突變型報告載體。將轉染后的細胞使用24孔板進行鋪板,每孔細胞數約為8×104個,并轉染野生型或突變型報告載體。24 h后按照雙熒光素酶報告基因試劑說明書檢測各孔海腎和螢火蟲基因的熒光素酶強度。
1.9 Western blotting實驗檢測DKK1蛋白表達
收集約1×106個MC3T3-E1細胞,采用RIPA裂解液提取總蛋白,常規定量和變性。制備12%十二烷基硫酸鈉聚丙烯酰胺凝膠,上樣、電泳、轉膜及封閉,加入抗DKK1與GAPDH抗體4 ℃孵育過夜,TBS-T緩沖液洗滌3次,每次5 min。37 ℃孵育相應二抗1 h,TBS-T緩沖液洗滌3次,每次5 min。暗室添加超敏化學發光液孵育20 s并曝光拍照。
1.10 統計學處理
2 結 果
2.1 miR-363在外周血中的表達情況
熒光定量PCR結果顯示,miR-363在脆性骨折患者外周血中的表達水平低于正常健康者外周血(P<0.05);脆性骨折患者術后1周、2周及4周外周血中miR-363的表達水平均高于術前,且呈上調趨勢,以4周的表達水平為最高(均P<0.05;表2)。

表2 miR-363 在正常健康者與脆性骨折患者外周血中的表達水平
2.2 MC3T3-E1細胞中過表達miR-363
模擬物組與陰性對照組MC3T3-E1細胞中可見大量紅色熒光,而空白組中無紅色熒光,提示細胞轉染效率良好。熒光定量PCR實驗分析可見模擬物組MC3T3-E1細胞中miR-363表達水平(142.93±14.66)高于陰性對照(1.09±0.09)與空白組(1.00±0.13)(均P<0.05),而陰性對照與空白組中miR-363表達水平差異無顯著性(P>0.05;圖1)。
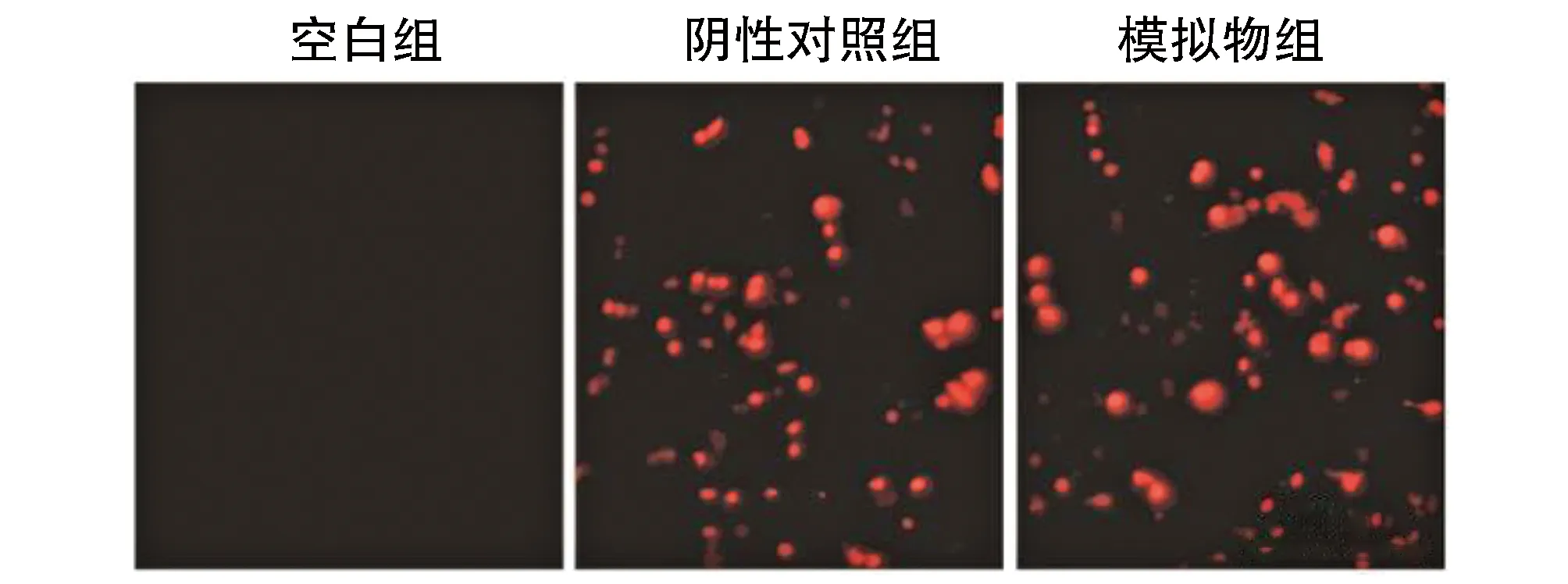
圖1 MC3T3-E1細胞中過表達miR-363
2.3 過表達miR-363促進MC3T3-E1細胞成骨分化與增殖
茜素紅S染色實驗顯示,模擬物組MC3T3-E1細胞礦化程度高于陰性對照組(P<0.05)。熒光定量PCR實驗顯示,模擬物組MC3T3-E1細胞中RUNX2及OCN mRNA表達水平均高于陰性對照組(均P<0.05)。MTT實驗顯示,在細胞培養后1天、2天、3天,模擬物組MC3T3-E1細胞增殖均高于陰性對照組(均P<0.05;圖2)。
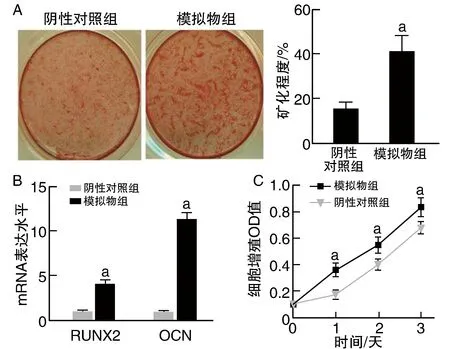
圖2 過表達miR-363促進MC3T3-E1細胞成骨分化與增殖
2.4 過表達miR-363抑制靶基因DKK1表達
生物信息學顯示,DKK1 mRNA 3′-UTR與miR-363存在互補結合位點。雙熒光素酶報告基因實驗顯示,模擬物抑制野生型報告載體熒光素酶強度(P<0.05),而對突變型報告載體沒有影響(P>0.05)。Western blotting實驗顯示,模擬物組MC3T3-E1細胞中DKK1蛋白表達水平低于陰性對照組(P<0.05;圖3)。
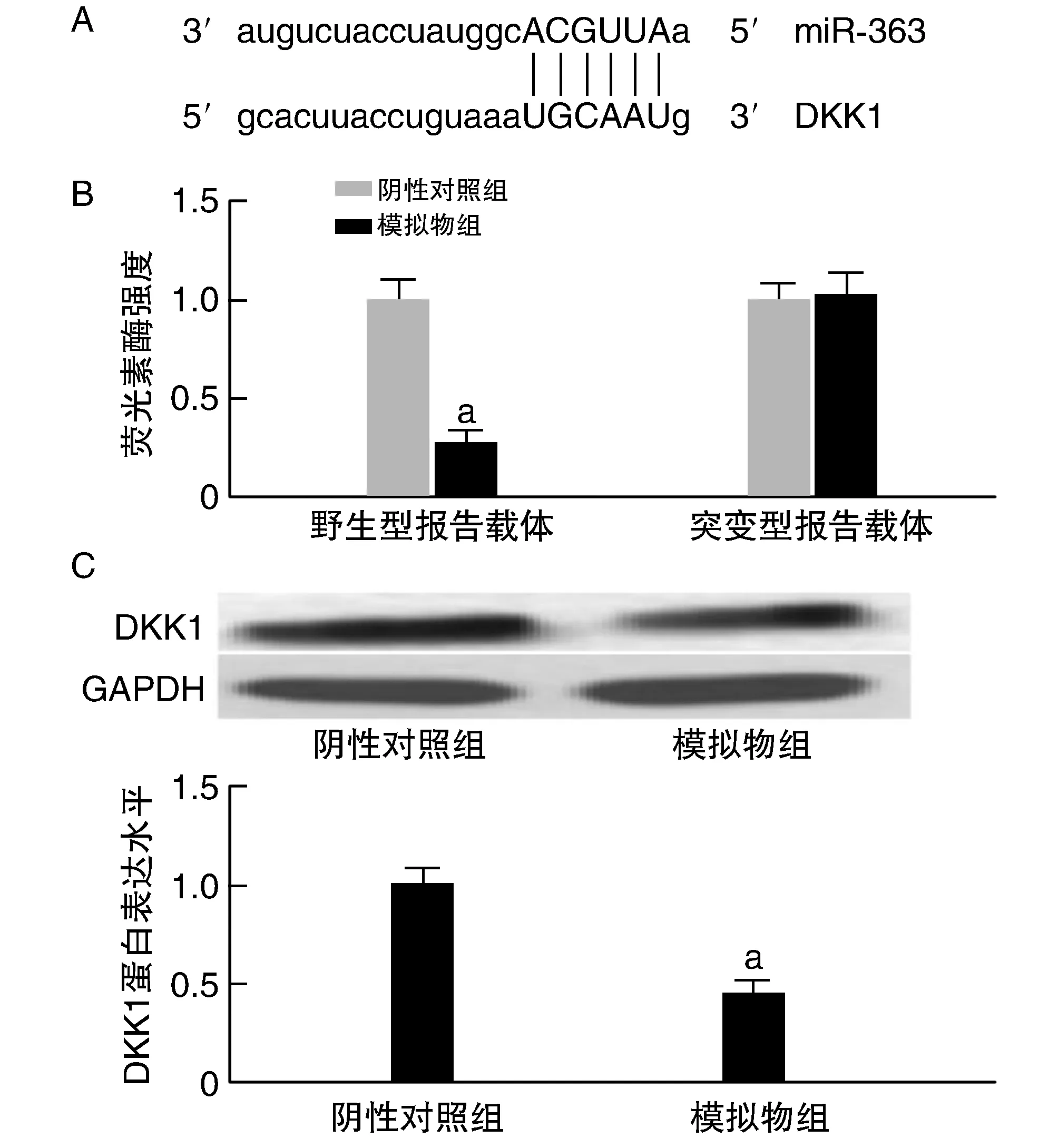
圖3 過表達miR-363下調靶基因DKK1表達
2.5 過表達miR-363促進Wnt/β-catenin信號通路相關基因表達
熒光定量PCR實驗顯示,模擬物組MC3T3-E1細胞中CCND1、CTNNB1及MYC mRNA表達水平均高于陰性對照組(均P<0.05;表3)。
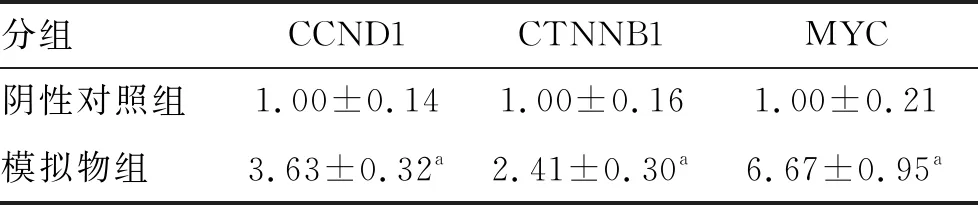
表3 陰性對照組與模擬物組CCND1、CTNNB1及MYC mRNA表達水平
3 討 論
研究表明,miRNAs在成骨分化中發揮重要的調節作用[7]。Chen等[8]發現miR-7-5p調控趨化因子樣受體1表達促進人間充質干細胞成骨分化。Liu等[9]發現miR-155通過下調骨形態發生蛋白9表達誘導小鼠胚胎成纖維細胞成骨分化。Yan等[10]報道miR-22通過抑制組蛋白脫乙酰基酶6表達促進人牙周膜干細胞的成骨分化。此外,Ren等[11]報道miR-23a-5p通過靶向有絲分裂原激活的蛋白激酶13表達抑制人骨髓間充質干細胞的成骨分化。miR-363位于人基因組Xq26.2區域,在胃癌、乳頭狀甲狀腺癌、肝細胞癌和肺腺癌等多種腫瘤中起抑癌作用[12]。本文結果顯示過表達miR-363促進MC3T3-E1細胞成骨分化及增殖,初步揭示了miR-363在骨折愈合中的作用。
DKK1是一種分泌型糖蛋白,通過特異性阻斷成骨細胞中的Wnt/β-catenin信號通路傳導,從而抑制成骨細胞的發育和活性[13]。研究發現,提高DKK1水平與活性可能導致成骨細胞活性受損和骨質流失[14]。此外,全基因組表達分析已將DKK1確定為一種與婦女絕經后骨礦物質密度變化相關的基因,與骨礦物質密度呈負相關[15]。本研究采用生物信息學分析miR-36的靶基因,發現DKK1是miR-363的靶基因,miR-363可與DKK1 mRNA 3′-UTR結合而抑制其蛋白表達。該結果初步表明,miR-363可能通過抑制靶基因DKK1表達促進MC3T3-E1細胞成骨分化及增殖。
Wnt/β-catenin信號通路是由配體無翅型MMTV整合位點家族蛋白和膜蛋白受體結合激發的一組多種下游通道的信號轉導途徑,在胚胎發育、組織器官形成以及腫瘤發生中起重要作用[16]。在胚胎骨骼形成過程中,抑制Wnt/β-catenin信號通路可阻止成骨細胞分化,從而誘導多能間充質細胞分化成軟骨細胞[17]。此外,在動物和人類的骨折愈合中,Wnt/β-catenin信號通路的許多下游基因均被激活,包括CCND1、CTNNB1及MYC等[18]。本文結果顯示過表達miR-363增加MC3T3-E1細胞中CCND1、CTNNB1及MYC的表達水平,初步表明miR-363可能通過激活Wnt/β-catenin信號通路促進MC3T3-E1細胞成骨分化及增殖。
綜上所述,miR-363促進MC3T3-E1細胞成骨分化與增殖,該機制可能與調控靶基因DKK1與Wnt/β-catenin信號通路相關。miR-363有希望作為治療骨折愈合的新靶點。

