小膠質細胞組蛋白去乙酰化酶3在低壓低氧誘導的氧化應激中的作用
李 珺 李碩碩 彭志鑫 廖亞金 程金波* 袁增強*
(1.首都醫科大學腦重大疾病研究院,北京 100069;2.軍事醫學研究院軍事認知與腦科學研究所,北京 100850;3.南華大學衡陽醫學院,湖南衡陽 421001;4.中央民族大學生命與環境科學學院轉化神經科學中心,北京 100081)
我國幅員遼闊,高原地區國土面積位居世界第一。在醫學上,高原是指能引起機體生物學效應的海拔高達2 500米以上的廣泛地區[1]。高原地區溫度低,溫差大,濕度低,陽光輻射強烈,而低壓低氧是最為顯著的特點[2]。宏觀上,中樞神經系統器官——腦,對于低氧十分敏感,氣壓降低導致供氧穩態的失衡,引起腦血管重構導致血管源性腦水腫[3]及機體認知障礙[4-5]。微觀上,細胞缺氧導致線粒體功能異常,產生大量活性氧(reactive oxygen species,ROS)引發氧化應激反應[6-7]。在氧化應激狀態下ROS的升高可以激活下游信號通路,導致小膠質細胞激活,小膠質細胞分泌的促炎因子,進一步加劇了神經炎性反應[8]。近年來有研究[9]顯示,組蛋白去乙酰化酶(histone deacetylases 3,HDAC3)在巨噬細胞中,通過非乙酰化作用引起急、慢性炎癥,巨噬細胞中HDAC3的缺失,可以減少線粒體膜的破壞,使ROS的產生減少。本課題組前期研究工作顯示,急性缺血缺氧導致小膠質細胞活化,神經炎癥水平升高。敲除小膠質細胞HDAC3可以緩解缺血缺氧導致的腦損傷和神經炎癥[10]。目前,高原低壓低氧環境導致腦損傷產生的分子機制還不清楚。本研究利用高原低氧倉與低氧細胞培養箱模擬高原環境處理小鼠和小膠質細胞,利用蛋白質免疫印跡和實時定量聚合酶鏈反應(real-time polymerase chain reaction,real-time PCR)等技術,探究高原缺氧是否會導致神經炎癥,以及HDAC3是否在這一過程中發揮作用,為高原性腦病的防治提供理論依據。
1 材料與方法
1.1 實驗動物和細胞
SPF級C57BL/6J小鼠(購于斯貝福生物技術有限公司);實驗室飼育的HDAC3flox/flox和HDAC3flox/flox;CX3CR1CreER小鼠[實驗動物使用許可證號:syxk(軍)2019-0004][10]。袁增強課題組實驗室凍存的BV2細胞系和穩定敲低HDAC3的BV2細胞系。
將HDAC3flox/flox小鼠與CX3CR1CreER小鼠雜交,使其產生后代HDAC3flox/flox; CX3CR1CreER小鼠(cKO小鼠),利用他莫昔芬(tamoxifen)灌胃誘導小膠質細胞特異性敲除HDAC3。
1.2 主要試劑和儀器
ROS檢測試劑盒(碧云天生物技術有限公司,貨號:S0033S),DMEM培養基(美國Gibco公司,貨號:C11885500BT),RNA反轉錄試劑盒(全式金生物技術公司,貨號:O10306),誘導型一氧化氮合酶(inducible nitric oxide synthase,iNOS)抗體(美國BD Biosciences公司,貨號:610332,1∶1 000配制),缺氧誘導因子-1α(hypoxia inducible factors-1α, HIF-1α)抗體(英國Abcam公司,貨號:ab179483,1∶1 000配制),超氧化物歧化酶(superoxidase dismutase,SOD)抗體(碧云天生物技術有限公司,貨號:S0088,1∶1 000配制),HDAC3抗體(美國Cell Signaling Technology公司,貨號:85057S,1∶1 000配制),HDAC3抑制劑RGFP966(美國Selleck Chemicals公司,貨號:S7229)。
1.3 高原缺氧小鼠模型建立
將14只2月齡健康C57BL/6J雄鼠使用簡單隨機分組法分成2組,常壓常氧組(常氧組)、低壓低氧組(低氧組)各7只。常氧組在正常氧環境下喂養,低氧組置于模擬 6 000米海拔環境的低壓氧艙,每3天降艙后,加食、喂水。將14只2月齡HDAC3flox/flox雄性小鼠使用簡單隨機分組法分成常氧組、低氧組各7只,常氧組在正常氧環境下喂養,低氧組置于模擬 6 000米海拔環境的低壓氧艙,每3天降艙后,加食、喂水。連續飼養7 d后斷頸處死小鼠,取小鼠腦組織進行相關檢測。
1.4 缺氧細胞模型建立
BV2細胞以及穩定敲低HDAC3的BV2細胞分別分為5組,以60%的密度鋪于12孔的細胞培養板,12 h更換培養基后,一組常氧培養(常氧組),另四組(低氧組)放入低氧培養箱,通入0.1%(體積分數)氧氣,5%(體積分數)二氧化碳,分別低氧處理2、4、6、8 h,然后收集樣品進行相關檢測。
1.5 RGFP966處理細胞
將RGFP966粉末溶于二甲基亞砜(DMSO)中,制成6 mmol/L母液,處理細胞終濃度為6 μmol/L。加入RGFP966后進行低氧處理2、4、6、8 h,然后收集細胞進行檢測。
1.6 ROS檢測
按照1∶1 000比例用無血清培養液稀釋DCFH-DA母液至終濃度為10 μmol/L,準備ROS染色試劑。然后將培養的細胞中培養液棄去,加入適當體積稀釋好的DCFH-DA進行染色。于37 ℃細胞培養箱內孵育20 min后,用無血清細胞培養液洗滌多余染料,之后收集細胞用流式細胞儀檢測熒光值,使用488 nm激發波長,525 nm發射波長,實時檢測刺激前后熒光的強弱。
1.7 mRNA的檢測
加入500 μL/孔Trizol 提取細胞總RNA和腦海馬組織總RNA,用微量紫外分光光度計檢測RNA的濃度及純度。然后取1 μg總RNA用 RNA反轉錄試劑盒按照說明書方法反轉錄成cDNA。最后用real-time PCR法檢測HIF-1α、HDAC1/2/3、iNOS、CD206、腫瘤壞死因子-α(tumor necrosis factor-α, TNF-α)、SOD的mRNA水平。所用PCR引物如表1所示。

表1 PCR引物
1.8 Western blotting法測定組織和細胞相關蛋白表達
Western blotting法測定各組HIF-1α、HDAC3、iNOS、SOD蛋白表達,β-actin 作為內參標記蛋白。SDS-PAGE 電泳分離蛋白,對應一抗標記,辣根過氧化物酶標記二抗結合后ECL顯色液顯影,X線曝光,掃描各條帶灰度值,Image J分析條帶灰度值。
1.9 統計學方法
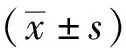
2 結果
2.1 低壓低氧暴露對小鼠腦內氧化應激相關因子的影響
通過real-time PCR檢測低氧組小鼠和常氧組小鼠海馬區的iNOS、SOD、HIF-1α的mRNA水平。結果顯示,兩組間低氧相關因子HIF-1α及炎癥因子CD206、ARG1水平差異無統計學意義(P>0.05)。但低氧組iNOS和SOD的濃度明顯高于對照組,差異有統計學意義(P<0.05)。此外,低氧組HDAC3濃度高于對照組,差異有統計學意義(P<0.05),而HDAC1以及HDAC2組間差異無統計學意義(P>0.05)。詳見圖1。

圖1 低壓低氧暴露后小鼠腦部海馬區相關因子mRNA表達水平檢測
2.2 低氧處理對BV2小膠質氧化應激相關因子的影響
利用低氧細胞培養箱模擬高原低氧環境對BV2細胞進行低氧處理[1%(體積分數)O2]2、4、6、8 h后,通過real-time PCR檢測HIF-1α、iNOS、HDAC3、SOD的mRNA水平。結果顯示,低氧處理組和常氧組低氧相關因子HIF-1α水平差異無統計學意義(P>0.05)。但低氧處理組iNOS、SOD和HDAC3的水平明顯高于對照組,差異有統計學意義(P<0.05)。蛋白質免疫印跡檢測以及灰度統計結果顯示低氧處理組HIF-1α、iNOS和HDAC3的蛋白表達量明顯高于常氧組。通過流式細胞儀檢測ROS探針熒光強度,結果顯示低氧組ROS的濃度明顯高于常氧組,差異有統計學意義(P<0.05)。詳見圖2。

圖2 低氧處理增加小膠質細胞的氧化應激水平
2.3 抑制HDAC3減輕低氧導致的氧化應激水平
RGFP966處理顯著抑制了低氧導致的iNOS、SOD的mRNA表達水平的升高,差異有統計學意義(P<0.05)。蛋白質免疫印跡結果顯示RGFP966處理顯著抑制了低氧導致的iNOS蛋白表達水平的升高。從mRNA和蛋白水平確定HDAC3穩定敲低細胞株具有較好的敲低效果。低氧處理后,結果顯示低氧處理4 h,HIF-1α的mRNA水平沒有顯著改變,但敲低HDAC3的細胞中HIF-1α蛋白水平較未敲低組增加,差異有統計學意義。并且敲低HDAC3顯著降低了低氧暴露后iNOS和SOD的mRNA升高和iNOS蛋白增加。與此一致,敲低HDAC3顯著降低了低氧誘導的ROS升高。詳見圖3。
2.4 特異性敲除小膠質細胞HDAC3可減輕低壓低氧導致的氧化應激反應
首先檢測HDAC3的敲除效率,通過分選腦內小膠質細胞進行Western boltting檢測,發現HDAC3的表達水平在HDAC3flox/flox;CX3CR1CreER小鼠中顯著下降(圖4A)。隨后,將cKO小鼠與野生型小鼠置于低壓低氧艙中,模擬6 000米海拔高度連續處理7 d(圖4B)。結果顯示,低壓低氧暴露后iNOS和SOD的mRNA水平在cKO小鼠中顯著下調,差異有統計學意義(P<0.05)(圖4C、4D)。

圖4 特異性敲除小膠質細胞HDAC3可減輕低壓低氧所引起的氧化應激反應
3 討論
研究[4]表明,根據暴露時間的長短,高原低氧環境會對機體造成可逆或不可逆的影響。但是高原病的病理生理過程尚未明確,也未發現一些高原病的特異性生物學標志物。本研究以BV2小膠質細胞和HDAC3條件性敲除小鼠為研究對象,探究低壓低氧對腦內氧化應激的影響及小膠質細胞HDAC3在其中的作用。
機體的各項生命活動離不開氧氣,機體的組織、細胞以各種方式感受外界氧氣濃度的變化,外界氧濃度的改變分為兩種,一種是局部改變例如腫瘤或局部損傷[11-12],另一種是全身性改變,例如當機體處于高原低壓低氧環境[13]。常氧狀態下HIFs上的α亞基的脯氨酸殘基被脯氨酰羥化酶羥化而快速降解。缺氧條件下,脯氨酰羥化酶會被抑制,HIFs蛋白表達顯著增多[14-16]。有研究[14]顯示暴露在嚴重缺氧環境下的大鼠腦內HIF-1α的表達高于常氧組的大鼠,缺氧又可以引起氧化應激反應,但進行缺氧預適應后不引起氧化應激反應,因此缺氧誘導的HIF-1α的表達獨立于腦內氧化應激狀態的存在。在本實驗中,對缺氧細胞模型的檢測發現HIFs蛋白表達量顯著增多,因此將低氧處理后細胞HIF-1α蛋白表達量升高作為細胞低氧模型構建成功的標志。氧化應激在神經系統損傷中扮演著十分重要的角色,研究[17]表明在各種神經系統退行性疾病中,神經系統的細胞中自由基代謝平衡嚴重失調,對于自由基的防御能力明顯下降,過量的自由基可使生物膜磷脂雙分子層中的不飽和脂肪酸過氧化,而形成脂質過氧化物,從而使組織細胞的結構和功能發生障礙。
實驗中筆者發現低壓低氧暴露引起小鼠腦內氧化應激相關因子升高,這表明低壓低氧可以引起神經系統氧化應激反應。在小膠質細胞中特異性地敲除HDAC3后,低壓低氧暴露引起小鼠腦內氧化應激相關因子下調,這表明小膠質細胞中敲除HDAC3可以緩解低壓低氧所導致的氧化應激反應。提示HDAC3參與了低壓低氧導致的氧化應激反應。HDAC3屬于HDACs,是大腦中表達最廣泛的HDACs[18-19]。抑制HDAC3減少相關蛋白去乙酰化作用,可以抑制相關炎癥信號通路的激活,減輕缺血再灌注引起的腦損傷,有助于減輕神經退行性疾病中的運動表型缺陷和轉錄失調[20]。本實驗中,敲除小膠質細胞中HDAC3后可減輕低壓低氧導致的氧化應激反應,可能與HDAC3的去乙酰化作用導致轉錄受到抑制有關,HDAC3的特異性抑制劑可能成為高原腦損傷治療的有效藥物,還有待深入研究。
氧化應激狀態下會伴隨著抗氧化能力的降低,例如SOD的下調[21]。但是也有研究[22-23]顯示神經炎癥以及內分泌疾病所導致的氧化應激反應中伴隨著SOD的上調。本實驗中低壓低氧暴露后,ROS水平升高,這直接證明了氧化應激反應的發生。而BV2小膠質細胞以及小鼠腦內SOD顯著升高,造成這個差異的原因,一方面可能來自于氧化應激反應持續時間的不同;另一方面還可能是由于超氧化物成分的相對比例不同。文獻[24]顯示,小膠質細胞氧化應激水平的增加促進細胞核易位和細胞信號通路的激活促進iNOS和促炎細胞因子的表達,從而進一步延長大腦氧化應激和炎癥循環。但是本實驗中沒有發現低壓低氧暴露后炎癥因子的顯著上調,導致這個現象的原因可能在于小鼠相對于人類對于高原環境的抵抗能力更強,此外還可能由于小鼠低壓低氧處理的時間短、采樣過程中標本復氧等原因,從而無法引起強烈的神經炎癥的發生。
本研究揭示了暴露于低壓低氧環境中將導致腦組織及小膠質細胞氧化應激水平升高,抑制HDAC3則可以緩解該現象,進一步豐富了HDAC3在缺氧相關疾病中的作用研究。在此基礎上,本課題組將繼續研究干預HDAC3是否可改善低壓低氧導致的認知功能降低,從而為相關疾病的防治提供藥物靶點和理論依據。

