重癥肺炎患者血清circ_0009128 表達及其與TLR4、免疫功能的相關性研究
鄭國平,田孝瑞,苗士領
(河南省第二人民醫院ICU,河南 鄭州 451191)
肺炎是臨床常見的一種炎癥性疾病, 其主要是相關因素損傷機體后氣道、肺泡等出現炎癥,其中重癥肺炎是指肺炎患者出現急性呼吸衰竭及終末器官功能障礙等情況, 由于重癥肺炎起病迅速及進展快導致患者死亡率逐年上升[1-2]。 因而探究重癥肺炎發生的相關分子機制對臨床治療具有重要意義。 研究表明炎癥反應、氧化應激在肺炎發生及發展過程密切相關[3]。 重癥肺炎發生過程還與機體免疫功能降低有關,其中Toll 樣受體4(Toll-like receptor 4,TLR4)屬于跨膜信號轉導受體并可參與免疫反應[4]。相關報道指出環狀RNA(circular RNA,circRNA)屬于一類非編碼RNA 且具有穩定性、組織特異性等特點, 還可能參與神經系統疾病、心血管疾病等多種疾病發生及發展過程[5]。 研究表明 環 狀RNA_0009128 (circular RNA_0009128,circ_0009128)在活動性肺結核中呈低表達,并可能作為活動性肺結核診斷及治療的潛在靶標[6]。 但circ_0009128 在重癥肺炎患者中的表達及其臨床意義尚未完全闡明。 因此,本研究主要探討重癥肺炎患者血清circ_0009128 的表達水平, 并分析其與炎癥因子、氧化指標及免疫功能的相關性。
1 資料與方法
1.1 一般資料 選取2017年2月至2018年10月本院收治的重癥肺炎患者90 例為重癥肺炎組,其中男60 例, 女30 例,年齡45~70 歲, 平均年齡(55.36±8.59)歲,所有患者均符合中華醫學會呼吸病學分會制定的重癥肺炎診斷標準[7]。 排除標準:合并惡性腫瘤患者;免疫功能障礙患者;凝血功能障礙患者;呼吸衰竭患者。 選取同期普通肺炎患者80 例為普通肺炎組, 所有患者均符合普通肺炎診斷標準[8],其中男58 例,女22 例,年齡42~72 歲,平均年齡(54.69±8.96)歲。 同時選取同期于本院進行體檢的健康志愿者80 例為對照組, 其中男55例, 女25 例,年齡42~75 歲, 平均年齡(55.69±9.52)歲。 各組受試者一般資料比較差異無統計學意義(P>0.05),具有可比性。 本研究經本院倫理委員會批準,所有研究對象知情且簽署同意書。
1.2 方法
1.2.1 采集血液樣本 抽取三組研究對象入組后的空腹靜脈血5 mL,4 ℃經3 000 r/min 離心10 min,吸取上清,置于-20℃冰箱內保存。
1.2.2 實時熒光定量聚合酶鏈反應(Quantitative Real-time PCR,qRT-PCR) 檢測血清circ_0009128的表達水平 采用Trizol 法(美國Invitrogen 公司)提取血清中的總RNA, 應用Nanodrop2000c 超微量分光光度計檢測RNA 濃度與純度。 參照反轉錄試劑盒說明書將總RNA 反轉錄為cDNA,circ_0009128 正 向 引 物5’-CTGGCTCAATTGCTCACTGA-3’,反向引物5’-CCTCAAATGATCTGCCTGCC-3’;GAPDH 正向引物5’-AACGGATTTGGTCGTATTG-3’, 反向引物5’-GGAAGATGGTGATGGGATT-3’, 引物由上海生工生物工程股份有限公司設計合成。 以cDNA 為模板進行qRTPCR 反應,qRT-PCR 反應體系:cDNA 2 μL,Real-Time Master Mix 10 μL, 正 反 向 引 物 各1 μL,RNase-Free ddH2O 補足體系至20 μL; 反應條件:95 ℃5 min,95 ℃15 s,60 ℃1 min,72 ℃30 s(循環40 次)。 circ_0009128 以GAPDH 為內參,采用2-ΔΔCt法計算circ_0009128 相對表達量。 反轉錄試劑盒與qRT-PCR 試劑盒購自美國Thermo Fisher公司。
1.2.3 檢測血清炎癥因子水平 采用酶聯免疫吸附法 (enzyme linked immunosorbent assay,ELISA)檢測血清白細胞介素6(interleukin-6,IL-6)、白細胞介素-18(interleukin-18,IL-18)、腫瘤壞死因子-α(Tumor Necrosis Factor-α,TNF-α)的水平,檢測試劑盒購自上海酶聯生物科技有限公司, 嚴格按照試劑盒說明書進行操作。
1.2.4 檢測血清氧化應激指標 采用硫代巴比妥酸比色法檢出血清過氧化脂質(lipoperoxides,LPO)水平, 采用氮藍四唑法檢測血清超氧化物歧化酶(superoxide dismutase,SOD)水平,檢測試劑盒購自上海碧云天生物技術有限公司。 采用改良的Hafeman 氏法檢測血清谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)水平,檢測試劑盒購自上海盈公酶聯檢測試劑有限公司, 嚴格按照試劑盒說明書進行操作。
1.2.5 評估患者肺部感染程度 采用肺部感染評分(Clinical Pulmonary Infection Score,CPIS)評估患者肺部感染程度,分數越高預示肺部感染越嚴重[9]。
1.2.6 檢測TLR4 水平與免疫球蛋白水平 采用ELISA 法檢測血清Toll 樣受體4(Toll-like receptor 4,TLR4)水平,檢測試劑盒購自北京方程佰金科技有限公司。采用免疫比濁法檢測血清免疫球蛋白A(Immunoglobulin A,IgA)、 免 疫 球 蛋 白G (Immunoglobulin G,IgG)、免疫球蛋白M(Immunoglobulin M,IgM)水平,檢測試劑盒購自長春匯力生物技術有限公司。
1.3 統計學處理 采用SPSS 21.0 統計學軟件分析數據,計量資料以(±s)表示且均符合正態分布,兩組間比較采用獨立樣本t 檢驗,多組間比較采用單因素方差分析;采用Pearson 法分析重癥肺炎患者circ_0009128 與炎癥因子、 氧化應激、CPIS 評分、TLR4、免疫蛋白的相關性,P<0.05 為差異具有統計學意義。
2 結果
2.1 重癥肺炎患者血清circ_0009128 表達量 與對照組比較, 普通肺炎組、 重癥肺炎組血清circ_0009128 的表達量均顯著降低(P<0.05);與普通肺炎組比較, 重癥肺炎組血清circ_0009128 的表達量顯著降低(P<0.05),見表1。
表1 重癥肺炎患者血清circ_0009128 表達量比較(±s)

表1 重癥肺炎患者血清circ_0009128 表達量比較(±s)
注:與對照組比較,*P<0.05;與普通肺炎組比較,#P<0.05。
組別 n對照組普通肺炎組重癥肺炎組80 80 90 F P circ_0009128 1.01±0.20 0.72±0.11*0.41±0.13*#335.969 0.000
2.2 重癥肺炎患者血清炎癥因子水平比較 與對照組比較,普通肺炎組、重癥肺炎組血清IL-6、IL-18、TNF-α 水平顯著升高(P<0.05);與普通肺炎組比較,重癥肺炎組血清IL-6、IL-18、TNF-α 水平顯著升高(P<0.05),見表2。
表2 重癥肺炎患者血清炎癥因子水平比較(±s,ng/L)
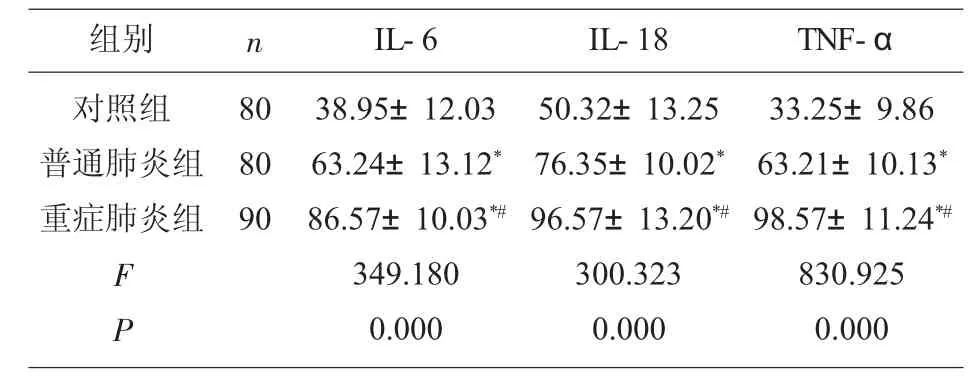
表2 重癥肺炎患者血清炎癥因子水平比較(±s,ng/L)
注:與對照組比較,*P<0.05;與普通肺炎組比較,#P<0.05。
組別 n對照組普通肺炎組重癥肺炎組80 80 90 F P IL-6 IL-18 38.95±12.03 63.24±13.12*86.57±10.03*#349.180 0.000 50.32±13.25 76.35±10.02*96.57±13.20*#300.323 0.000 TNF-α 33.25±9.86 63.21±10.13*98.57±11.24*#830.925 0.000
2.3 重癥肺炎患者血清氧化應激指標比較 與對照組比較,普通肺炎組、重癥肺炎組血清LPO 水平顯著升高 (P<0.05),SOD、GSH-Px 活性顯著降低(P<0.05); 與普通肺炎組比較, 重癥肺炎組血清LPO 水平顯著升高(P<0.05),SOD、GSH-Px 活性顯著降低(P<0.05),見表3。
表3 重癥肺炎患者血清氧化應激指標比較(±s)

表3 重癥肺炎患者血清氧化應激指標比較(±s)
注:與對照組比較,*P<0.05;與普通肺炎組比較,#P<0.05。
組別 n對照組普通肺炎組重癥肺炎組80 80 90 F P LPO(μmol/L) SOD(U/L)10.20±1.23 15.52±1.03*20.03±5.20*#193.693 0.000 485.25±36.24 356.21±22.03*186.34±20.12*#2655.865 0.000 GSH-Px(U/L)126.35±12.45 95.32±10.15*45.32±9.23*#1261.870 0.000
2.4 重癥肺炎患者CPIS 評分比較 與普通肺炎組比較,重癥肺炎組CPIS 評分顯著升高(P<0.05),見表4。
表4 重癥肺炎患者CPIS 評分比較(±s)

表4 重癥肺炎患者CPIS 評分比較(±s)
注:與普通肺炎組比較,*P<0.05。
組別 n普通肺炎組重癥肺炎組80 90 t P CPIS 評分5.16±1.45 6.23±1.32*5.036 0.000
2.5 重癥肺炎患者血清TLR4 水平與免疫蛋白水平比較 與對照組比較,普通肺炎組、重癥肺炎組血清TLR4 水平顯著升高(P<0.05),血清IgA、IgG、IgM 水平顯著降低(P<0.05);與普通肺炎組比較,重癥肺炎組血清TLR4 水平顯著升高(P<0.05),血清IgA、IgG、IgM 水平顯著降低(P<0.05),見表5。
表5 重癥肺炎患者血清TLR4 水平與免疫蛋白水平比較(±s)
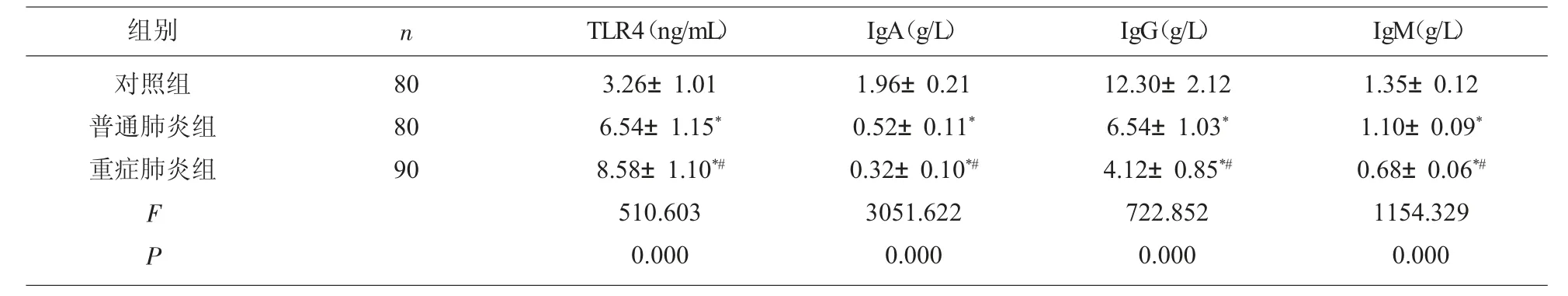
表5 重癥肺炎患者血清TLR4 水平與免疫蛋白水平比較(±s)
注:與對照組比較,*P<0.05;與普通肺炎組比較,#P<0.05。
組別 n TLR4(ng/mL) IgA(g/L) IgG(g/L) IgM(g/L)對照組普通肺炎組重癥肺炎組80 80 90 F P 3.26±1.01 6.54±1.15*8.58±1.10*#510.603 0.000 1.96±0.21 0.52±0.11*0.32±0.10*#3051.622 0.000 12.30±2.12 6.54±1.03*4.12±0.85*#722.852 0.000 1.35±0.12 1.10±0.09*0.68±0.06*#1154.329 0.000
2.6 circ_0009128 與炎癥因子、 氧化應激、CPIS 評分、TLR4、 免疫蛋白的相關性分析 采用Pearson法分析重癥肺炎患者circ_0009128 與炎癥因子、氧化應激、CPIS 評分、TLR4、 免疫蛋白的相關性,結果顯示circ_0009128 與SOD、GSH-Px、IgA、IgG、IgM 呈正相關(P<0.05),而與IL-6、IL-18、TNF-α、LPO、CPIS 評分、TLR4 呈負相關(P<0.05),見表6。
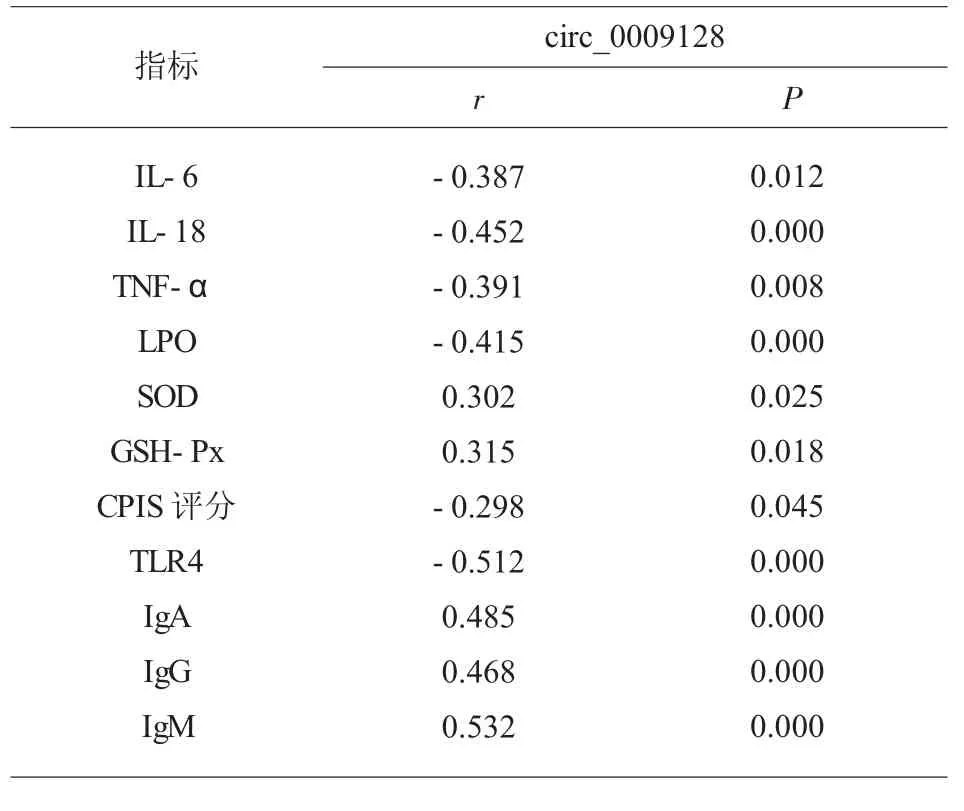
表6 circ_0009128 與炎癥因子、氧化應激、CPIS 評分、TLR4、免疫蛋白的相關性分析(r/p)
3 討論
circRNA 在自身免疫性疾病、炎癥性疾病中表達異常并可能參與多種疾病發生及發展過程[10-11]。但circ_0009128 在重癥肺炎中的表達及其作用機制尚未闡明。 本研究結果顯示重癥肺炎患者血清circ_0009128 的表達水平顯著降低,其表達量顯著低于普通肺炎患者及對照組, 提示circ_0009128在重癥肺炎發生過程中可能發揮重要調控作用。研究表明炎癥反應與氧化應激在肺炎發生及發展過程中發揮重要作用,其中IL-6、IL-18、TNF-α 可參與機體炎癥反應, 并可促使患者肺部受損而引發重癥肺炎,LPO 屬于氧自由基與多聚不飽和脂肪酸的反應產物且具有促進氧化應激的作用,SOD、GSH-Px 是過氧化物分解酶, 可提高機體抗氧化能力[12-13]。 本研究結果顯示重癥肺炎患者血清中IL-6、IL-18、TNF-α、LPO 水平顯著升高, 血清中SOD、GSH-Px 活性顯著降低, 與上述研究報道結果相似,說明重癥肺炎患者體內炎癥反應加重,且患者存在氧化/抗氧化失衡, 即重癥肺炎患者存在氧化應激反應。 本研究結果顯示重癥肺炎患者CPIS 評分顯著高于普通肺炎組患者, 提示重癥肺炎患者肺部感染情況明顯加重。 本研究采用Pearson 法分析顯示circ_0009128 與SOD、GSH-Px呈正相關,而與IL-6、IL-18、TNF-α、LPO、CPIS 評分呈負相關, 提示circ_0009128 與重癥肺炎患者炎癥反應、氧化應激反應密切相關。
重癥肺炎病情發展可引起多臟器功能障礙綜合征,而病原菌感染是引發肺炎的重要原因,TLRs信號通路可促進炎性細胞因子生成從而激發炎癥反應,TLR4 可與其配體結合而促進炎癥因子釋放從而引發炎癥反應[14-17]。研究表明免疫球蛋白IgA、IgG、IgM 與肺炎患者免疫功能密切相關,肺炎患者血清中IgA、IgG、IgM 水平顯著降低[18-21]。 本研究結果顯示重癥肺炎患者血清TLR4 水平顯著升高,IgA、IgG、IgM 水平顯著降低, 與上述研究報道結果相似, 提示重癥肺炎患者體內存在細胞免疫功能失調。 同時本研究結果顯示circ_0009128 與IgA、IgG、IgM 呈正相關, 而與TLR4 呈負相關, 提示circ_0009128 與重癥肺炎患者病情嚴重程度密切相關。 分析原因可能為circ_0009128 表達降低可引發炎癥反應及氧化應激反應, 炎癥反應可加重患者肺部損傷程度還可影響機體免疫功能從而導致機體抵抗能力降低最終加重肺部感染嚴重程度。
綜上所述, 重癥肺炎患者血清circ_0009128的表達水平顯著降低, 炎癥因子、LPO、TLR4 水平升高,SOD、GSH-Px 活性與IgA、IgG、IgM 水平顯著降低,circ_0009128 與炎癥反應、 氧化應激及免疫功能密切相關,circ_0009128 表達量降低與重癥肺炎發生及發展密切相關, 并可能作為重癥肺炎診斷及判斷病情嚴重程度的重要指標。 本研究首次檢測重癥肺炎患者血清circ_0009128 的表達水平, 并初步分析其與疾病嚴重程度及病情發展的相關性,但關于其具體作用機制仍需進一步探究。

