我國獸用化學藥品標準物質與國內外藥品標準物質管理模式和研制技術的比較研究
韓寧寧,趙富華,王 雷,王 軒,張秀英
(中國獸醫(yī)藥品監(jiān)察所,北京 100081)
獸藥標準物質是獸藥檢驗的實物對照標準,具有確定的可追溯與可傳遞的特性量值,是評價獸藥質量的標尺。不斷推動和完善標準物質管理體系建設是保障獸藥標準物質管理模式科學化與規(guī)范化的根源;不斷優(yōu)化和提高標準物質研制技術是確保獸藥標準物質性質穩(wěn)定賦值可靠的基礎。本文對我國獸用化學藥品標準物質和國內外藥品標準物質的管理模式與研制技術進行了比較和研究,以期為我國獸用化學藥品標準物質的管理與研制提供借鑒和參考,進而為獸藥產品監(jiān)管和評審提供準確可靠的實物保障。
1 我國獸用化學藥品標準物質和國內外藥品標準物質管理模式
1.1 我國藥品標準物質管理模式 根據《藥品管理法》[1]和《藥品注冊管理辦法》[2]的規(guī)定,中國食品藥品檢定研究院(中檢院)是負責國家藥品標準物質的計劃、研究、制備、標定、審核、分發(fā)和管理工作的唯一法定機構。目前中檢院已形成了由標準物質與標準化管理中心歸口管理、各研制部門共同參與、系統(tǒng)內各單位協(xié)作標定、藥品標準物質委員會技術審查的管理模式[3]。與此同時,中檢院建立了“標準物質信息管理系統(tǒng)”,實現了從品種立項到入庫供應的全程自動化管理[4]。中檢院在ISO 17025的質量體系基礎上,已按照ISO 17034:2016《標準物質/標準樣品生產者能力通用要求》和中國等同轉化的CNAS CL04:2017《標準物質/標準樣品生產者能力認可準則》相關要求,建立了標準物質質量管理體系,做到了標準物質全流程的質量控制[5]。
1.2 美國藥品標準物質管理模式 根據《聯(lián)邦食品、藥品和化妝品法》[6]的規(guī)定,藥品標準物質的管理分別由美國藥典委員會(USPC)和美國食品藥品監(jiān)督管理局(FDA)負責。其中USPC負責美國法定藥品標準物質的標準制定、研制、標定和供應;FDA負責藥品標準物質相關法律法規(guī)的實施管理和具體執(zhí)行。USPC是制訂國家藥典質量標準的非政府組織,其認為標準與標準物質是不可分割的兩部分,只有在保證標準物質可同時研制發(fā)放的前提下該標準才能被收入藥典標準中[7]。USPC下設標準物質管理部門,該部門與標準制定部門溝通合作,在啟動藥典標準研究后,標準物質管理部門即開始尋求適宜原料,制定研制方案,然后交由標準物質實驗室完成樣品分裝、運輸和協(xié)作標定,所有實驗數據交由標準物質管理部門進行統(tǒng)計分析和技術審查,審核通過后對外發(fā)放。
1.3 歐盟藥品標準物質管理模式 歐洲藥品質量管理局(EDQM)為所有適用于《歐洲藥典制定公約》的締約國藥品生產和質量控制制定和提供官方標準物質。為了保證藥典各論和相應標準物質的同步發(fā)布,EDQM內部負責藥典工作和負責標準物質工作的兩個部門保持著非常密切的合作關系[8]。藥典部門在召開有關專家委員會時會邀請標準物質部門的相關人員參會,使標準物質部門掌握《歐洲藥典》新增各論的建立和各論修訂的最新情況,在新增各論的討論研究過程中相應的標準物質研制工作就開始啟動。這一機制可以保證在新各論發(fā)布的同時,相應的標準物質就能夠得到提供。
1.4 國際藥典藥品標準物質管理模式 《國際藥典》由世界衛(wèi)生組織(WHO)編纂出版,供WHO成員國免費使用。許多國家,尤其是非洲各成員國將《國際藥典》作為本國或地區(qū)的認可標準,具有法律效力[9]。WHO國際藥典及藥品專家委員會負責審批世界各地協(xié)作標化中心研制的標準物質,其在 1975年制定了《化學標準物質建立、保存和分發(fā)指導原則》,其目的是建立不同國家和地區(qū)機構在化學標準物質研制過程中的協(xié)作性和一致性。從2006年起,EDQM承擔起WHO抗生素國際標準物質的制備和發(fā)放任務;從2010年起,EDQM承擔起WHO國際藥典化學標準物質的制備和發(fā)放任務[10]。
1.5 我國獸用化學藥品標準物質管理模式 中國獸醫(yī)藥品監(jiān)察所(中監(jiān)所)承擔著獸藥國家標準中所需的獸藥標準物質的標定和供應工作。2005年,中監(jiān)所進行了內設機構與職能的調整,新成立了標準物質研究室,負責獸藥標準物質的組織、協(xié)調和管理及新標準物質的研制;并首次籌建了獸藥標準物質技術小組,制定了標準物質管理辦法、研制技術規(guī)范、研制審批程序和供應程序等。2017年,中監(jiān)所再次進行了內設機構職能調整,由業(yè)務管理處負責化學藥品標準物質的管理,化學藥品檢測室負責標準物質的研制及供應。2018年,中監(jiān)所成立了獸藥標準物質委員會,下設化學藥品專業(yè)分委會,負責化藥標準物質的全面技術審核。為適應信息化管理需要,2020年推出“中國獸醫(yī)藥品標準物質訂購平臺”,解決了無網絡銷售途徑導致的信息不互通問題。
目前,中監(jiān)所可供應化藥對照品90種,抗生素標準品和對照品78種,中藥化學對照品15種,對照藥材21種,對應獸藥國家標準的供應率達85%以上,年均供應量近三萬支。除了供應中監(jiān)所自研的標準物質外,還從中檢院代購350余種人獸共用品種的標準物質。
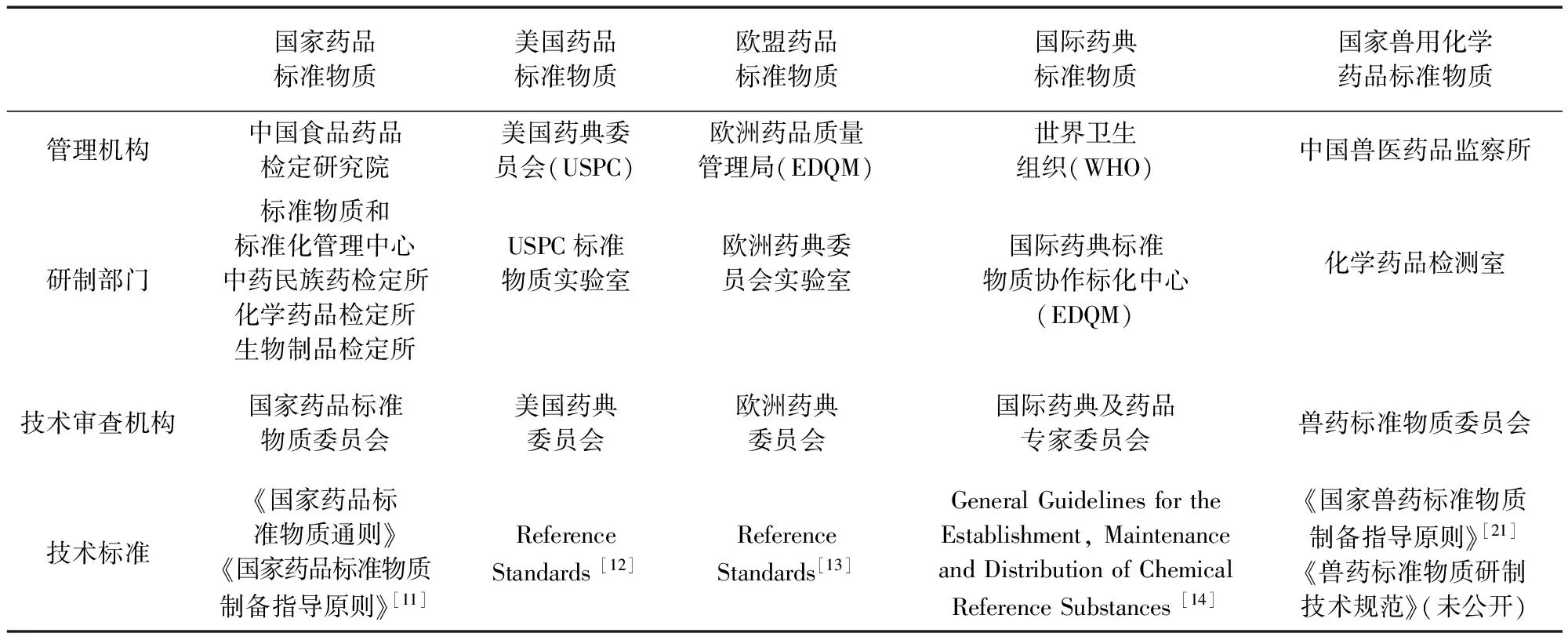
表1 我國獸用化學藥品標準物質與國內外藥品標準物質管理模式總結
2 我國獸用化學藥品標準物質和國內外藥品標準物質研制技術
2.1 標準物質的原料篩選 歐洲藥典《標準物質指導原則》[13]規(guī)定“標準物質的候選原料需要采用多種分析方法進行全面檢測。除非能證明其合理性,候選原料通常要符合相關藥品質量標準的規(guī)定”。《國家藥品標準物質制備指導原則》[11]中規(guī)定“原料的選擇應滿足適用性、代表性及可獲得性的原則。原料的性質應符合使用要求。原料的均勻性、穩(wěn)定性及相應特性量值范圍應適合該標準物質的用途。”《獸藥標準物質研制技術規(guī)范》對獸用化學藥品標準物質規(guī)定“供含量測定的原料除另有規(guī)定外,純度不低于99.5%;供制備薄層鑒別、檢查用的原料,一般純度不低于90.0%;供制備紅外鑒別用的原料,一般純度不低于98.0%;供制備有關物質檢查用的原料,一般純度不低于95.0%”。
2.2 標準物質的結構確證 標準物質的結構確證通常會應用到多種技術手段,如核磁共振(NMR)波譜分析、質譜(MS)分析、紅外(IR)光譜分析、紫外(UV)光譜分析、元素分析等。《國家藥品標準物質制備指導原則》[11]規(guī)定“驗證已知結構的化合物需要提供必要的理化參數及波譜數據,并提供相關文獻及對比數據。如無文獻記載,應提供完整的結構解析過程。對于不能用現代理化方法確定結構的藥品標準物質,應選用適當的方法對其組分進行確證”。我國獸用化學藥品標準物質對于新研制品種要求基于現有實驗條件進行全面結構確證,對于換批制備品種要求至少進行一項標準中涉及的鑒別檢驗。
2.3 標準物質的均勻性評估 藥品標準物質均勻性評估的主要目的是為了判定最小包裝單元間特性量值的均勻性,保證其特性量值的變動在可接受范圍[15]。均勻性檢驗原則上應在候選原料分裝成最終產品之后進行。含量測定用標準物質,無論首批研制還是換批制備,均應進行均勻性評估,評估合格后方可開展定值實驗。原則上選擇藥品標準物質標示的特性量值(通常為含量或純度)進行均勻性檢驗,檢驗方法優(yōu)選藥品標準檢驗方法或經驗證的檢驗方法。我國獸用化學藥品標準物質在原料選擇時即要求應為GMP車間生產的同一批次的原料,不可使用混批原料,在源頭上對標準物質均勻性進行控制。
2.4 標準物質的定值 國內外標準物質研制機構對化學對照品標準物質的定值方法[11]~[14]包括三類:用高準確度的絕對或權威測量方法定值(即質量平衡原理定值);用兩種以上不同原理的已知準確度的可靠方法定值;多個實驗室協(xié)作標定。原則上首選質量平衡原理,其定值公式為:(100.0-水分-有機溶劑-無機雜質)×純度%。不同原理的可靠方法包括滴定法、色譜法、差示掃描量熱法、定量核磁法等。《國家藥品標準物質制備指導原則》[11]中規(guī)定“參加協(xié)作標定的實驗室應具有候選藥品標準物質定值的必備條件及相關實驗室資質。協(xié)作實驗室的數目或獨立定值組數應符合統(tǒng)計學的要求”。外標法協(xié)作標定的測定結果用于對質量平衡原理定值結果的輔佐證明。實際上,協(xié)作標定也是美國、歐盟、WHO等國際藥典標準物質通用的定值方法。例如,USP的協(xié)作標定實驗室可以是USP在美國或其他國家的實驗室,也可以是FDA等政府機構的實驗室及美國化學藥品企業(yè)研發(fā)部門的實驗室[16]。EDQM的協(xié)作標定實驗室大都來自于歐洲官方藥品質量控制實驗室網,并會邀請藥品生產企業(yè)的質控實驗室參加協(xié)作標定。WHO的協(xié)作標定實驗室遍布世界范圍,在指導建議中指出,一般參與的實驗室數目在5到25個之間[10]。我國的獸用化學藥品標準物質,新研制品種的定值亦以質量平衡法為首選,多種不同原理的方法相互驗證。換批制備品種的定值以外標法為主,所用標準物質可選擇USP、EP和中檢院等國際標準物質,也可以選用上一批自研的標準物質,但需由兩人以上協(xié)作標定。另外,中監(jiān)所近年來不斷加強與各省級藥檢機構、科研機構和生產企業(yè)的聯(lián)合研制工作,通過委托生產企業(yè)和科研機構合作研制原料、各省級藥檢所協(xié)作標定等方式增強標準物質的研制力量。
2.5 標準物質的穩(wěn)定性評估與監(jiān)測 標準物質通常在藥品研發(fā)時已經積累了相應的有關穩(wěn)定性資料,故可通過經驗資料進行判斷或評估。對于新研制標準物質,應制定長期穩(wěn)定性監(jiān)測計劃,在該品種分發(fā)后、換批前持續(xù)開展長期穩(wěn)定性研究,進一步積累完善該標準物質的穩(wěn)定性研究資料。WHO《化學標準物質(CRS)建立、保存和分發(fā)指導原則》[14]規(guī)定“監(jiān)測CRS穩(wěn)定性的分析方法取決于CRS的性質及用途。用于鑒別的CRS,僅需要證明其仍適用于相應的鑒別項即可。如果用于其它目的,則須多方面采用快速、靈敏的方法檢查。被廣泛采用的檢查方法是色譜法。凡是影響CRS一致性的變化都表明此CRS應立即停止使用”。我國的獸用化學藥品標準物質是以期間核查的方式進行穩(wěn)定性監(jiān)測。每年制訂標準物質期間核查計劃,針對新標準物質采取先密后疏的監(jiān)測原則,對特性量值進行監(jiān)測。按照國際藥品標準物質管理慣例,對獸用化學藥品標準物質不設置有效期,更換新批次后,在“中國獸醫(yī)藥品標準物質訂購平臺”進行公示。
3 對我國獸用化學藥品標準物質未來發(fā)展的建議
3.1 進一步推進獸藥標準物質管理法制化 通過比較研究得知,國內外藥品標準物質的研制規(guī)范或指導原則均以藥典附錄或官方文件的形式公開發(fā)布,有利于規(guī)范對藥品標準物質的研制、供應和使用,也會對企業(yè)研制新注冊產品標準物質有所啟發(fā)與引導。為進一步明確中監(jiān)所的國家獸藥標準物質研制、管理和供應職責,統(tǒng)一行業(yè)內對獸藥標準物質使用重要性的認識,有必要將《獸藥標準物質管理辦法》、《獸藥標準物質研制技術規(guī)范》等中監(jiān)所內部文件法制化和公開化。此外,應繼續(xù)規(guī)范和完善標準物質研制技術,新研制標準物質和換批標準物質均應提前設計定值方法,以保證賦值的準確性與合理性。
3.2 進一步推進標準新增與標準物質研制同步化 我國的獸藥國家標準體系日益完善,《獸藥標準管理辦法》(征求意見稿)[17]中提到“獸藥標準包括獸藥國家標準和獸藥注冊標準”,“中國獸醫(yī)藥品監(jiān)察所負責獸藥國家標準的標準物質標定和供應工作”,希望在法律層面進一步推進獸藥標準分級管理,這既有利于明確獸藥國家標準物質的供應范疇,也有利于強化獸藥研發(fā)企業(yè)對相應標準物質研制的主體責任。但我國的獸藥國家標準物質是一般需待每版《中國獸藥典》出版后,研制部門才開始進行新標準物質的研制,標準物質的供應存在一定的滯后性。在這方面,我們可以借鑒USPC和EDQM的經驗,獸藥典委員會辦公室應與標準物質研制部門保持密切聯(lián)系,在質量標準制修訂的同時,及時啟動相應的標準物質研制工作,保證新增標準物質發(fā)布的同時,相應的標準物質實現及時供應。
3.3 進一步借鑒國內外先進的管理模式 目前,國內外幾大藥品標準物質管理體系均通過了ISO或CNAS的認可。中檢院根據藥品標準物質的研制、生產和標定流程,共建立了與標準物質有關的程序文件40個,其中9個為標準物質專有。為保證同類藥品標準物質品種測定項目設定的合理性和要求的一致性,中檢院針對各類藥品標準物質的特性,細化了相應的操作規(guī)范,實現了全流程質量管理[3]。可見將獸藥標準物質納入質量管理體系已是大勢所趨,這有利于優(yōu)化研制、生產、審評和分發(fā)的組織管理,也是持續(xù)提升供應能力和服務水平的基礎。
3.4 進一步擴大獸用化學藥品標準物質種類范圍 目前中監(jiān)所供應的獸用化學藥品標準物質包括化學藥品對照品、抗生素標準品和對照品、中藥化學對照品、對照藥材四個類別。其中中藥化學對照品制備技術和成本要求高,用戶也反饋檢驗成本壓力大。基于中醫(yī)理論指導下的全面藥效物質研究基礎和“一標多測”的研制思路,對照提取物憑借制備相對簡單、成本價格低廉、質控指標較多的優(yōu)勢成為國內外藥品標準物質的研制熱點,中國藥典、EP、USP等多個藥典均已有多個品種將對照提取物用于藥品整體的定性或定量質量控制[18]。獸藥的對照提取物研究尚處于初期階段,獸醫(yī)專用中藥的對照提取物研制空白亟需填補。另外,中藥指紋圖譜庫、待測物特征紫外吸收光譜庫、LC-MS特征離子碎片色譜圖庫等的研究也將電子對照品的研制推上了日程。USP《標準物質指導原則》[12]中已有電子對照品(Authentic Visual References)的相關定義。實際上,在獸藥非法添加物篩查領域,農業(yè)農村部公告第169號[19]公開的153種目標化合物的特征紫外吸收光譜圖即為電子對照品的典型應用。相信電子對照品將憑借不使用實物對照品即可實現藥品整體質量控制的優(yōu)勢成為新的研究熱點。
3.5 進一步打通標準物質原料獲取途徑 《獸藥注冊管理辦法》[20]明確規(guī)定,企業(yè)申請注冊新獸藥,需同時向中監(jiān)所報送制備標準物質的原料及相關標準物質的研究資料。目前這一規(guī)定在化學藥品注冊檢驗過程中已得以嚴格執(zhí)行,基本解決了新增品種的原料供應問題。但對于換批制備的標準物質,原料的獲取基本還是通過研制人員與省級藥檢單位溝通,間接從生產企業(yè)獲得,這種方式對原料來源的穩(wěn)定性和品質的可控性均不利。我們可以借鑒USPC的經驗——其鼓勵企業(yè)以捐贈的形式免費提供化學藥品標準物質候選原料,如果原料能通過USPC的評估,捐贈企業(yè)除得到USP認證外,還會獲得USPC頒發(fā)的感謝信和證書,并被納入USPC合作方的表彰計劃中[16]。另外,在標準物質說明書中注明原料供應企業(yè),亦可極大提高其市場影響力,進而促使企業(yè)提高供應原料的積極性。

