魔芋膠對南美白對蝦肌原纖維蛋白凝膠特性的影響
孫樂常,周典穎,杜 瀚,翁 凌,繆 松,劉光明,曹敏杰,*
(1.集美大學海洋食品與生物工程學院,福建 廈門 361021;2.福建省海洋功能食品工程技術研究中心,福建 廈門 361021;3.水產品深加工技術國家地方聯合工程研究中心,福建 廈門 361021;4.愛爾蘭農業部Teagasc食品研究中心,愛爾蘭 科克 999014)
南美白對蝦()是世界三大養殖蝦類之一。隨著苗種選育與養殖技術的日益成熟,我國南美白對蝦的產量呈現逐年上升的趨勢,2020年全國南美白對蝦養殖達186.29萬 t,已成為我國重要的養殖蝦種。除了鮮銷外,南美白對蝦主要被加工成凍蝦、開背蝦、面包蝦以及即食蝦干等加工品。近年來,以蝦滑為代表的蝦糜類制品因其口感爽滑Q彈、味道鮮美迅速成為火鍋類餐飲的熱捧產品,市場潛力巨大。凝膠特性是評價肉糜類制品品質的重要指標,而添加淀粉、非肌肉蛋白、多糖等生物大分子能有效提高肉糜類制品的凝膠彈性,提高產品的品質與經濟價值。
魔芋膠(konjac glucomannan,KGM)是魔芋塊莖中提取的水溶性、非離子性高分子質量多糖,由葡萄糖和甘露糖以1∶1.5或1∶1.6的物質的量比組成,具有良好的保水性、膠凝性與生物兼容性。KGM自身可以形成獨立的網絡,通過填充作用支撐和穩定蛋白凝膠的網絡支架,還能與蛋白質產生相互作用,有效增強凝膠強度和持水能力。研究發現,KGM能有效改善凝膠強度較差的魷魚魚糜與低值魚糜的品質,彌補因凝膠劣化導致的品質下降。Yuan Li等發現相比于KGM,脫乙酰化后的KGM能形成熱不可逆凝膠,添加到鰱魚魚糜中具有更好的凝膠強度,但持水力卻顯著下降。Jian Wenjie等單獨考察KGM與肌原纖維蛋白(myofibrillar protein,MF)的相互作用,發現高分子質量KGM對羅非魚MF的凝膠化反而具有負作用,而低分子質量KGM能通過多糖-蛋白分子的相互作用進一步促進MF凝膠化能力。Zhuang Xinbo等則發現,當KGM添加量小于1%時能顯著提高豬肉MF的凝膠化能力與持水力,而過量的KGM會形成連續的水凝膠界面,進而抑制MF的分子間交聯與凝膠化。由此可見,KGM對MF的影響會因KGM的化學性質、添加量以及不同物種來源的MF自身特性而存在顯著差異。與魚類、哺乳動物肌肉MF相比,對蝦等甲殼類動物的MF蛋白組成存在明顯差異,KGM在MF凝膠化過程中的作用機理尚鮮見報道。本研究以南美白對蝦為對象,將KGM與對蝦肌原纖維蛋白(shrimp myofibrillar protein,SMP)按不同質量比(1∶50、1∶20、1∶10)進行復配制備復合凝膠體系得到復合凝膠SK50、SK20、SK10,通過測定表面疏水性、內源性熒光、濁度及粒徑、流變學、紅外光譜、蛋白變化及凝膠微觀結構,研究復合體系的凝膠特性變化,旨在為KGM在蝦糜及其制品生產中的應用提供指導。
1 材料與方法
1.1 材料與試劑
南美白對蝦購于福建省廈門市集美區水產品市場。
KGM(食品級) 廈門市美拉德食品科技有限公司;8-苯胺基-1-萘磺酸銨鹽(8-anilino-1-naphthalenesulfonic acid ammonium salt,ANS) 美國Sigma公司;標準蛋白 美國Thermal公司;十二烷基硫酸鈉(sodium dodecyl sulfate,SDS,電泳純)、丙烯酰胺美國Bio-Rad公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)等其他試劑均為國產分析純。
1.2 儀器與設備
PT-2100組織搗碎機 瑞士Kinematica公司;Avanti J-25大型冷凍離心機 美國Beckman公司;DHR-2流變儀 美國TA儀器公司;UB-7型pH計 瑞士Mettler Toledo公司;WB-14恒溫水浴鍋 美國Memmert公司;Mini-PROTEAN蛋白質電泳裝置 美國Bio-Rad公司;759s紫外-可見分光光度計 上海棱光技術有限公司;FP-8200熒光分光光度計 日本Jasco公司;Phenom Pro掃描電子顯微鏡 荷蘭Phenom-World Pr公司;G∶BOX凝膠成像儀 英國Syngene公司。
1.3 方法
1.3.1 SMP的制備
無特殊說明,以下實驗均在4 ℃條件下進行。根據Shui Shanshan等的方法并適當修改,將新鮮的南美白對蝦用清水洗凈后,去頭、去殼,收集蝦肉。加入10 倍體積的緩沖液A(20 mmol/L Tris-HCl,0.1 mol/L NaCl,0.001 mol/L EDTA,pH 8.0)混合后組織搗碎,經8 000×離心15 min后收集沉淀部分。沉淀重新用10 倍體積相同的緩沖液A懸浮,并重復以上步驟3 次,最終所得沉淀即為SMP。將SMP重新復溶于緩沖液B(20 mmol/L Tris-HCl,0.5mol/L NaCl,pH 8.0),調節蛋白終質量濃度為30 mg/mL作為蛋白母液,貯存于4 ℃冰箱用于以下實驗。蛋白濃度測定采用Bradford法,并以牛血清白蛋白為標準。
1.3.2 SMP-KGM復合凝膠體系制備
參考Zhuang Xinbo等的方法并適當修改。配制12 mg/mL KGM,分別按SMP與KGM質量比50∶1、20∶1、10∶1配制SMP-KGM復合凝膠,且每組肌原纖維最終質量濃度均為20 mg/mL,攪拌均勻放在4 ℃以備用,各組分別命名為SK50、SK20和SK10。以未加KGM的SMP(20 mg/mL)為對照。
1.3.3 表面疏水性的測定
參照Shui Shanshan等的方法并適當修改。用緩沖液B將SMP-KGM復合體系稀釋至蛋白質量濃度為0.1 mg/mL。為考察加熱前后的表面疏水性變化,設置未加熱組與加熱組(90 ℃加熱30 min,迅速冰水冷卻備用)。2 mL樣品液加入20 μL 8 mmol/L ANS溶液混勻,避光反應10 min,測定熒光強度。測定條件:激發波長390 nm,發射波長470 nm,狹縫寬度10 nm。
1.3.4 內源性熒光的測定
參照Li Jinling等的方法,將SMP-KGM復合凝膠用緩沖液B稀釋至蛋白質量濃度為0.5 mg/mL,利用熒光分光光度計進行測試。測試所用激發波長為280 nm,發射波長為300~500 nm。
1.3.5 濁度及粒徑的測定
將SMP-KGM復合凝膠用緩沖液B稀釋至蛋白質量濃度為1 mg/mL,90 ℃加熱30 min后于冰水中冷卻,放在冰上備用。濁度測定參考An Yueqi等的方法,測定波長370 nm處SMP-KGM復合體系的紫外吸光度,蛋白吸光度表示濁度值。粒徑的測定參考Zhu Zongshuai等的方法,將1 mL樣品液裝載在可拋式比色皿中,控制測試環境溫度為25 ℃,檢測角為90 °。
1.3.6 流變學性質
穩態掃描參照Wu Fan等的方法,用移液槍吸取1.4 mL復合凝膠放在測量平臺上,移除超出夾具的多余樣品。參數如下:40 mm平行鋁板夾具,間距1 mm,剪切速率范圍0.1~100 s,記錄樣品的表觀黏度與剪切速率的關系。
動態流變學(溫度斜坡及頻率掃描)參照Sun Lechang等的方法,取1.4 mL樣品放在測量平臺上,移除超出夾具的多余樣品,用硅油將樣品進行密封,防止水分蒸發。溫度斜坡參數如下:40 mm平行鋁板夾具,間距1 mm,溫度范圍20~90 ℃,升溫速率2 ℃/min,振蕩頻率0.1 Hz,應變0.5%(線性黏彈區范圍內)進行測試。為考察加熱對樣品的影響,分別測定未加熱與90 ℃加熱30 min后樣品的頻率掃描曲線,參數如下:40 mm平行鋁板夾具,間距1 mm,振蕩頻率范圍0.01~10 Hz,應變0.5%(線性黏彈區范圍內)。
1.3.7 傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)分析
參考Chen Jinyu等的方法,樣品冷凍干燥過后研磨成粉末,以2 mg/100 mg(樣品/KBr)的比例與KBr混合并壓片,室溫條件下使用紅外光譜儀在4 000~400 cm的波數范圍內記錄樣品的FTIR。用KBr的紅外光譜作為背景。
1.3.8 SDS-聚丙烯酰胺凝膠電泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE)分析
取100 μL樣品(20 mg/mL)經90 ℃加熱30 min后形成熱凝膠,然后加入2 倍體積的溶解緩沖液C(20 mmol/L Tris-HCl pH 8.0,含8 mol/L尿素、1% SDS、2%-巰基乙醇),充分振蕩溶解后,進行SDS-PAGE分析。
1.3.9 掃描電鏡與分形維數分析
參考Laemmli的方法,將20 mg/mL的SMP-KGM復合凝膠在90 ℃中水浴加熱30 min,隨后用冰水立即冷卻。取少量樣品在含0.1 mol/L的磷酸鹽緩沖液(pH 7.3)的2.5%戊二醛中固定24 h,用0.1 mol/L的磷酸鹽緩沖液(pH 7.2)漂洗3 次(10 min/次),隨后分別用50%、60%、70%、80%、90%、100%乙醇溶液進行梯度脫水。將樣品取出,干燥48 h后進行鍍金即可用于電鏡觀察。
將電鏡圖形轉換成1 024×1 088像素的八位二進制圖像,使用ImageJ 1.53e(Wayne Rasband and Contributors National Institutes of Health, USA)并通過盒子計數進行分析。按下式計算分維()值:

式中:N為在給定標度下凝膠網絡中的盒子數;為相應的縮放比例。
評析: 試題以六個真實的學生認知活動情境為主線,以不同的動物呼吸系統或器官的結構及功能為切入點,針對呼吸器官結構的“是什么”、實驗現象的“為什么”和歸納總結的“怎么樣”三個層面進行考查。題干中已經明確了動物呼吸的本質的基礎上,從“為什么”層面對A草履蟲和B蚯蚓及E魚的呼吸過程分析,考查學生應用演繹推理解釋現象的能力。同時,對五類動物進行了呼吸的結構或器官結構與分類的雙重考查;再對動物呼吸的結構和功能進行概括和總結,歸納出結構與功能的關系和進化的規律。試題的綜合性充分體現了統一觀和進化觀的高度融合。
通過圖像分析的值是基于二維空間的。因此,有必要在值上增加一個額外的維度代表實際的蛋白質凝膠的三維(3D)結構。
1.4 數據統計分析

2 結果與分析
2.1 KGM對SMP表面疏水性的影響
蛋白的表面疏水性反應其表面疏水殘基的分布,可用來衡量蛋白質物理化學狀態的變化。如加熱前,隨著KGM添加量的增多,復合體系的表面疏水性呈現先增高后降低的趨勢(圖1A)。其中SK50、SK20組的表面疏水性增加,可能是由于在一定質量濃度下KGM分子能與蛋白的親水基團結合,使蛋白空間結構變得更為松散,由此暴露更多的疏水基團。而過量的KGM分子則會進一步包圍在蛋白表面,使本暴露在表面的疏水基團被掩蓋,導致疏水性降低。
進一步將樣品進行90 ℃加熱以促使體系凝膠化,結果表明SMP-KGM復合體系的表面疏水性隨著KGM添加量的增加而增加(圖1B)。這可能是因為融解態的KGM通過離子鍵、氫鍵與SMP相結合,有利于SMP在熱凝膠化過程中蛋白內部結構進一步展開,進而暴露出更多的疏水性氨基酸殘基。楊振也發現魔芋粉的添加能使鯉魚肌原纖維蛋白表面疏水性提高并伴有劑量依賴性。

圖1 KGM對SMP表面疏水性的影響Fig. 1 Effect of KGM on surface hydrophobicity of SMP
2.2 KGM對SMP內源性熒光的影響
如圖2所示,在280 nm的激發波長下,SMP的最大發射波長在333 nm處。與SMP相比,隨著KGM添加量增加,SMP-KGM復合體系的內源性熒光強度均出現不同程度的下降。熒光強度的減小與混合體系中生物聚合物的相互作用以及蛋白質分子環境對色氨酸的猝滅效應有關。其中,SK10組的內源熒光強度高于SK20組,與表面疏水性下降(圖1A)結果一致,這可能是由于過多KGM包圍在肌原纖維蛋白表面,使蛋白的空間結構進一步收緊,減少了色氨酸殘基的暴露。另外,多糖和蛋白之間的靜電相互作用也能為內源色氨酸殘基提供良好的疏水環境,進而避免了熒光猝滅現象發生。

圖2 KGM對SMP內源熒光的影響(25 ℃)Fig. 2 Effect of KGM on intrinsic fluorescence of SMP (25 ℃)
2.3 KGM對SMP濁度及粒徑的影響

圖3 KGM對SMP濁度(A)、PDI(B)、平均粒徑(C)及粒徑分布(D)的影響Fig. 3 Effect of KGM on turbidity (A), polydispersity index (B),average particle size (C) and particle size distribution (D) of SMP
蛋白溶液的濁度水平是評價蛋白聚集程度的主要指標之一,反映了蛋白液中懸浮粒子的大小及數量,濁度的增加表明形成了更多蛋白聚集體。如圖3A所示,隨著KGM添加量的增加,復合體系的濁度值也逐漸增大。與對照組相比,SK20、SK10組的濁度值顯著增大(<0.05),這表明體系中形成了更多的蛋白質聚合物。結合表面疏水性(圖1B)測定結果,推測KGM的加入使更多SMP-KGM復合體系疏水基團的暴露,蛋白分子內部結構相對開放,更有利于KGM和蛋白結合進而形成更大的聚合物。
為了進一步了解SMP與KGM在加熱過程中的相互作用,對其粒徑分布變化進行分析,如圖3所示。隨著KGM比例的增多,SMP-KGM復合體系的聚合物分散性指數(polymer dispersity index,PDI)逐漸增大。SMP、SK50、SK20、SK10平均粒徑分別為277.75、279.15、284.45、289.36 nm,粒徑主要分布在100~1 000 nm,并在1 000~10 000 nm之間形成了少量的大分子聚體。PDI越小,說明蛋白質溶液粒徑分布范圍越小且分散性越好,該結果也表明了KGM的加入減小了SMP-KGM復合凝膠體系的分散性,更容易形成聚合體。另一方面,SMP-KGM復合體系復合凝膠的平均粒徑隨著KGM添加量的增大逐漸增大且粒徑分布逐漸右移,這與濁度的結果(圖3A)相吻合。以上結果表明,KGM與SMP在復合體系中存在相互作用,適量KGM的加入能促進SMP的熱聚集。
2.4 KGM對SMP流變學性質的影響
為了進一步探究復合體系的膠凝化過程,研究了溫度對復合凝膠儲能模量(’)的影響。如圖4B所示,所有組的’變化曲線基本一致,表明KGM與SMP之間沒有發生交聯。與魚肌原纖維相比,SMP在35 ℃和50 ℃出現了2個波谷,這可能與SMP中存在副肌球蛋白有關。此外,SMP在35~42 ℃出現明顯上升趨勢,并在42 ℃達到最大,這可能是由于肌球蛋白頭部相互作用形成聚體,初步形成了早期的凝膠結構。而當溫度高于42 ℃時,’值出現了明顯的下降趨勢,這可能與輕鏈肌球蛋白的熱變性以及肌球蛋白復合物的解離相關。與SMP組相比,SMP-KGM復合體系組在42 ℃左右的’峰值相對較低,而后’繼續上升,造成了此階段“雙峰”的形成。這可能是由于KGM分子在熱凝膠的過程中吸水溶脹,導致結構發生變化。同時,肌球蛋白尾部的螺旋被打開,解開的蛋白質又再次聚集、交聯,KGM與SMP相互作用,進而導致’再次上升。隨著溫度的進一步升高(55~70 ℃)中’又急劇上升,到70 ℃左右’趨于平穩,這可能是重鏈肌球蛋白的締合與交聯,形成了較穩定的三維網絡結構。加熱至90 ℃時,SMP對應的’為317.96 Pa,而不同添加量的KGM-SMP存在顯著差異,其中SK20的’值最高,約為SMP組的2 倍,而SK50的’值最低。這可能是由于一定量的KGM會在MF凝膠結構中起到“填充”作用,進而表現出凝膠增強作用。而KGM添加量較多時,KGM會自身凝膠化進而與MF形成混合凝膠,對復合體系的凝膠具有消極作用。另一方面,SK50組凝膠化低于對照組,推測可能是由于少量的KGM雖能結合在SMP的親水基團,但形成的凝膠體系并不穩定,在加熱凝膠化過程中KGM的熱融化作用反而阻礙了蛋白的交聯與凝膠網絡結構的形成。Jian Wenjie等發現不同添加量的天然KGM(0.5%、1.0%、1.5%)反而抑制羅非魚MF(7 mg/mL)的凝膠形成,推測其可能是由于大分子質量的天然KGM與MF發生了錯配,進而影響了復合體系的凝膠化。而Iglesias-Otero等卻發現加入1%的天然KGM對魷魚魚糜凝膠具有較好的提升效果。由此可見,本實驗中KGM對SMP凝膠化的影響可能還與對蝦肌原纖維自身蛋白組成與物種不同有關。
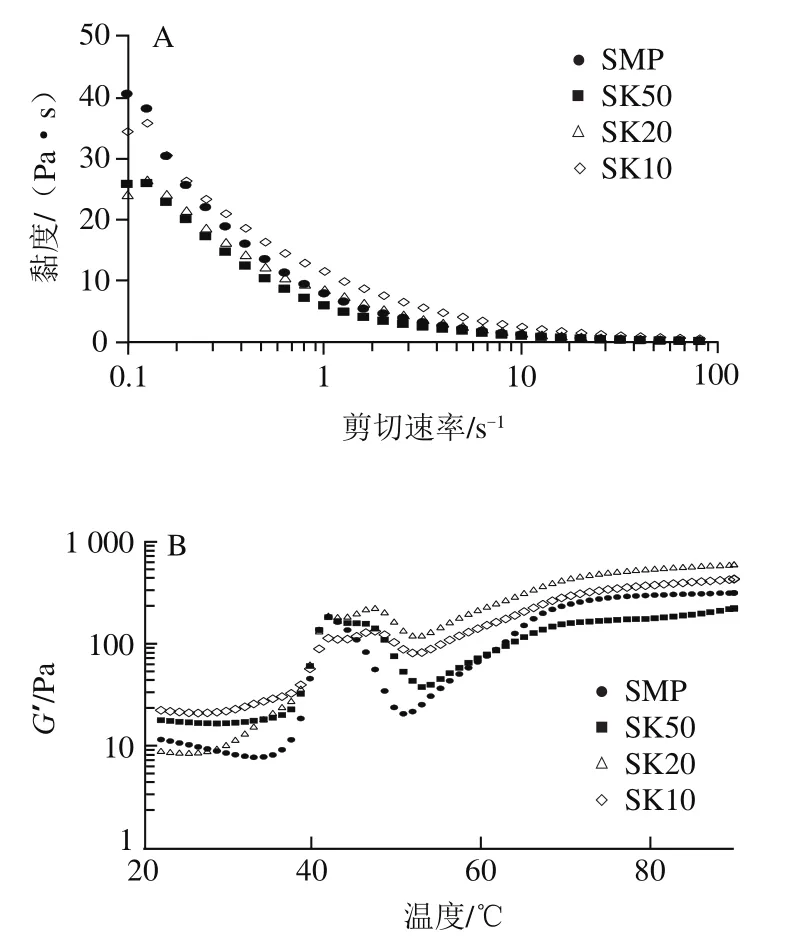
圖4SMP-KGM復合凝膠的穩態掃描(A)和溫度斜坡(B)曲線Fig. 4 Steady state scan (A) and temperature slope (B) curves of SMP-KGM
添加KGM促進SMP的熱聚集,進而影響SMP-KGM復合凝膠結構穩定程度。如圖5所示,在相同振動頻率條件下,無論加熱前后SMP及SMP-KGM復合體系所有組的’均大于″,表現出彈性行為特征,表明形成了較為穩定的網狀結構。加熱前樣品的’與″隨著KGM添加量的增加逐漸增加(圖5A、B),表現出明顯的劑量依賴性,這可能與KGM本身的流變學特性有關。相比之下,90 ℃加熱后(圖5C、D),樣品的’與″隨著KGM添加量的增加呈現先增加后下降的趨勢,其中SK20的’值最大,與溫度斜坡結果一致(圖4B),這說明經過加熱后SK20組形成的凝膠彈性最好。SK10的’值有所下降,推測可能是由于過量的KGM自身形成了連續網絡結構,進而阻礙了SPM蛋白凝膠網絡的形成。

圖5 SMP-KGM復合凝膠頻率掃描曲線Fig. 5 Frequency scan curves of SMP-KGM
2.5 FTIR分析
復合凝膠體系中碳水化合物和蛋白質通過紅外光譜分析能檢測到各自不同的光譜學特征。其中,蛋白質的光譜特征分別位于1 650 cm和1 540 cm附近的強酰胺I帶和酰胺II帶。碳水化合物在1 180~953 cm范圍間則有一系列不同振動模式重疊峰,如C—C、C—O拉伸,以及C—H鍵的彎曲模式。另外,3 500~3 000 cm處酰胺A吸收帶為N—H或O—H伸縮振動峰,2 925 cm附近處酰胺B吸收帶為—CH伸縮振動峰。
如圖6所示,SMP及SMP-KGM復合體系所形成的凝膠沒有出現新的吸收收峰,表明復合凝膠中無新化學基團產生。隨著KGM添加量的增多,SK50、SK20組酰胺A(—OH)峰的位移沒有發生明顯變化,吸收峰的強度呈現先增大后減小的趨勢,這表明SMP與KGM之間可能存在氫鍵的作用。同時,SK10組酰胺A帶有輕微藍移,表明蛋白質分子與水分子之間的氫鍵作用逐漸減弱。肖雄在研究KGM對肌球蛋白的影響中也發現,當KGM添加量達到0.46%和0.6%時峰值向高波數移動。這可能是由于KGM分子自身含有豐富的羥基,過多的KGM分子可能與蛋白質競爭凝膠體系中的水分子,進而影響了蛋白質分子間作用力。

圖6 肌原纖維蛋白-KGM復合物FTIR圖Fig. 6 FT-IR spectra of SMP-KGM
2.6 SDS-PAGE分析
為深入了解KGM與SMP在凝膠中的相互作用,對復合凝膠中SMP進行了電泳分析,如圖7所示。SMP主要蛋白組成有:肌球蛋白重鏈(myosin heavy chain,MHC)、副肌球蛋白(paramyosin,PM)、肌動蛋白(actin,AC)、原肌球蛋白(tropomyosin,TM)與肌球蛋白輕鏈(myosin light chain,MLC)。KGM的加入并沒有引起各組分蛋白條帶的明顯變化,這與FT-IR(圖6)結論一致,說明復合凝膠中并沒有產生新的基團。于加美在研究不同脫乙酰度KGM對鰱魚糜凝膠中蛋白組分的影響時也發現了類似現象,推測不同脫乙酰度KGM與魚糜蛋白之間并沒有發生化學反應,這與本研究的結果類似。相較于未加熱組,加熱后樣品中MHC、PM以及AC的條帶明顯減弱,這說明了加熱能促使MHC與PM、AC發生熱聚合反應。這與動態流變學(圖4B)結果一致,表明PM在加熱過程中參與了SMP的凝膠化。

圖7SMP-KGM SDS-PAGE分析Fig. 7 SDS-PAGE analysis of SMP-KGM
2.7 掃描電鏡與分形維數分析
如圖8A~D所示,SMP蛋白凝膠的結構比較松散,孔洞較多并且大小不均一。隨著KGM的增加,SMP-KGM復合體系結構變得更加致密有序,表面相對也變得更光滑,推測是由于KGM促進SMP中各蛋白組分的熱聚集,進而形成更致密的凝膠網絡。此外,由于KGM具有較強的水結合能力,在熱凝膠過程KGM部分支鏈與水分子共同填充到凝膠網孔也可能會是凝膠顯得更加致密。
掃描電鏡能可視化和直觀看出復合凝膠的結構變化,但是仍然需要使用可靠的方法進行定量描述。分形維數()是評價凝膠微觀結構變化以及蛋白質聚集體復雜程度的常用指標,分形維數越大表明了凝膠結構更復雜性且更有序。如圖8A~D所示,根據盒計數法計算斜率值如圖8A~D所示,由此可以計算出SMP、SK50、SK20、SK10相應的值分別為2.866 4、2.863 8、2.869 3、2.879 0,這與鳙魚肌球蛋白的值類似。隨著KGM添加量的增加,從2.866 4增加到了2.879 0,這進一步說明了KGM-SMP復合體系形成了更復雜且有序的微觀結構。其中SK50組的值略低于對照組,這與本研究中的動態流變學(圖4B)結果一致。



圖8SMP-KGM微觀結構和分形維數分析Fig. 8 Microstructures and fractal dimension analysis of SMP-KGM
3 結 論
分析不同KGM添加量對KGM-SMP凝膠的影響。結果表明KGM能不同程度地增加SMP的表面疏水性、濁度與粒徑。不同KGM添加對SMP理化性質與凝膠特性的影響存在顯著差異。一定濃度的KGM能與SMP發生相互作用,顯著提升SMP的凝膠特性,但過低與過高濃度則會阻礙SMP凝膠網絡形成。研究還發現,有別于魚類,KGM與PM的相互作用對SMP的凝膠化可能也存在重要影響。此外,作為一種優質的膳食纖維,KGM的添加是否對蝦糜凝膠類制品的消化性產生影響也有待進一步闡明。本研究結果可為KGM在蝦糜中的應用提供一定理論參考。

