大豆分離蛋白與染料木素共價交聯對蛋白表征和結構的影響
呂思瑤,朱登兆,鮑云翔,張德斌,于寒松,2,谷春梅,*
(1.吉林農業大學食品科學與工程學院,吉林 長春 130118;2.吉林農業大學 國家大豆產業技術體系加工研究室,吉林 長春 130118)
大豆作為世界上應用最多的豆類之一,與其他豆類相比,有價格低、營養價值高、來源廣等優點。大豆異黃酮(soy isoflavone,SIF)是一種多酚類化合物,是大豆生長中形成的一類次級代謝產物,是從大豆中提取的一種活性物質。SIF具有抗氧化、抗腫瘤、維持動物正常生殖機能、預防甚至治療骨質疏松癥、更年期綜合癥、前列腺癌等功效。染料木素(genistein,Ge)是一種苷元型的SIF單體,可直接被人體消化吸收,具有植物雌激素的活性。大豆分離蛋白(soy protein isolate,SPI)是將豆粕粉中的可溶性及不可溶性碳水化合物、灰分等去除后得到的一種全價蛋白,其中蛋白質含量占90%以上。SPI含有9種必需氨基酸并且其含量能滿足人體對植物蛋白的需求,是一種可以代替動物蛋白的植物高蛋白產品,也是一種營養價值豐富的蛋白資源。
由于多酚類物質是小分子化合物,與蛋白質結合時有一種天然的親和力,會形成一種共價化合物,這種共價交聯通常發生在堿性、氧化酶、高溫和自由基的條件下。多酚與蛋白的共價結合是穩定且不可逆的,它不僅會對蛋白的表征特性造成影響,還會改變蛋白的結構。研究表明,單寧酸與大豆蛋白、綠原酸與向日葵蛋白分離物質在堿性條件下能夠生成共價鍵;咖啡提取物與牛奶蛋白在高溫(90 ℃)條件下也會產生共價鍵;兒茶素與明膠在多酚氧化酶(漆酶)的作用下能夠產生共價復合物。此外,賈娜等研究表明沒食子酸與肌原纖維蛋白在自由基氧化的條件下可以發生交聯作用,交聯后對蛋白的二級結構產生影響。
目前對SPI與SIF共價復合物的基礎特性還不清楚。因此,本實驗以SPI和Ge為研究對象,在堿性條件下制備SPI-Ge共價復合物,對其表征特性進行探究,并通過紫外吸收光譜、熒光光譜、傅里葉變換紅外光譜法3種光譜學方法研究蛋白的結構特性。這不僅能拓寬SPI食品的研發領域,還可以為SPI-Ge共價復合物在食品中的應用提供創新思路和一定理論依據。
1 材料與方法
1.1 材料與試劑
脫脂豆粕 山東禹王生態食業有限公司;Ge 上海源葉生物科技有限公司;5,5’-二硫雙-2-硝基苯甲酸美侖生物技術有限公司;8-苯胺基-1-萘磺酸鎂(II)鹽水合物(8-anilino-1-naphthalenesulfonic acid magnesium salt,ANS) 阿拉丁生物科技有限公司;溴化鉀 麥克林生物科技有限公司;實驗所用分析試劑均為分析純。
1.2 儀器與設備
FD-1C型冷凍干燥機 北京德天佑科技發展有限公司;LGR20-W型臺式高速冷凍離心機 北京京立離心機有限公司;KPB-V1358攪拌機 深圳市康佳電器有限公司;BT-9300HT型激光粒度分布儀 丹東市百特儀器有限公司;Zetasizer Nano ZS90電位分析儀 英國馬爾文儀器有限公司;F-280型熒光分光光度計 天津港東公司;MAGNA-IR560傅里葉變換紅外光譜儀 天津恒創立達科技發展有限公司;FE-28 pH計 梅特勒-托利多(上海)儀器有限公司;T6紫外-可見分光光度計 北京普析通用儀器有限責任公司。
1.3 方法
1.3.1 SPI的制備
參考Keppler等的方法并稍作修改。用去離子水將低溫脫脂豆粕粉配成質量濃度為0.05 g/mL的溶液,用1 mol/L NaOH溶液調pH值至8.5,在室溫下充分攪拌3 h后,將溶液9 000×離心20 min,取上清液。將上清液用1 mol/L HCl溶液調pH值至4.5,靜置3 h。將靜置后的溶液8 000×離心30 min,得到蛋白沉淀。將蛋白沉淀水洗3 次后加入去離子水中,使蛋白沉淀充分溶解,并用1 mol/L NaOH溶液調pH值至7.0。溶液經過真空冷凍干燥后得到SPI粉末(純度91%),貯存備用。
1.3.2 SPI-Ge共價復合物的制備
參考Kroll等的方法并稍作修改。用磷酸鹽緩沖溶液(phosphate buffered saline,PBS)(pH 7.0、10 mmol/L)溶解SPI粉末,使SPI質量濃度為60 mg/mL。加入疊氮鈉抑制細菌的生長并使其質量濃度為0.2 mg/mL,充分攪拌4 h后放入4 ℃冰箱中過夜使溶液充分水合。將不同質量濃度(0、1.2、1.5、2.0 mg/mL)的Ge與SPI等體積混合,并用0.5 mol/L NaOH溶液調pH值至9.0,室溫下充分與氧氣接觸攪拌24 h,然后轉移至透析袋(截留分子質量8~10 kDa)內透析48 h后,進行冷凍干燥,得到SPI-Ge共價復合物,分別標記為SPI、SPI-Ge-1.2、SPI-Ge-1.5、SPI-Ge-2.0。
1.3.3 粒徑分布的測定
使用激光粒度分布儀測定溶液的粒徑,為防止粒子濃度過高引起的多種散射效應,在加樣之前用PBS(pH 7.0、10 mmol/L)稀釋100 倍進行測定,測定溫度為25 ℃,每個樣品做3 次。
1.3.4 Zeta電位的測定
使用Zeta電位儀測定。將樣品注入Zeta電位儀之前用PBS(pH 7.0、10 mmol/L)稀釋1 000 倍進行測定,測定溫度為25 ℃,每個樣品做3 次。
1.3.5 濁度的測定
參考Gao Hao等的方法,將樣品用PBS(pH 7.0、10 mmol/L)稀釋至質量濃度為3 mg/mL后放入石英比色皿中,使用紫外分光光度計在600 nm波長處測定吸光度,測定溫度為25 ℃,每個樣品做3 次。
1.3.6 表面疏水性()的測定
參考Kato等方法稍作修改。使用熒光探針ANS測定蛋白質的表面疏水性。將SPI-Ge共價復合物溶液用PBS(pH 7.0、10 mmol/L)稀釋,使質量濃度達到0.2~1 mg/mL;同時使用相同的PBS(pH 7.0、10 mmol/L)配制ANS儲備液(8.0 mmol/L)。將ANS溶液與各稀釋樣品按1∶100進行混合搖勻,避光反應20 min,使用熒光光度計在激發波長355 nm、發射波長460 nm、狹縫寬度5 nm下測量熒光強度。以熒光強度為縱坐標、蛋白質質量濃度(mg/mL)為橫坐標作圖,表面疏水性為曲線初始斜率。
1.3.7 總巰基含量的測定
根據Lü Tong等的方法稍作改動。在0.5 mL樣品溶液中加入2.5 mL含有8 mol/L尿素的Tris-甘氨酸緩沖液(十二烷基硫酸鈉1 g/100 mL、甘氨酸9.4 g/100 mL、Tris1.51 g/100 mL)和0.02 mL含有4 mg/mL 5,5’-二硫雙-2-硝基苯甲酸的Tris-甘氨酸緩沖液,將其置于室溫下反應25 min。利用紫外分光光度計在波長412 nm處測定吸光度。以Tris-甘氨酸緩沖溶液作空白,根據下式計算蛋白的總巰基含量:

式中:為吸光度;為稀釋倍數;為樣品質量濃度/(mg/mL);73.53=10/(1.36×10),1.36×10為摩爾吸光系數。
1.3.8 紫外吸收光譜分析
參考Cheng Jing等的方法稍作改動。將共價復合物溶液用PBS(pH 7.0、10 mmol/L)稀釋,使蛋白質量濃度達到0.3 mg/mL。測定溶液在波長200~400 nm、分辨率0.5 nm、掃描速率50 nm/min時的紫外吸收光譜,重復掃描3 次,記錄平均值。經Origin 8.5軟件分析得到紫外吸收曲線。
1.3.9 熒光光譜測定
參考Arroyo-Maya等方法對樣品進行內源熒光分光光度計檢測。將共價復合物溶液用PBS(pH 7.0、10 mmol/L)稀釋,使蛋白質量濃度達到0.3 mg/mL。記錄波長300~500 nm的發射光譜,激發波長為280 nm,激發和發射狹縫寬度均為5 nm,激發電壓為400 V,掃描速度為1 200 nm/min。
1.3.10 傅里葉變換紅外光譜分析
采用溴化鉀壓片法測定樣品的紅外光譜。將共價復合物經真空冷凍干燥后研磨成粉狀,與提前烘干的溴化鉀以1∶100比例進行混合,在紅外燈的照射下用瑪瑙煙波將粉末混勻,并進行壓片。掃描條件設置如下:光譜范圍4 000~500 cm,掃描次數32 次,分辨率為4 cm。
1.4 數據統計
所有實驗至少做3 次,利用SPSS 22.0軟件進行差異顯著性分析。<0.05,差異顯著。采用Origin 8.5軟件進行圖形繪制。利用PeakFit 4.12軟件進行紅外光譜的擬合處理。
2 結果與分析
2.1 SPI-Ge共價復合物的表征分析
2.1.1 SPI-Ge共價復合物的粒徑變化
溶液的粒徑能夠直接反映出溶液的穩定性,因此本實驗對在堿性條件下制備出的不同質量濃度的Ge與SPI共價交聯復合物的粒徑進行探究。如圖1所示,粒徑分布主要成單峰,表明所形成的溶液體系較穩定,其中對照組與實驗組的中位徑(值)基本都在90~160 μm之間,而且還可以看出SPI-Ge共價復合物的粒徑分布范圍相比于對照組都有所減小。其中對照組與實驗組的值從大到小依次為SPI組(135.6 μm)>SPI-Ge-2.0組(117.6 μm)>SPI-Ge-1.5組(108.9 μm)>SPI-Ge-1.2組(98.0 μm)。由此可以看出,與對照組相比,實驗組的中位徑顯著減小(<0.05),并且隨著Ge質量濃度的增加共價復合物粒徑逐漸增大,其中SPI-Ge-1.2組的粒徑最小,穩定性最強。這可能是因為在共價作用下,Ge與SPI通過共價鍵結合在一起,使結構更加穩定,所以使共價復合物的粒徑減小。Li Ting等研究發現,在大米蛋白中加入花青素后,大米蛋白與花青素的復合物粒徑減小,這與本實驗研究結果相似。

圖1SPI-Ge共價復合物的粒徑分布Fig. 1 Particle size distribution of covalent complexes of SPI with genistein
2.1.2 SPI-Ge共價復合物的Zeta電位變化
Zeta電位絕對值越小,粒子之間的相互斥力就越小,易形成較大顆粒;Zeta電位絕對值越大,粒子之間的相互斥力越大,易形成較小顆粒。如圖2所示,對照組的Zeta電位絕對值最小,為15.0 mV;共價復合物溶液與對照組相比,Zeta電位的絕對值顯著增大(<0.05),說明在堿性條件下Ge與SPI共價交聯后能夠使蛋白的Zeta電位絕對值增大,結構更加穩定。此外,從圖2還可以看出,隨著SIF質量濃度的增加共價復合物溶液的電位絕對值減小,低質量濃度組(SPI-Ge-1.2)的Zeta電位絕對值最大(21.4 mV),高質量濃度組(SPI-Ge-2.0)的Zeta電位絕對值最小(17.1 mV)。這可能是由于Ge質量濃度較高時,它與蛋白之間共價交聯后產生的相互斥力減弱,SPI結合更少帶負電荷的Ge,導致形成的共價復合物所帶的負電荷減少。花春陽等研究酪蛋白與香芹酚相互作用時,發現加入質量濃度為15 mg/mL的香芹酚相對于加入低質量濃度(3、6、9、12 mg/mL)香芹酚后所形成的納米顆粒所帶負電荷減少,這與本實驗研究的結果相似。

圖2SPI-Ge共價復合物的Zeta電位Fig. 2 Zeta potential of covalent complexes of SPI with genistein
2.1.3 SPI-Ge共價復合物的濁度的變化
復合物溶液的濁度變化可以反映溶液分散與聚集的程度,并且濁度與溶液顏色和粒子的粒徑有關。將不同質量濃度SPI-Ge共價復合物溶液稀釋至3 mg/mL后對濁度變化進行探究,結果如圖3所示。可以看出,對照組的濁度顯著低于共價復合物組(<0.05),這是因為在堿性條件下多酚與蛋白發生共價交聯會使酚類物質氧化成棕色的醌類物質,所以堿性條件形成的共價復合物的濁度大于對照組。此外,實驗組中隨著Ge質量濃度的增加,共價復合物溶液的濁度增加,說明在實驗組中,SPI-Ge-1.2組更加穩定,這與粒徑結果一致。孫紅波等研究發現花青素與SPI在堿性條件下形成共價復合物后溶液濁度也隨之增加,與本實驗結果類似。
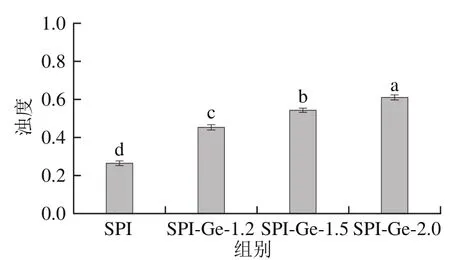
圖3SPI-Ge共價復合物的濁度Fig. 3 Turbidity of covalent complexes of SPI with genistein
2.1.4 SPI-Ge共價復合物的表面疏水性的變化
是影響其表面相關功能的重要指標,能夠衡量蛋白分子表面疏水基團數目,同時也影響著分子間相互作用,其與蛋白質的結構變化和功能特性密切相關。使用ANS作為熒光探針探測SPI與Ge共價復合物的表面疏水性的變化。如圖4所示,與對照組相比,共價復合物的表面疏水性顯著降低(<0.05)。由此可以看出Ge與SPI共價交聯后能夠使SPI的表面疏水性減小,這可能是由于Ge與SPI的共價相互作用使蛋白結構發生改變,將內部的親水區域暴露出來,復合物的表面疏水性降低,從而使SPI表面的疏水性向親水的結構改變。從圖4還可知,隨著Ge質量濃度的增加,表面疏水性增加,當質量濃度為1.2 mg/mL時表面疏水性最小。Ali等在研究-乳球蛋白和咖啡酸共價相互作用時,發現咖啡酸與-乳球蛋白共價交聯后能夠減小-乳球蛋白表面的疏水性,并且Cao Yungang等研究發現高濃度的綠原酸處理豬肌原纖維蛋白后蛋白表面疏水性增大,上述研究結果與本實驗相似。

圖4SPI-Ge共價復合物的表面疏水性Fig. 4 Surface hydrophobicity of covalent complexes of SPI with genistein
2.2 SPI-Ge共價復合物的結構變化
2.2.1 SPI-Ge共價復合物的總巰基的變化
從圖5可知,與對照組相比,SPI與Ge在堿性條件下共價交聯后總巰基含量顯著下降(<0.05)。一方面,這可能是由于與蛋白質發生共價作用時,Ge羥基基團與SPI巰基基團發生結合,從而使巰基含量減少;另一方面,當發生共價交聯時,Ge的羥基能夠氧化成醌,然后與SPI上的巰基發生交聯形成巰基-醌的加成物,也使巰基含量減少。此外,從圖5還發現,隨著Ge質量濃度的增大,總巰基含量顯著增加(<0.05),這可能是由于SPI與Ge過度交聯,Ge與SPI共價作用減弱,導致總巰基含量隨之增加。賈娜等研究發現沒食子酸與肌肉纖維蛋白共價交聯后,肌肉纖維蛋白的總巰基含量明顯減少,并且隨著沒食子酸的濃度增大總巰基含量增加,這與本實驗研究結果類似。

圖5SPI-Ge共價復合物的總巰基含量Fig. 5 Total sulfhydryl contents of covalent complexes of SPI with genistein
2.2.2 SPI與Ge共價作用的紫外吸收光譜分析
在研究蛋白質與多酚相互作用時,紫外可見吸收光譜是最常用的方法。由于蛋白質中的一些氨基酸殘基具有紫外吸收性質,如色氨酸、酪氨酸、苯丙氨酸和含硫氨基酸,它們在230~310 nm波長范圍內具有吸收峰,因此可以通過對比吸收峰位移以及吸光度變化判斷蛋白質與多酚是否發生了相互作用。
從圖6可以看出,對照組與實驗組均在波長290 nm左右處出現峰值,并且在加入Ge后,共價復合物的峰值明顯升高。與此同時,與對照組相比,實驗組SPI-Ge-1.2的吸收峰波長由290 nm藍移到285 nm。共價復合物的吸光度升高可能是因為SPI與Ge的共價交聯導致蛋白質發生解折疊,色氨酸與酪氨酸殘基暴露,微環境的疏水性降低,蛋白質解折疊使更多的發色基團轉移到蛋白質的表面。研究還發現隨著Ge質量濃度的增加,共價復合物的紫外吸收光譜峰值逐漸降低。上述結果表明Ge的加入對SPI結構產生了影響,二者的共價作用生成了新的SPI-Ge共價復合物,并且低質量濃度的Ge與SPI相互作用更強。

圖6SPI-Ge共價復合物的紫外吸收光譜圖Fig. 6 UV absorption spectra of covalent complexes of SPI with genistein
2.2.3 SPI與Ge共價作用對蛋白內源性熒光光譜的影響
SPI中存在色氨酸、酪氨酸和苯丙氨酸等殘基,這些殘基含有的苯環結構或共軛雙鍵使其在一定波長下發射熒光。一般當激發波長為280 nm時,蛋白質分子中苯丙氨酸殘基的熒光極弱且易被猝滅,所以可以只探究色氨酸與酪氨酸殘基的變化。色氨酸與酪氨酸分別在波長348、303 nm左右處出現峰。如圖7所示,在發射光譜掃描范圍波長300~500 nm、激發波長280 nm、溫度25 ℃的條件下,蛋白質的最大發射波長為337 nm,并在303 nm左右未出現峰值,所以本實驗主要探究色氨酸的變化。從圖7可以看出,與對照組相比,加入Ge后SPI的熒光強度降低,隨著Ge質量濃度的增加SPI的熒光強度逐漸升高,并且共價復合物的最大發射波長發生1 nm的紅移,說明共價復合物的結構發生改變。這可能是由于Ge與SPI在堿性條件下發生了共價結合,使蛋白的色氨酸基團被掩蓋,降低了色氨酸含量,從而使蛋白質的微環境親水性增加。Pan Xin等研究發現大米蛋白和綠原酸共價作用后,其最大發射波長也發生了紅移。因此,Ge與SPI共價相互作用對SPI的內源熒光產生了猝滅作用,同時低質量濃度Ge對蛋白的猝滅效果更好。
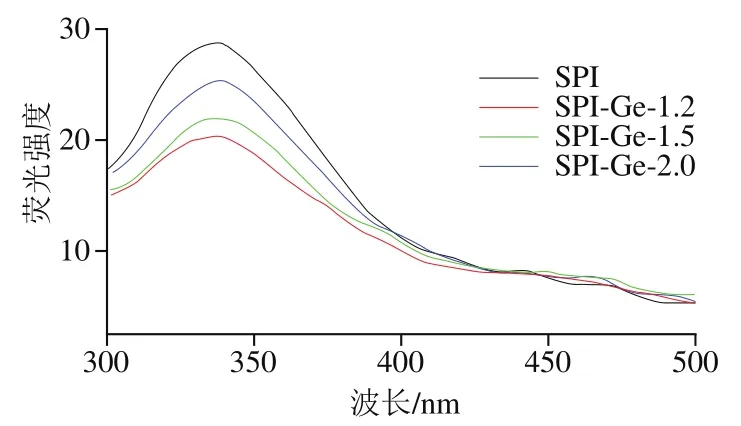
圖7SPI-Ge共價復合物的熒光光譜圖Fig. 7 Fluorescence spectra of covalent complexes of SPI with genistein
2.2.4 SPI與Ge共價作用的傅里葉變換紅外光譜分析
將不同質量濃度的SPI-Ge共價復合物凍干壓片后得到的紅外光譜圖,見圖8。蛋白紅外光譜中的酰胺I帶(1 600~1 700 cm)由C=O伸縮振動引起,主要伴隨蛋白質二級結構的改變。Ji Hui等研究表明,在酰胺I帶中,蛋白質二級結構與峰值的對應關系為:波數1 650~1 658 cm對應-螺旋;1 610~1 640 cm對應-折疊;1 660~1 700 cm對應-轉角;1 640~1 650 cm對應無規卷曲。從圖8可以看出,與對照組相比,加入Ge后,酰胺I帶的峰值發生波數由1 643 cm至1 650 cm的藍移,表明Ge與SPI發生了相互作用,并且形成的新的共價復合物改變了SPI的二級結構。

圖8 SPI與Ge共價復合物的紅外光譜圖Fig. 8 Infrared spectra of covalent complexes of SPI with genistein
將得到的不同質量濃度Ge與SPI共價作用后的紅外光譜圖進一步分析,對酰胺I帶(1 600~1 700 cm)進行擬合,通過對峰面積定量計算得出了各個二級結構的含量,如表1所示。與對照組相比,加入Ge后的共價復合物中-螺旋含量增多、-折疊含量減少、-轉角含量增多、無規卷曲含量減少。此外,還發現隨著Ge質量濃度的降低,蛋白質二級結構中-螺旋含量增多、-折疊含量減少、-轉角含量增多、無規卷曲含量減少。因此說明Ge與SPI共價交聯會對SPI的二級結構造成影響,另外低質量濃度的Ge對蛋白質結構影響更加明顯,Ge質量濃度過高時會對蛋白質的結構影響減弱。賈娜等研究發現沒食子酸與肌肉纖維蛋白共價作用也會使蛋白的-螺旋、-折疊、-轉角、無規卷曲的含量改變,并且添加沒食子酸含量為10 μmol/g對蛋白結構的影響強于50、100 μmol/g,這與本實驗的研究結果相似。

表1SPI-Ge共價復合物二級結構相對含量Table 1 Relative contents of secondary structures in covalent complexes of SPI with genistein
3 結 論
將SPI與Ge在堿性(pH 9.0)條件下得到的共價復合物進行表征和結構分析,發現加入Ge后蛋白的粒徑分別減小了37.6、26.7、18.0 μm,Zeta電位絕對值分別增大了6.4、3.8、2.1 mV,表面疏水性分別減小了100.5、87.5、80,總巰基含量分別減少11.1、8.3、5.8 μmol/g,這說明低質量濃度Ge的引入對蛋白質的影響更加明顯。同時添加Ge后共價復合物的濁度都有著不同程度的增加,說明堿性條件下SPI與Ge發生了共價作用。在對SPI-Ge共價復合物的紫外吸收光譜與熒光光譜分析中,發現二者發生共價相互作用后使蛋白質的色氨酸與酪氨酸殘基所處的微環境疏水性減少,并且Ge對SPI有猝滅的效果,低質量濃度Ge猝滅效果更好。紅外光譜分析表明SPI與Ge形成共價復合物后蛋白的-螺旋含量增多、-折疊含量減少、-轉角含量增多、無規卷曲含量減少,導致了二級結構的相互轉化。與對照組相比,Ge質量濃度越高,對蛋白質的二級結構作用效果越弱。本實驗從研究SPI與Ge之間的共價作用出發,探究二者形成的新型共價復合物的表征特征以及對蛋白結構的影響,為蛋白質與多酚在食品保健以及大豆食品的研發提供了更多的可能性。

