臭鱖魚源清酒乳桿菌的分離鑒定及其在臭鱖魚發酵中的應用
周迎芹,孫子怡,黃晶晶,鄢 嫣,鄭海波,謝寧寧,*
(1.安徽省農業科學院農產品加工研究所,安徽 合肥 230031;2.安徽省食品微生物發酵與功能應用工程實驗室,安徽 合肥 230031;3.安徽科技學院食品工程學院, 安徽 滁州 239000)
臭鱖魚又稱腌鮮鱖,是利用新鮮鱖魚為原料,配以食鹽、花椒等輔料,由乳酸菌等多種微生物共同發酵制得的發酵魚制品。傳統自然發酵使臭鱖魚在加熱熟化后,具有豐富的營養價值和細膩嫩滑的蒜瓣狀肉質以及聞臭吃香的獨特風味,市場接受度高,產業需求大。但在傳統自然發酵條件下,臭鱖魚發酵周期相對較長,生產效率低;人工操作過程較為模糊,加工環境控制不嚴,產品質量變化大,風味品質參差不齊,食用安全性存在潛在風險,使其標準化、工業化生產受到嚴重阻礙。
微生物接種發酵技術是縮短發酵時間和改善產品品質的有效途徑之一。微生物發酵菌種主要來源于傳統自然發酵制品,包括乳酸菌、葡萄球菌、微球菌、酵母菌和霉菌等。在傳統自然發酵臭鱖魚中,乳酸菌是其發酵的優勢微生物菌群。Dai Zhiyuan等和李燕通過傳統微生物分離培養技術,系統研究了臭鱖魚在發酵過程中的微生物菌群組成,分離得到的乳酸菌主要為清酒乳桿菌()、乳酸乳球菌()、格氏乳球菌()等,在發酵中后期,清酒乳桿菌成為臭鱖魚中特定的優勢乳酸菌。本實驗室前期在對臭鱖魚不同發酵工藝微生物菌群組成解析時發現,清酒乳桿菌也是臭鱖魚在傳統干腌、濕腌工藝中的優勢乳酸菌菌群。但目前,在對臭鱖魚乳酸菌資源的開發利用研究中,鮮見有關清酒乳桿菌在臭鱖魚中的應用研究報道。基于此,本研究以自然發酵臭鱖魚為分離基質,對其中的優勢乳酸菌——清酒乳桿菌進行分離、鑒定,研究其生物學特性,并結合黃山臭鱖魚制作工藝,采用清酒乳桿菌接種發酵臭鱖魚,研究菌株對臭鱖魚發酵過程中特征蒜瓣的變化以及對質構、色澤和揮發性風味物質的影響,以期為臭鱖魚發酵基礎研究和工業化生產提供參考依據。
1 材料與方法
1.1 材料與試劑
1.1.1 樣品
臭鱖魚:采集于黃山臭鱖魚加工企業,為傳統低溫濕法腌制發酵16 d的成品。
鱖魚():購于東至縣大聯圩有限公司,品種為秋浦花鱖,規格為0.5~0.6 kg/尾。
1.1.2 培養基
MRS液體培養基(1 L):胰蛋白胨10 g、牛肉膏8 g、酵母粉4 g、葡萄糖20 g、磷酸氫二鉀2 g、檸檬酸氫二銨2 g、乙酸鈉5 g、硫酸鎂0.2 g、硫酸錳0.04 g、吐溫-80 1 mL,pH 6.5±0.2。
MRS-溴甲酚綠鑒別培養基(1 L):胰蛋白胨10 g、牛肉膏10 g、酵母粉10 g、番茄汁200 g、葡萄糖10 g、碳酸鈣20 g、溴甲酚綠0.1 g、吐溫-80 0.5 mL、瓊脂18 g,pH 6.0±0.2。
水瓊脂培養基(1 L):瓊脂粉15 g。
營養瓊脂培養基(1 L):胰蛋白胨10 g、牛肉膏3 g、氯化鈉3 g、瓊脂18 g,pH 7.0±0.2。
培養基均用蒸餾水配制和定容,并經高壓滅菌(1.0×10Pa,20 min)后備用。
1.1.3 試劑
食用鈉鹽、花椒等調料 市購;氯化鈉、氫氧化鈉、無水乙醇 上海阿拉丁生化科技股份有限公司;乳酸菌生化鑒定試劑盒 青島高科技工業園海博生物技術有限公司;細菌DNA提取試劑盒、聚合酶鏈式反應(polymerase chain reaction,PCR)聚合酶 北京天根生物有限公司。所有化學藥品均為分析純。
1.2 儀器與設備
ZWY-240恒溫振蕩培養箱 上海智城分析儀器制造有限公司;T100 PCR儀 美國Bio-Rad公司;JY600C電泳儀 北京君意東方電泳設備有限公司;H1750R高速冷凍離心機 湖南湘儀實驗室儀器開發有限公司;CR-400色差分析儀 柯尼卡美能達控股公司;TA. XT Plus質構儀 英國Stable Micro System公司;FlavourSpec氣相色譜-離子遷移譜(gas chromatography-ion mobility spectrometry,GC-IMS)聯用儀 德國G.A.S.公司;臭鱖魚腌制發酵專用裝置由本實驗室自行設計。
1.3 方法
1.3.1 清酒乳桿菌的分離鑒定
在無菌條件下,取臭鱖魚魚肉打成魚糜,用無菌生理鹽水將魚糜樣品稀釋至適當濃度,劃線于MRS-溴甲酚綠平板上,進行厭氧培養(30 ℃,48 h)。挑取平板上呈黃色、有溶鈣圈的菌落進行重復劃線培養,至菌株純化。通過革蘭氏染色、生理生化實驗,完成對疑似乳酸菌菌株的初步篩選。
根據純化菌株在MRS-溴甲酚綠平板上的菌落特征,挑選符合清酒乳桿菌獨特菌落特征的菌株,即中心深綠色而周圍為淺綠色的菌落,進一步進行掃描電鏡觀察。通過細菌基因組提取試劑盒提取該菌基因組DNA,以通用引物27F(5’-AGAGTTTGATCCTGGCTCAG-3’)、1492R(5’-CTACGGCTACCTTGTTACGA-3’)進行PCR擴增。擴增體系(50 μL):20 ng/μL模板1.0 μL,含2.5 mmol/L Mg的10×Buffer 5.0 μL,10 μmol/L上/下引物各1.5 μL,10 mmol/L dNTP 1.0 μL,5 U/μL聚合酶1.0 μL,ddHO 39.0 μL。擴增程序:95 ℃預變性5 min;95 ℃變性30 s,58 ℃退火30 s,72 ℃延伸90 s,35個循環;72 ℃終延伸7 min。將擴增產物送至上海派森諾基因科技有限公司測序。通過MEGA 6.0軟件對菌株16S rDNA序列與NCBI乳桿菌屬菌株16S rRNA基因序列進行比對分析,并采用Neighbor-Joining法構建系統發育樹。
1.3.2 清酒乳桿菌的生物學特性
1.3.2.1 生長條件優化
以厭氧培養至24 h的菌液OD為評價指標,先通過單因素試驗,對菌株在MRS液體培養基中的初始pH值(4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0),培養溫度(4、8、15、20、25、30、37、42 ℃),接種量(0.5%、1.0%、2.0%、3.0%、4.0%、5.0%)進行優化,然后利用Design-Expert 11軟件的Box-Behnken試驗設計原理設計試驗組,以初始pH值、培養溫度和接種量3個因素為自變量,菌液OD為響應值,通過響應面分析對培養條件進一步優化,響應面設計因素水平如表1所示。
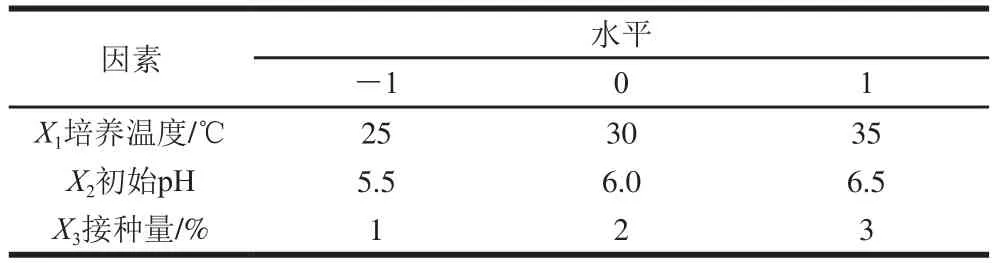
表1 響應面試驗設計因素與水平Table 1 evels and codes of variables used for response surface analysis
1.3.2.2 生長、產酸能力測定
將活菌數為1.0×10CFU/mL的SMF-L5種子液,按2%接種量接種于MRS液體培養基,30 ℃厭氧培養24 h,間隔2 h取樣,分別以平板瓊脂計數法和光電比濁法測定活菌數和培養液OD,繪制生長曲線,用pH計測定pH值和用NaOH溶液滴定法測定菌株產酸量,各指標平行測定3 次。
1.3.2.3 耐鹽、抑菌能力測定
將活菌數為1.0×10CFU/mL的SMF-L5種子液,以2%的接種量接種于含0、0.02、0.04、0.06、0.08、0.1 g/mL NaCl的MRS液體培養基中,以培養24 h后的OD為評價指標,測定菌株耐鹽能力。
將大腸桿菌()、金黃色葡萄球菌()以及從臭鱖魚中分離的腐生葡萄球菌()、丁香假單胞菌()分別劃線于營養瓊脂培養基上,30 ℃培養24 h。挑取單菌落接種于營養肉湯培養基中,以30 ℃、180 r/min培養24 h的培養液作為指示菌菌懸液。
以2%接種量將清酒乳桿菌種子液接種于MRS液體培養基中,30 ℃靜置培養18 h,離心(6 000 r/min,10 min)后取上清液,采用牛津杯雙層瓊脂擴散法檢測乳酸菌上清液抑菌特性。即取10 mL滅菌的水瓊脂傾注于培養皿底層,待其干后在其上放置牛津杯,每個培養皿放置4個。按100 μL指示菌懸液/20 mL保溫至46 ℃的營養瓊脂比例進行混合,傾注于放置好牛津杯的培養皿內,待其干后拔下牛津杯,以1 孔作為對照,向其中加入100 μL未接菌的MRS液體培養基,另外3 孔作為平行樣品,即向其中加入100 μL清酒乳桿菌上清液,4 ℃擴散2 h,30 ℃靜置培養24 h。取出觀察并用游標卡尺測量抑菌圈直徑,根據抑菌圈直徑大小判斷菌株抑菌性能。耐鹽及抑菌能力測試均設置3個平行樣。
1.3.3 清酒乳桿菌對臭鱖魚食用品質及揮發性物質形成的影響
1.3.3.1 發酵工藝流程
發酵工藝流程:新鮮鱖魚→宰殺→清洗→碼放→腌制→發酵→包裝。
傳統自然發酵操作步驟如下:a.取新鮮鱖魚,用魚鱗刷刷去魚體表面魚鱗,再經剖腹宰殺,去除內臟和魚鰓,用自來水和10%鹽水先后清洗一次,瀝水待用;b.將魚平整碼放于鱖魚發酵專用裝置內,一桶約碼放30 kg,每碼一層,撒上若干粒干炒過的花椒(花椒總量為魚質量的0.1%),碼放結束后在上層魚體上放置按壓板;c.向桶內加入提前配制好的腌制液,即0.08 g/mL食鹽溶液,以剛好浸沒按壓板為宜,按壓板上放置扁圓狀砝碼(按壓質量為魚質量的40%),用以將魚體全部浸壓于腌制液液面以下;d.合上發酵裝置頂蓋,以厭氧發酵方式,8 ℃發酵16 d。
接種發酵則是將步驟c調整為:按1 kg魚添加1.25 g清酒乳桿菌濕菌體的量,將清酒乳桿菌充分溶于0.08 g/mL食鹽溶液中,作為腌制液。其他步驟同自然發酵操作步驟。
發酵結束后,將臭鱖魚取出,用清水清洗干凈,備用。
1.3.3.2 特征蒜瓣觀察
用解剖刀沿臭鱖魚的脊背和鰓蓋后沿,將兩側魚皮劃裂,并輕輕剝離至尾部,分別切取同側、沿背鰭下方至側線之間的肌肉塊,并置于蒸鍋中隔水蒸煮10 min,取出室溫下冷卻后剝離蒜瓣肉,肉眼觀察并拍照。
1.3.3.3 色澤、質構測定
參照本實驗室建立的方法測定魚肉的色澤、質構,每個樣品平行測定6 次。
1.3.3.4 揮發性風味物質測定
參照本實驗室建立的方法,采用GC-IMS測定和分析樣品的揮發性風味物質,每個樣品進行3 次平行測定。
1.4 數據處理

2 結果與分析
2.1 清酒乳桿菌的分離與鑒定
利用傳統分離培養手段,從自然發酵臭鱖魚中分離到1 株符合清酒乳桿菌形態學特征的菌株,命名為SMF-L5。SMF-L5菌株在含溴甲酚綠的MRS固體平板上的菌落特征為綠色(中心綠色,周圍淺綠色),中央凸起,邊緣整齊,表面光滑(圖1A);革蘭氏染色呈陽性,短桿狀排列,菌體大小約為1.0 μm×0.5 μm,無芽孢,無鞭毛,單個或成對,成鏈狀排列(圖1B、C);可發酵纖維二糖、麥芽糖、水楊苷、蔗糖、菊糖和乳糖(表2)。對菌株SMF-L5的16S rRNA基因進行測序,在GenBank中獲得序列登錄號為MZ208836。通過NCBI數據庫BLAST序列比對和系統發育樹分析,證實菌株SMF-L5與6668、JBAR-SPR、subsp.JUL0153等菌株聚類在同一分枝上(圖2),因此確定為清酒乳桿菌。
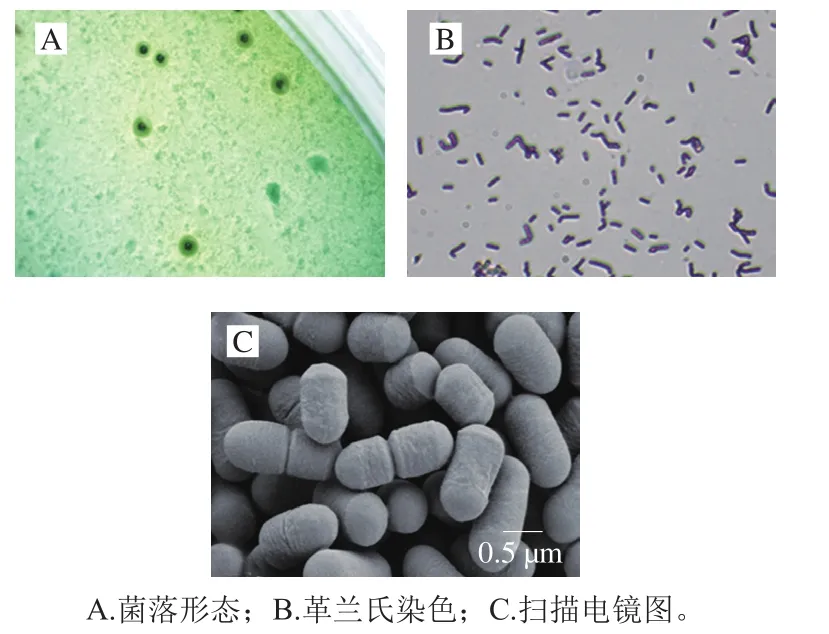
圖1 清酒乳桿菌SMF-L5的形態特征Fig. 1 Morphological characteristics of L. sakei SMF-L5

表2 清酒乳桿菌SMF-L5的生理生化特性Table 2 Physiological and biochemical characteristics of L. sakei SMF-L5

圖2 基于16S rRNA基因序列構建的系統發育樹Fig. 2 Phylogenetic tree based on 16S rRNA gene sequences
2.2 清酒乳桿菌的生物學特性
2.2.1 清酒乳桿菌最適生長條件
通過單因素試驗對菌株SMF-L5在MRS液體培養基中的培養條件(初始pH值、培養溫度、接種量)進行初步優化。結果顯示,當初始pH值為4.0~6.0時,菌液OD隨著初始pH值的升高先逐漸升高,至pH 6.0~8.0時,菌液OD稍有下降;在培養溫度4~30 ℃時,菌液OD隨著溫度升高而升高,在30~42 ℃范圍內則隨著溫度升高而下降;菌株初始接種量在0.5%~2%時,菌液OD隨接種量增加而升高,至2%~5%時又逐漸降低(圖3)。因此,將最適培養條件定為培養溫度30 ℃、初始pH 6.0、接種量2%。
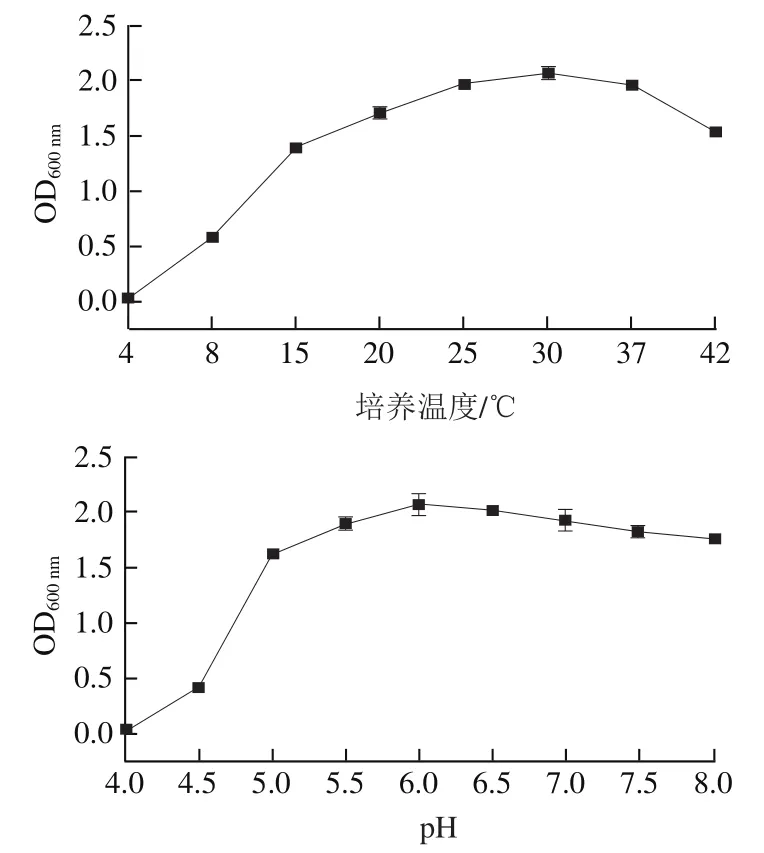

圖3 不同培養條件對清酒乳桿菌SMF-L5生長的影響Fig. 3 Effects of different culture conditions on the growth of L. sakei SMF-L5
2.2.2 響應面試驗結果
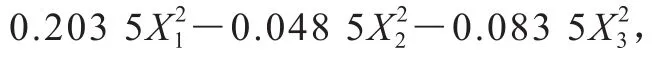
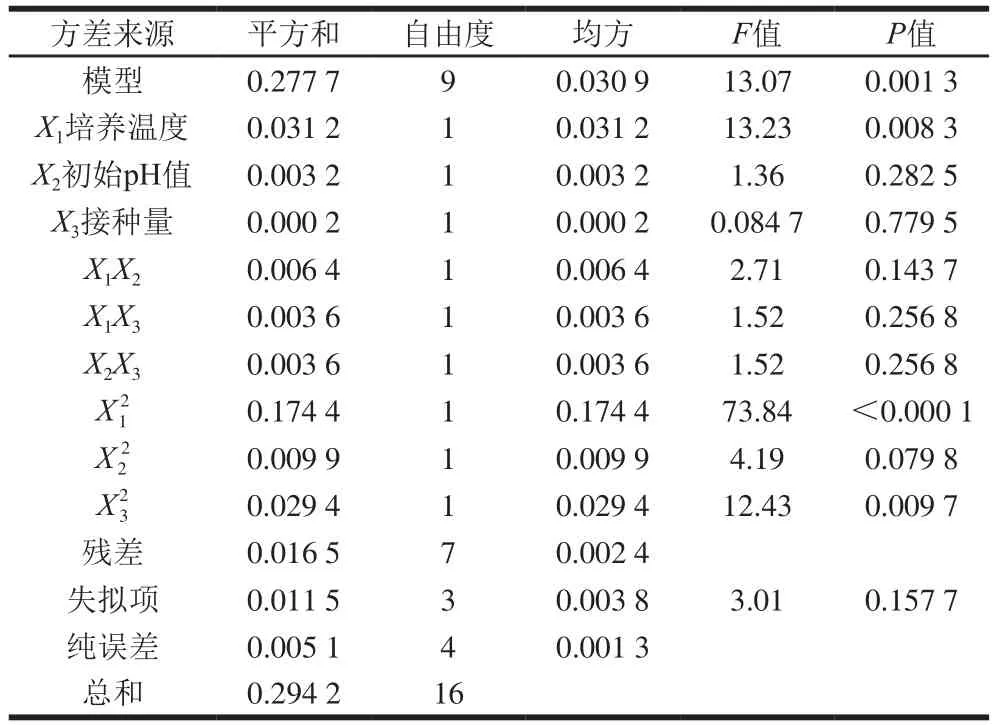
表3 模型回歸方程方差分析Table 3 Analysis of variance of quadratic polynomial model
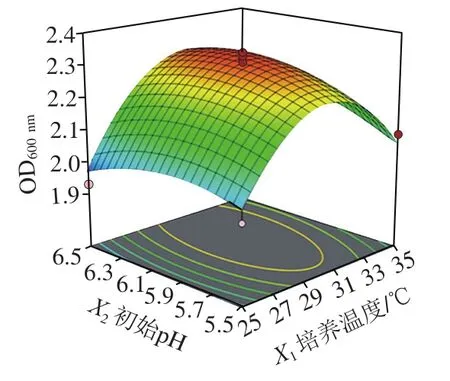
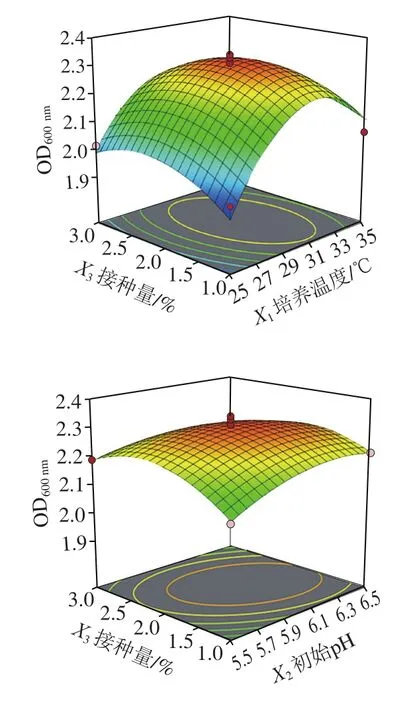
圖4 初始pH值、培養溫度與接種量交互作用對清酒乳桿菌SMF-L5 OD600 nm影響的響應面圖Fig. 4 Response surface plots for individual and interactive effects of initial pH, growth temperature and inoculum on the growth of L. sakei SMF-L5
通過Design-Expert 11軟件對回歸方程求解得到模型最大值,即培養溫度30.9 ℃、初始pH 6.15、接種量1.94%,此時菌體最大生物量達2.31。在最佳培養條件下進行培養驗證實驗,所得菌體生物量實際值為2.39±0.03,與理論值接近,表明該模型合理。
2.2.3 清酒乳桿菌生長、產酸能力
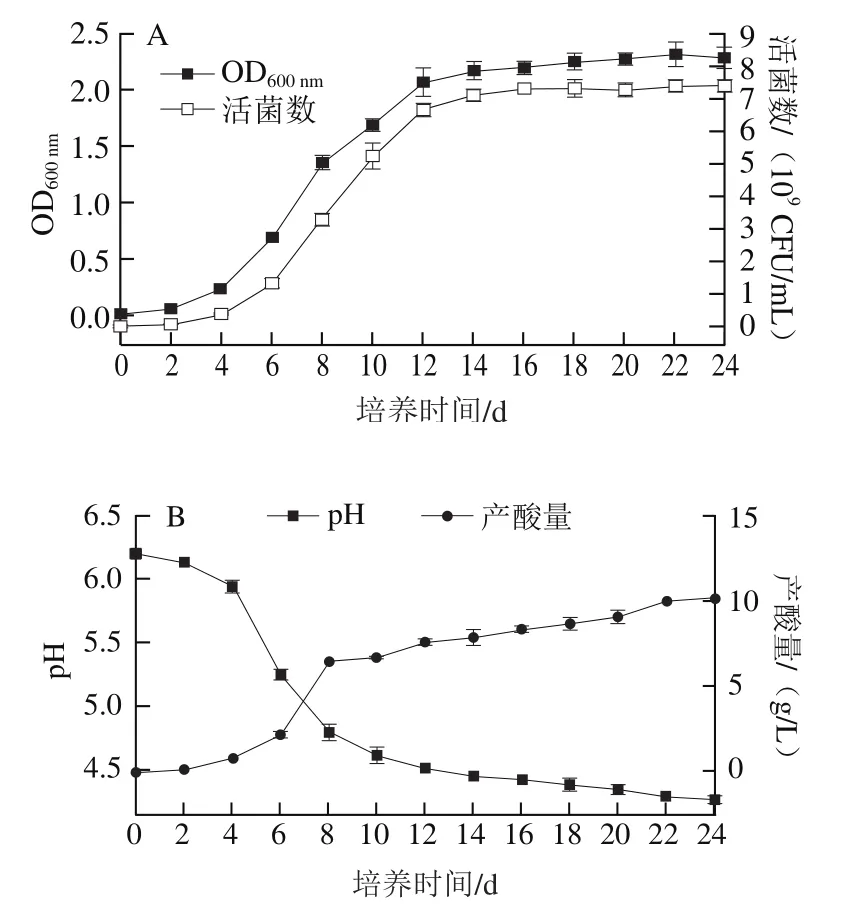
圖5 清酒乳桿菌SMF-L5生長(A)、產酸(B)能力Fig. 5 Growth (A) and acid production ability (B) of L. sakei SMF-L5
菌株SMF-L5在培養最初,活菌數約為1.0×10CFU/mL,在4 h進入對數生長期,14~24 h進入生長穩定期,活菌數約達到7.0×10CFU/mL(圖5A),結果表明清酒乳桿菌在接種至培養基后具有較強的適應能力和較快的生長速率。菌株在4~14 h對數生長期內,培養基pH值下降速率較快,進入生長穩定期后pH值降至4.2,這與它具有良好的適應性有關,符合菌株的生長曲線規律。在pH值不斷下降過程中,菌株也在持續產酸,最大產酸量達到10 g/L(圖5B)。表明菌株具有較強產酸能力,能夠有效降低發酵體系中的pH值。
2.2.4 清酒乳桿菌耐鹽、抑菌能力
2.2.4.1 清酒乳桿菌耐鹽能力
在研究菌株SMF-L5耐鹽能力時,發現當NaCl添加量在0~0.1 g/mL范圍內,菌株生物量下降不明顯,至0.04~0.08 g/mL時,生物量有所下降,但OD仍可維持在1.5以上,高于0.08 g/mL后,生物量則下降比較明顯,OD低于1.0(圖6),表明菌株具有一定的耐鹽能力,在較高鹽濃度環境中仍可較好地生長和繁殖。

圖6 清酒乳桿菌SMF-L5對NaCl的耐受結果Fig. 6 Tolerance of L. sakei SMF-L5 to NaCl
2.2.4.2 清酒乳桿菌抑菌能力
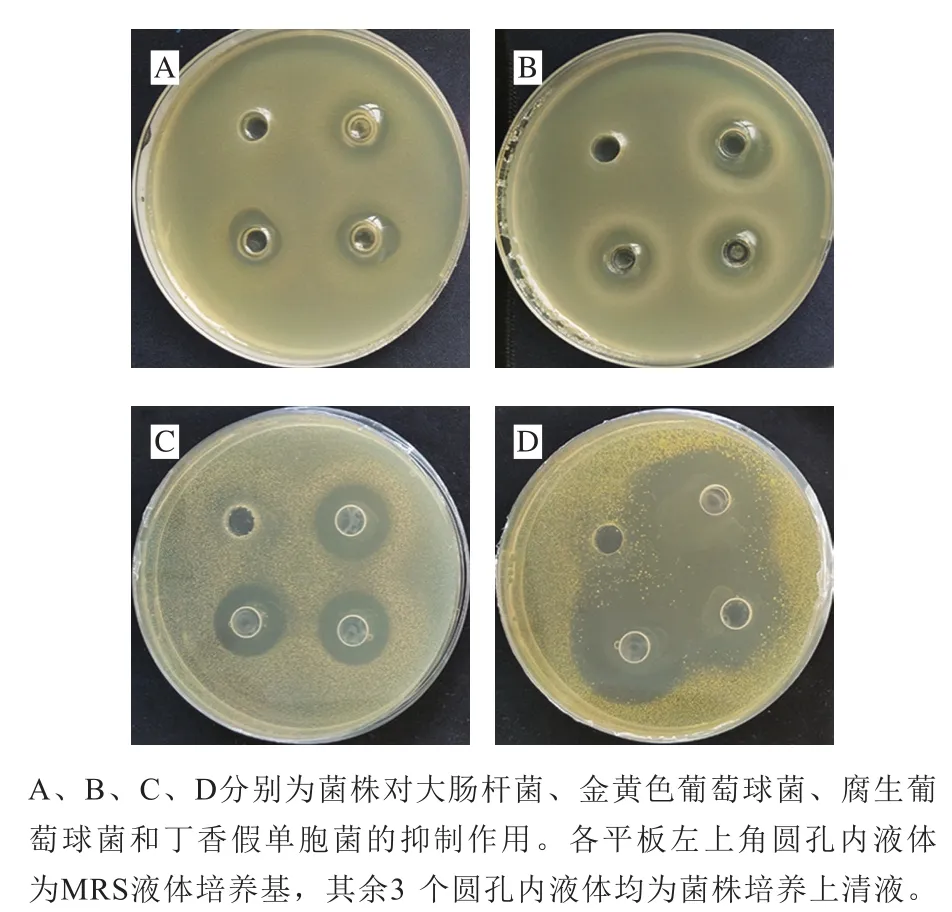
圖7 清酒乳桿菌SMF-L5對病原菌的抑制效果Fig. 7 Inhibitory effects of L. sakei SMF-L5 on pathogens
以大腸桿菌、金黃色葡萄球菌以及本實驗室在臭鱖魚中常分離到的丁香假單胞菌、腐生葡萄球菌作為指示菌,研究清酒乳桿菌SMF-L5的抑菌能力,結果如圖7所示。SMF-L5菌株培養上清液對所有指示菌均有不同程度的抑制作用。對大腸桿菌、金黃色葡萄球菌的抑菌圈直徑分別達到(14.42±0.21)mm和(18.40±0.46)mm,對臭鱖魚源丁香假單胞菌和腐生葡萄球菌抑菌圈直徑分別為(19.24±0.11)mm和(24.66±1.58)mm。
2.3 清酒乳桿菌對臭鱖魚食用品質及揮發性物質形成的影響
2.3.1 清酒乳桿菌對魚肉特征蒜瓣的影響
腌制發酵而成的臭鱖魚,其典型的品質特征為魚肉呈蒜瓣狀。沿背鰭下方至側線之間的肌肉,其蒜瓣狀尤為明顯。蒸煮后通過剝離可以發現,通過清酒乳桿菌接種發酵的臭鱖魚,其肉質的蒜瓣狀比自然發酵臭鱖魚的肉質蒜瓣狀更規則、更白亮(圖8)。

圖8 清酒乳桿菌SMF-L5對臭鱖魚特征蒜瓣的影響Fig. 8 Influence of L. sakei SMF-L5 on the characteristic garlic clove-like appearance of fermented mandarin fish
2.3.2 清酒乳桿菌對魚肉色澤、質構的影響
通過清酒乳桿菌接種發酵后,臭鱖魚的色澤和白度均得到提升(圖9A),魚肉質構也產生了變化,硬度在接種發酵后有所降低,黏附性、彈性、膠黏性和咀嚼性則均有所增加(圖9B),表明清酒乳桿菌接種發酵可改善臭鱖魚的色澤和質構,使臭鱖魚魚肉更為白亮、更有彈性。
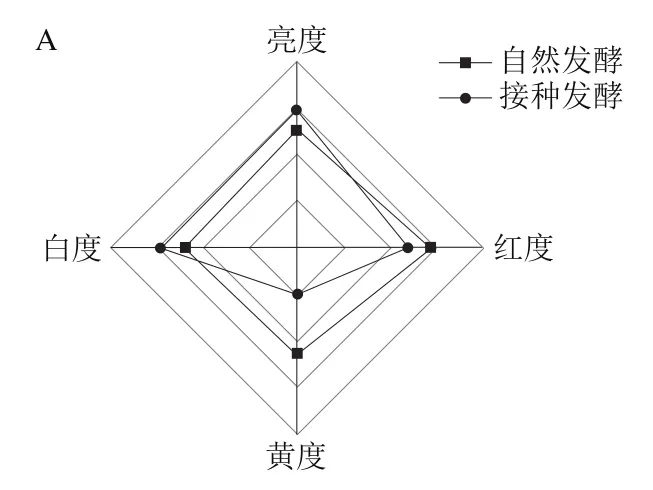

圖9 清酒乳桿菌SMF-L5對臭鱖魚色澤(A)、質構(B)的影響Fig. 9 Influence of L. sakei SMF-L5 on the color (A) and texture (B) of fermented mandarin fish
2.3.3 清酒乳桿菌對魚肉揮發性風味物質形成的影響
通過GC-IMS的GC保留時間和IMS遷移時間對接種發酵、自然發酵臭鱖魚中的揮發性風味物質進行鑒定,共鑒定出36種揮發性風味物質,其中醇類11種、酮類8種、醛類5種、酯類5種、酸類2種、醚類3種、烯烴類2種(表4)。為進一步比較接種發酵、自然發酵臭鱖魚中揮發性物質組分的差異,利用LAV軟件將三維譜圖中的特征峰生成指紋圖譜(圖10),在指紋圖譜中,每縱列特征峰對應一種揮發性風味物質。接種發酵的臭鱖魚,丁酸乙酯、乙酸己酯、羥基丙酮、2,3-丁二醇、玫瑰醚、甲硫醇、2,3-戊二酮、甲硫基丙醛、2-辛醇、丙醇和4-甲基-2-戊酮等的含量明顯低于自然發酵臭鱖魚,而芳樟醇、-松油醇、-蒎烯、檸檬烯等揮發性香氣成分的含量比自然發酵臭鱖魚明顯增加,表明清酒乳桿菌接種發酵臭鱖魚,能夠降低魚肉中惡臭氣味的產生和促進香氣物質的生成。

表4 接種、自然發酵臭鱖魚中揮發性風味物質Table 4 Volatile substances of fermented mandarin fish using inoculated and spontaneous fermentations

續表4

圖10 清酒乳桿菌SMF-L5對臭鱖魚揮發性風味物質形成的影響Fig. 10 Influence of L. sakei SMF-L5 on volatile flavor substances of fermented mandarin fish
3 討 論
乳酸菌是世界公認的食品級安全微生物,被廣泛用于食品發酵以及天然食品防腐劑等食品工業上。在發酵魚制品中,乳酸菌是主導發酵過程的優勢菌群之一,在改善發酵制品風味、延長保質期、加速色澤形成和提高產品安全等方面發揮著不可替代的作用。傳統臭鱖魚發酵工藝屬于多菌種參與的、開放式的自然發酵,發酵體系中含有大量病原微生物,產品安全性不能得到有效保證,產品質量和風味品質穩定性差,通過乳酸菌發酵臭鱖魚,有望能夠解決這些問題。
清酒乳桿菌最早是從發酵米酒中分離獲得,現已知泡菜、發酵乳制品、發酵香腸和發酵魚等自然發酵制品也是獲得清酒乳桿菌的良好來源。傳統培養技術是獲取純菌株必不可少的步驟,也是進一步篩選優良菌株的基礎。含溴酚藍或溴甲酚綠的MRS培養基適用于產酸類乳酸菌的篩選。嗜酸乳桿菌()、植物乳桿菌()、羅伊氏乳桿菌()、雙歧桿菌()等乳酸菌在含溴酚藍的MRS培養基上較易區分,植物乳桿菌、清酒乳桿菌和格氏乳球菌等乳酸菌在含溴甲酚綠的MRS培養基上形態差異較為明顯。清酒乳桿菌在含溴甲酚綠的MRS培養基上,其典型形態特征為菌落中心綠色、周圍淺綠色或中心綠色、周圍白色。努爾古麗?熱合曼等為跟蹤清酒乳桿菌在酸駝乳發酵過程中的作用,基于含溴甲酚綠的MRS鑒別培養基,實現了自然發酵酸駝乳中清酒乳桿菌的快速識別和分離。本實驗在明確清酒乳桿菌為傳統發酵臭鱖魚中優勢乳酸菌的前提下,借助含溴甲酚綠的MRS鑒別培養基從臭鱖魚中也成功分離到清酒乳桿菌,進一步說明基于含溴甲酚綠的MRS鑒別培養基分類鑒定清酒乳桿菌的方法,簡單、快速可行。
良好的生長環境對乳酸菌生長速率及生物量積累至關重要。乳酸菌的生長受環境中溫度影響較大,pH值對乳酸菌的生長也具有較大影響。在本實驗中,清酒乳桿菌SMF-L5對溫度、pH值等生長條件具有較寬的適應范圍,這很可能是清酒乳桿菌能夠成為臭鱖魚在自然發酵過程中優勢菌的主要原因。乳酸菌生長代謝形成的低pH值發酵環境能夠有效抑制腐敗菌、致病菌的生長和減少有害物質的產生,從而提高產品的安全性。林城杏以傳統發酵酸魚中篩選出的植物乳桿菌接種發酵酸魚,發現植物乳桿菌可明顯抑制產胺腸桿菌等腐敗菌和病原菌的生長,同時也使魚肉中的生物胺含量有所減少。以產酸能力強的乳酸菌應用于臭鱖魚發酵生產,將是主導臭鱖魚發酵過程、提升產品安全品質的一種有效途徑。
在發酵食品制作過程中,加入食鹽可一定程度抑制腐敗菌等雜菌的生長,在鹽腌發酵技術基礎上,通過添加耐鹽性微生物主導發酵過程,有利于縮短發酵時間和提升產品品質。當前臭鱖魚規模化生產主要以濕法腌制發酵工藝為主,鹽水質量濃度控制在0.06~0.08 g/mL。清酒乳桿菌SMF-L5對高達0.08 g/mL鹽質量濃度的培養條件仍具有較高的耐受能力,因此適于在臭鱖魚發酵體系中生長。
清酒乳桿菌SMF-L5對大腸桿菌、金黃色葡萄球菌等食品中常見病原菌的抑制作用,與肉及肉制品中被普遍分離到的清酒乳桿菌,具有相似的結果。在發酵香腸中,清酒乳桿菌能夠快速成為其中的優勢菌,并能夠明顯抑制大腸桿菌和腸桿菌的生長。如果將臭鱖魚源清酒乳桿菌接種至臭鱖魚發酵體系中,可使其成為主導發酵過程的優勢菌群并抑制其他雜菌的生長。
清酒乳桿菌SMF-L5在接種發酵臭鱖魚時,可能是通過改變發酵體系中的菌群結構,抑制產臭微生物生長和減少細菌種類、數量,形成優于自然發酵臭鱖魚的風味。在揮發性風味物質中,芳樟醇、-松油醇、-蒎烯和檸檬烯可賦予臭鱖魚具有植物花香的風味特征,是在發酵過程中由添加的花椒所帶入。這些成分也是植物花椒本身主要的揮發性物質,隨著腌制發酵過程的進行,花椒中的風味物質逐漸滲透進入魚體,構成魚肉重要的風味物質。在臭鱖魚風味研究中,芳樟醇是常見的揮發性物質,且被認為對臭鱖魚整體風味品質具有重要貢獻的風味活性物質。
4 結 論
通過含溴甲酚綠的MRS鑒別培養基,結合革蘭氏染色、生理生化實驗以及16S rDNA分子生物學鑒定方法從傳統自然發酵臭鱖魚中分離到一株清酒乳桿菌,命名為SMF-L5。清酒乳桿菌SMF-L5在MRS液體培養基中的最佳培養條件為培養溫度30.9 ℃、初始pH 6.15、接種量1.94%;該菌可耐受0.08 g/mL NaCl,對大腸桿菌、金黃色葡萄球菌、腐生葡萄球菌和丁香假單胞菌具有明顯的抑制作用;在應用于臭鱖魚發酵時,能夠使臭鱖魚具有更規則、更白亮的蒜瓣狀肉質和更具彈性的質構,同時還能使臭鱖魚產品的風味得到提升。因此,表明臭鱖魚源清酒乳桿菌SMF-L5可作為良好的乳酸菌發酵劑,在臭鱖魚工業化生產上具有應用潛力。

