胸主動脈腔內修復術置入短支架與過長支架療效及安全性分析
侯抒懷, 周鐵楠, 李智佳, 彭程飛, 王效增
1.錦州醫科大學北部戰區總醫院研究生培養基地,遼寧 沈陽110016;2.北部戰區總醫院 心血管內科,遼寧 沈陽 110016
急性主動脈綜合征(acute aortic syndrome,AAS)包括急性主動脈夾層(aortic dissection,AD)、急性壁內血腫、急性主動脈穿透性潰瘍、主動脈破裂等。AAS患者通常急性起病,臨床癥狀表現為突然發作的劇烈胸痛及背痛,可向腹部等其他部位放射,呈撕裂樣[1]。依據Stanford分型可將AD分為A型與B型[2]。目前,AAS的治療方法包括藥物治療、主動脈腔內修復術(thoracic endovascular aortic repair,TEVAR)及外科手術治療。TEVAR以其微創、安全、并發癥少、病死率低等優點逐漸替代外科手術成為AAS的主要治療方法[3-6]。本研究旨在探討AAS患者TEVAR置入短支架與過長支架的臨床療效及安全性。現報道如下。
1 對象與方法
1.1 研究對象 選取北部戰區總醫院自2002年6月至2020年6月收治的379例急性主動脈綜合征行TEVAR患者為研究對象。納入標準:經計算機斷層掃描血管造影(computed tomography angiography,CTA)確診為AAS;急性Stanford B型夾層;胸降主動脈瘤不全破裂;胸降主動脈假性動脈瘤;急性主動脈穿透性潰瘍伴壁內血腫。排除標準:單純主動脈瘤;腹主動脈置入覆膜支架;主動脈動脈粥樣硬化伴潰瘍形成;單純急性主動脈壁內血腫;外傷性主動脈損傷。根據覆膜支架置入長度將其分為A組(長度≥200 mm,n=182)與B組(長度<150 mm,n=197)。本研究經醫院倫理委員會批準。患者均簽署知情同意書。
1.2 研究方法 所有患者均接受CTA及三維重建,明確疾病的性質、位置、范圍,以及累及重要分支血管、主動脈弓參考血管直徑。所有患者均給予氧氣吸入、降壓和控制心率,繼續監測患者的血壓及心率。主動脈瘤不全破裂、胸部劇烈疼痛不緩解或重要器官灌注不良復雜型急性Stanford B型AD患者盡早完成TEVAR,其他患者待病情穩定后擇期行TEVAR治療。所有患者均在心血管心內科導管室實施TEVAR,嚴格按照本中心介入手術操作流程[7-8]。
1.3 觀察指標 記錄并比較兩組的臨床資料,以及在院期間、術后30 d與遠期臨床不良事件發生情況。所有患者出院后由相關人員通過電話、微信等方式進行1個月、6個月及1年的術后隨訪,此后每2年隨訪1次。隨訪內容包括CTA影像學、血壓控制及用藥情況、主動脈相關不良事件(再發夾層,遠端潰瘍,逆行撕裂,新發內漏)、死亡及其原因、新發卒中等發生情況。
1.4 統計學方法 采用SPSS 25.0統計學軟件對數據進行處理。符合正態分布的計量資料以均數±標準差(±s)表示,組間比較采用t檢驗;非正態分布的計量資料以中位數(25%四分位數,75%四分位數)表示,組間比較采用秩和檢驗。計數資料用例(百分率)表示,組間比較采用χ2檢驗。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者臨床資料比較 B組患者男性、吸煙史、飲酒史、糖尿病史、破口距離左鎖骨下動脈開口<20mm、病變撕裂過膈肌、在院服用降糖藥、他汀類藥比例及入院舒張壓、血紅蛋白、C反應蛋白、主動脈參考血管平均直徑、置入覆膜支架平均數、覆膜支架平均長度均低于A組,差異均有統計學意義(P<0.05)。兩組患者其他臨床資料比較,差異均無統計學意義(P>0.05)。見表1。
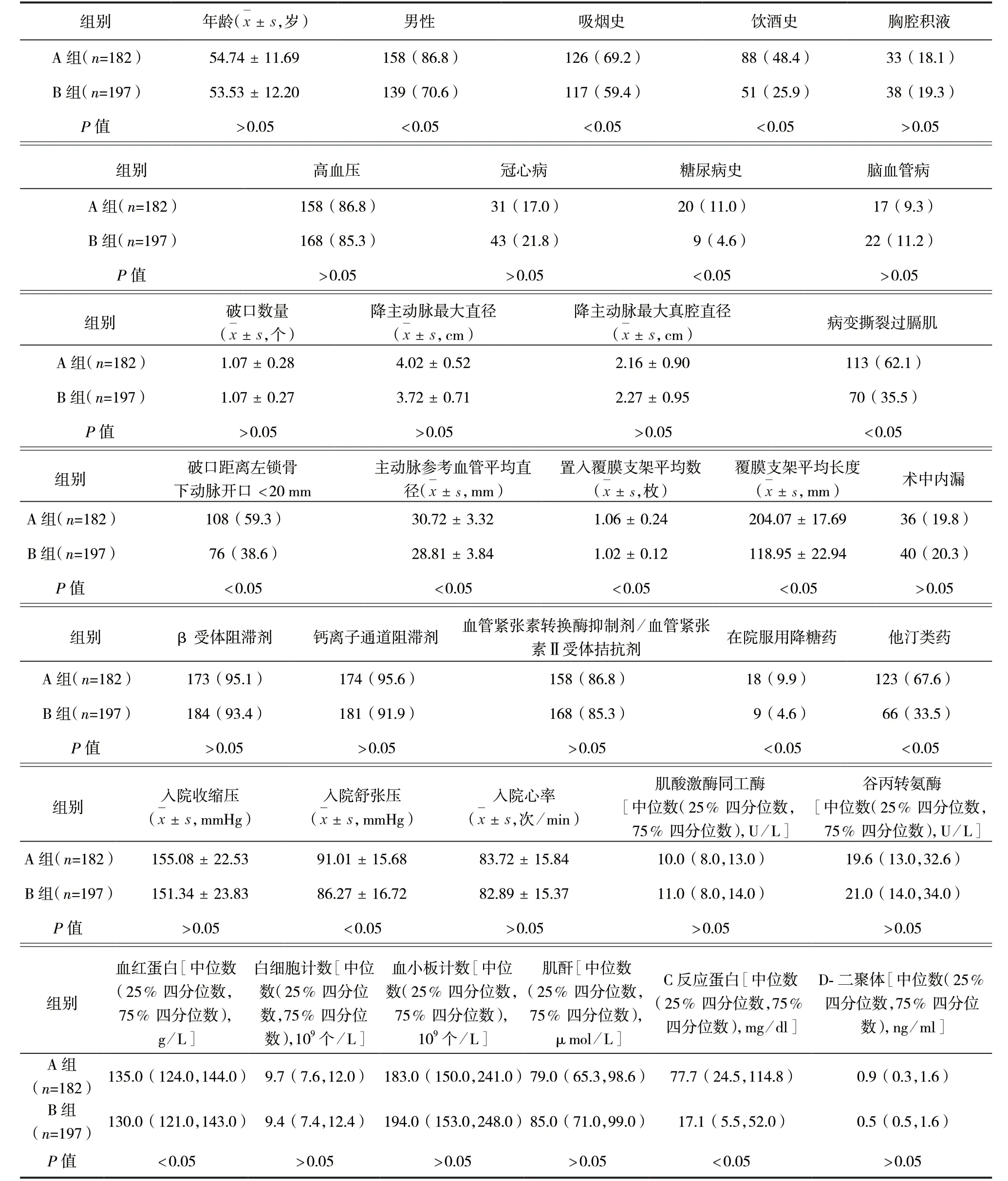
表1 兩組患者臨床資料比較/例(百分率/%)
2.2 兩組患者在院期間臨床不良事件發生情況比較 在院期間,兩組患者的全因死亡、新發卒中、截癱等臨床不良事件發生率比較,差異均無統計學意義(P>0.05)。見表2。
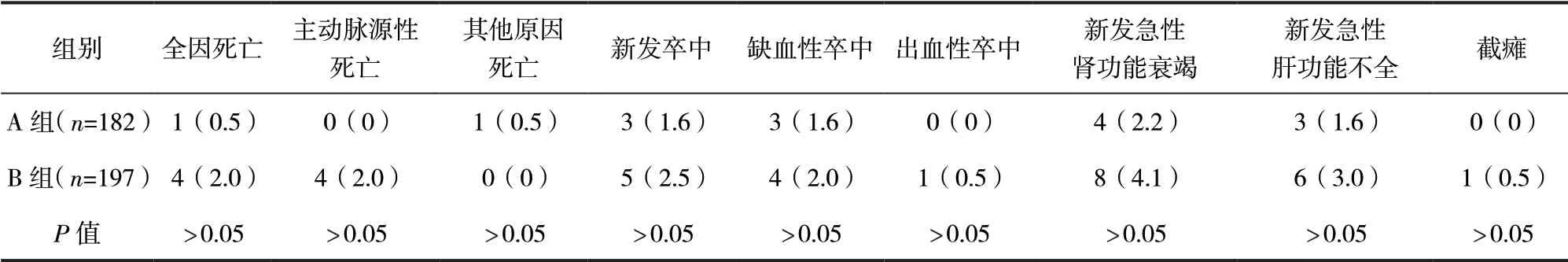
表2 兩組患者在院期間臨床不良事件發生情況比較/例(百分率/%)
2.3 兩組患者術后30 d臨床不良事件發生情況比較 對374例出院患者進行術后30 d隨訪,A組、B組隨訪完成率分別為93.9%(170/181)、93.3%(180/193),差異無統計學意義(P>0.05)。A組、B組總體臨床不良事件發生率分別為1.8%(3/170)、5.6%(10/180),差 異 無 統 計 學 意 義(P>0.05)。術后30 d,兩組患者全因死亡、新發卒中、主動脈相關不良事件發生率比較,差異均無統計學意義(P>0.05)。見表3。
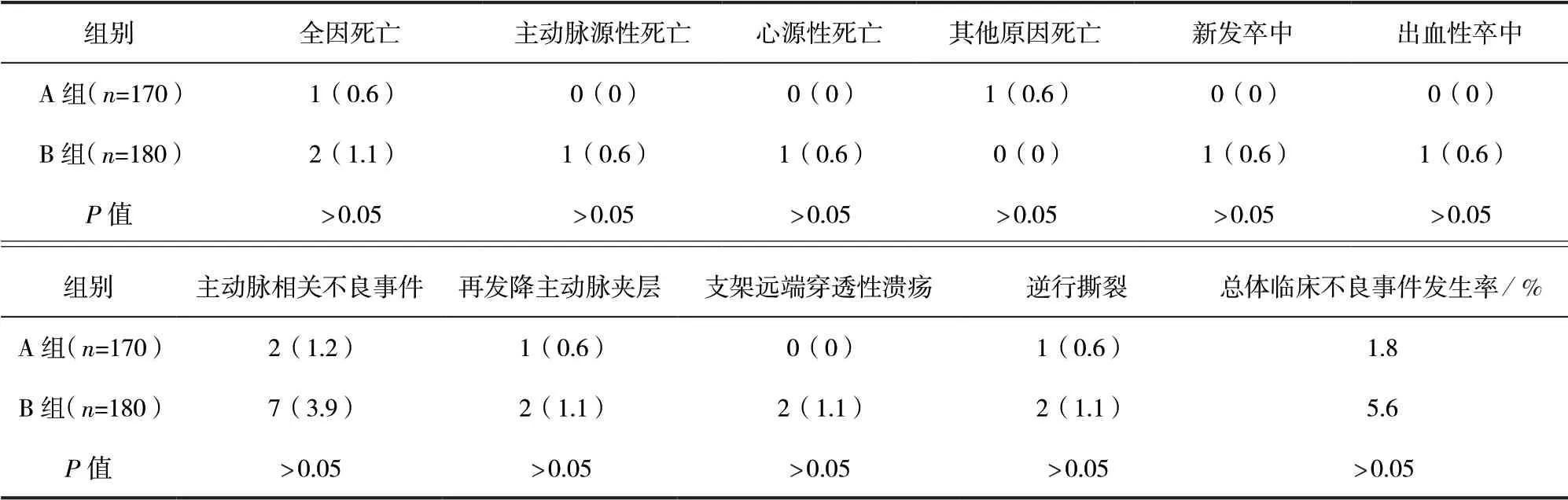
表3 兩組患者術后30 d臨床不良事件發生情況比較/例(百分率/%)
2.4 兩組患者遠期臨床不良事件發生率比較 對347例患者進行遠期隨訪,隨訪時間為12~180個月,中位隨訪時間為60個月。A組、B組隨訪完成率分別 為94.7%(160/169)、94.4%(168/178),差 異無統計學意義(P>0.05)。B組患者全因死亡、新發卒中、主動脈相關不良事件、總體臨床不良事件發生率及再次行TEVAR比例均高于A組,差異均有統計學意義(P<0.05)。見表4。
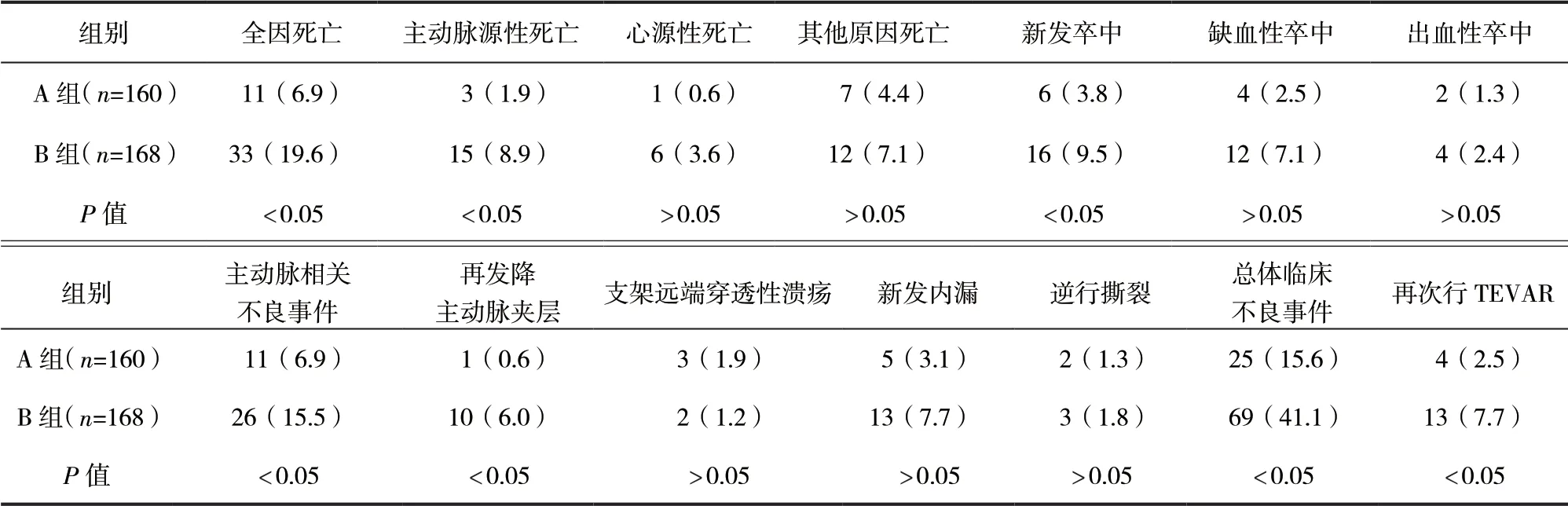
表4 兩組患者遠期臨床不良事件發生率比較/例(百分率/%)
3 討論
AAS為一類極其兇險的主動脈疾病,如不及時診治,后果十分嚴重,其中AD約占62%~88%。AD的發生是由于多種原因導致的,首先是主動脈內膜撕裂形成破裂口,其次為流入破裂口的血液使主動脈結構分離成雙腔[9]。TEVAR作為Stanford B型AD的主要治療手段已得到認可,應用覆膜支架將近端的夾層破口封閉從而使真腔擴大,假腔形成血栓變小,穩定主動脈壁結構,以防止病變破裂而造成嚴重后果[10]。但是,TEVAR治療以Stanford B型AD為主的AAS置入覆膜支架有發生截癱的風險,脊髓缺血損傷已被證實為TEVAR后嚴重并發癥之一,覆蓋脊髓根部動脈是其主要原因[11-15]。本研究中,術后第2天,B組患者中1例發生截癱,經神經營養及激素治療后好轉,預后良好,本例覆膜支架未覆蓋根大動脈,發生截癱考慮為夾層本身撕裂至根大動脈所致。兩組患者截癱發生率比較,差異無統計學意義(P>0.05)。覆膜支架過長并不會增加脊髓損傷或截癱發生率。
TEVAR應用的覆膜支架長度選擇要依據病變的長度、AD撕裂的長度、主動脈弓部及胸降主動脈形態等多種因素。AD的胸降主動脈多為被假腔壓縮變小的真腔,如果置入支架的遠端錨定區位于成角或迂曲的主動脈壁上,可能會導致再發夾層等并發癥發生,需要再次行TEVAR治療。本研究中,A組患者術后遠期再次行TEVAR比例低于B組,可能與置入短支架的遠端錨定區更多的位于主動脈弓、降部交界處造成支架對血管壁的側應力加大造成損傷,導致術后隨訪期間主動脈相關并發癥增多有關。為避免術后再次行TEVAR治療,應將置入的覆膜支架盡可能位于動脈內膜相對完整的部分,規避扭曲及狹窄的部位,使其與主動脈血管的縱軸相平行,避免支架置入后成角,減少再次TEVAR。本研究結果顯示,A組患者病變撕裂過膈肌比例大于B組,差異有統計學意義(P<0.05)。這表明,主動脈損傷范圍大的患者適合選擇過長支架,以獲得良好的臨床效果。本研究結果顯示,B組患者主動脈相關不良事件、總體臨床不良事件發生率及再次行TEVAR比例均高于A組,差異均有統計學意義(P<0.05)。應盡可能避免應用短支架,以免支架遠段誘發再發夾層,增加術后并發癥的發生率。術后發生主動脈相關不良事件除了支架對血管壁的壓力因素外,還需要重視患者血壓的控制,定期隨訪復查CTA,可以及時識別術后主動脈相關不良事件的發生,以便給予患者進一步治療。
綜上所述,TEVAR置入過長覆膜支架近遠期療效優于置入短支架,并未增加術后截癱的發生,安全可行。

