PAX-1 甲基化應(yīng)用于HPV 陽(yáng)性患者宮頸癌篩查的價(jià)值研究
馬媛 李穎 馬海蘭
宮頸癌是婦科的常見腫瘤,隨著人們生活模式的轉(zhuǎn)變,近年來(lái)宮頸癌的發(fā)病率呈逐年上升的趨勢(shì)[1]。宮頸癌患者的死亡率較高,患者的死亡原因與腫瘤的轉(zhuǎn)移存在著密切的聯(lián)系,因此能夠早期對(duì)宮頸癌患者進(jìn)行診斷、轉(zhuǎn)移的判斷能夠有效提高患者的預(yù)后[2,3]。1995 年,國(guó)際癌癥研究機(jī)構(gòu)(IARC)專題討論會(huì)明確指出HPV 感染在宮頸癌的發(fā)生過(guò)程中起著十分重要的作用,但是關(guān)于其具體的致病機(jī)制仍然不明確[4]。已有較多研究證實(shí)編碼基因異常甲基化在胃癌、肺癌、胰腺癌、前列腺癌等惡性腫瘤組織均明顯存在,同時(shí)與上述腫瘤的惡性生物學(xué)行為密切相關(guān),PAX-1 是另一種重要的抑癌基因,有研究顯示PAX-1 基因在宮頸癌患者中存在普遍的甲基化現(xiàn)象[5]。本研究通過(guò)分析HPV 陽(yáng)性的宮頸癌患者的PAX-1 基因甲基化情況,旨在探索潛在的HPV 導(dǎo)致宮頸癌的機(jī)制。
1 資料與方法
1.1 一般資料 選取2019 年6 月~2021 年6 月本院收治的120 例宮頸癌患者為研究對(duì)象,依據(jù)HPV 檢查結(jié)果分為陽(yáng)性組(HPV 陽(yáng)性)與陰性組(HPV 陰性),各60 例。另選擇同期收入本院的HPV 陽(yáng)性而宮頸正常的患者60 例作為對(duì)照組。陽(yáng)性組年齡43~83 歲,平均年齡(51.5±11.0)歲;陰性組年齡42~81 歲,平均年齡(52.0±11.5)歲;對(duì)照組年齡42~80 歲,平均年齡(53.0±11.2)歲。三組患者一般資料比較差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),具有可比性。本次研究均征得患者及其家屬的同意,并經(jīng)本院倫理委員會(huì)審批通過(guò)。
1.2 納入及排除標(biāo)準(zhǔn) 納入標(biāo)準(zhǔn):①宮頸癌患者經(jīng)取材活檢病理檢查確診為宮頸癌;②選取患者均為首次就診,此前未進(jìn)行過(guò)陰道抗菌藥物治療;③所有患者HPV 感染情況均由脫落細(xì)胞學(xué)檢查確定;④陽(yáng)性組患者此前未采取任何治療。排除標(biāo)準(zhǔn):①合并其他惡性腫瘤患者;②有其他能夠影響宮頸HPV 篩查的生殖系統(tǒng)疾病的患者。
1.3 方法
1.3.1 DNA 提取方法 將液氮罐中的標(biāo)本放置于-80℃冰箱中;用錫紙將研缽包好置于200℃的高壓滅菌鍋中消毒;將10、200、1000 μl 的移液槍槍頭和1.5 ml 的離心管進(jìn)行消毒備用;將組織自冰箱中取出,置于研缽中,將其敲碎30 mg 的組織,倒入液氮,進(jìn)行研磨后移至EP 管中;后加入200 μl 的TL 緩沖液;加入25 μl OB 蛋白酶,充分混勻,在55℃溫度條件下水浴孵育,每隔30 min 震蕩1 次;離心(1000 r/min×5 min),取出不溶性組織沉淀,將上清液轉(zhuǎn)移至無(wú)菌的1.5 ml EP 管中;加入220 μl BL 緩沖液,充分混勻。70℃孵育10 min;加入220 μl 無(wú)水乙醇,充分混勻;于2 ml 的收集管中組裝HiBand DNA 柱子,將得到的裂解物轉(zhuǎn)移到柱子中,置于離心機(jī)中進(jìn)行離心(8000 r/min×2 min),棄去流下液體;將離心柱置于新的2 ml 收集管中,加入500 μl HB 緩沖液,離心(8000 r/min×2 min),棄去流下液體;將離心柱置于新的2 ml 收集管中,加入700 μl DNA 洗脫緩沖液,離心(8000 r/min×2 min),棄去流下液體,重復(fù)該步驟2 次;將離心柱放回2 ml的收集管中,離心(8000 r/min×2 min),從而使離心柱干燥;將離心柱置于無(wú)菌的1.5 ml EP 管中,加入100 μl 70℃的洗脫緩沖液,室溫下靜止3 min,離心(10000 r/min×1 min),洗脫DNA。將DNA 的洗脫液加入至離心柱中,離心(10000 r/min×1 min),于-20℃的冰箱中凍存。
1.3.2 基因甲基化檢測(cè)引物設(shè)計(jì) 利用Epidesigner軟件設(shè)計(jì)甲基化引物。檢測(cè)基因的CpG 島全序列,包括上下游添加序列。選擇軟件系統(tǒng)顯示設(shè)計(jì)的甲基化引物,在反向引物5’端添加31 個(gè)bp 大小T7 啟動(dòng)子序列CAGTAATACGACTCACTATAGGGAGAAGGCT,用于后續(xù)的體外轉(zhuǎn)錄;在正向引物5’端添加10 個(gè)bp 大小序列AGGAAGAGAG 以平衡聚合酶鏈?zhǔn)椒磻?yīng)(PCR)。擴(kuò)增產(chǎn)物長(zhǎng)度為335~491 bp。亞硫酸氫鹽修飾基因組PCR 擴(kuò)增。采用2%瓊脂糖凝膠電泳對(duì)PCR 擴(kuò)增產(chǎn)物進(jìn)行鑒定。
1.3.3 體外轉(zhuǎn)錄及堿基特異性酶切 充分混勻后封好,4℃離心(1000 r/min×1 min),PCR 儀設(shè)定程序如下:37℃,20 min →85℃,5 min → 4℃,forever。
1.3.4 芯片點(diǎn)樣及質(zhì)譜檢測(cè) 從384 孔板的裂解產(chǎn)物中抽取15 nl,加在SpectroCHlP 芯片上,于MassARRAY Compact System 上機(jī)檢測(cè)。用EpiTYPER 軟件分析MassARRAY 質(zhì)譜儀收集的質(zhì)譜圖,后進(jìn)一步進(jìn)行甲基化定量分析。基因甲基化陽(yáng)性率=基因甲基化陽(yáng)性例數(shù)/總例數(shù)×100%。
1.4 統(tǒng)計(jì)學(xué)方法 采用SPSS19.0 統(tǒng)計(jì)學(xué)軟件處理數(shù)據(jù)。計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差()表示,采用t檢驗(yàn);計(jì)數(shù)資料以率(%)表示,采用χ2檢驗(yàn)。P<0.05 表示差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 三組PAX-1 基因甲基化的表達(dá)陽(yáng)性率比較陽(yáng)性組中PAX-1 基因甲基化的表達(dá)陽(yáng)性率為96.67%(58/60),陰性組中PAX-1 基因甲基化的表達(dá)陽(yáng)性率為83.33%(50/60),對(duì)照組中PAX-1 基因甲基化的表達(dá)陽(yáng)性率為11.67%(7/60)。陽(yáng)性組中PAX-1 基因甲基化的表達(dá)陽(yáng)性率高于陰性組與對(duì)照組,且陰性組高于對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(χ2=5.926、87.306,P=0.015、0.000<0.05)。
2.2 PAX-1 基因甲基化檢測(cè)結(jié)果與宮頸癌病理特征間的關(guān)系 PAX-1 基因甲基化檢測(cè)結(jié)果與宮頸癌患者年齡、腫瘤大小、組織分化程度、FIGO 分期無(wú)關(guān)(P>0.05)。PAX-1 基因甲基化檢測(cè)結(jié)果與宮頸癌患者淋巴結(jié)轉(zhuǎn)移有關(guān)(P<0.05)。見表1。
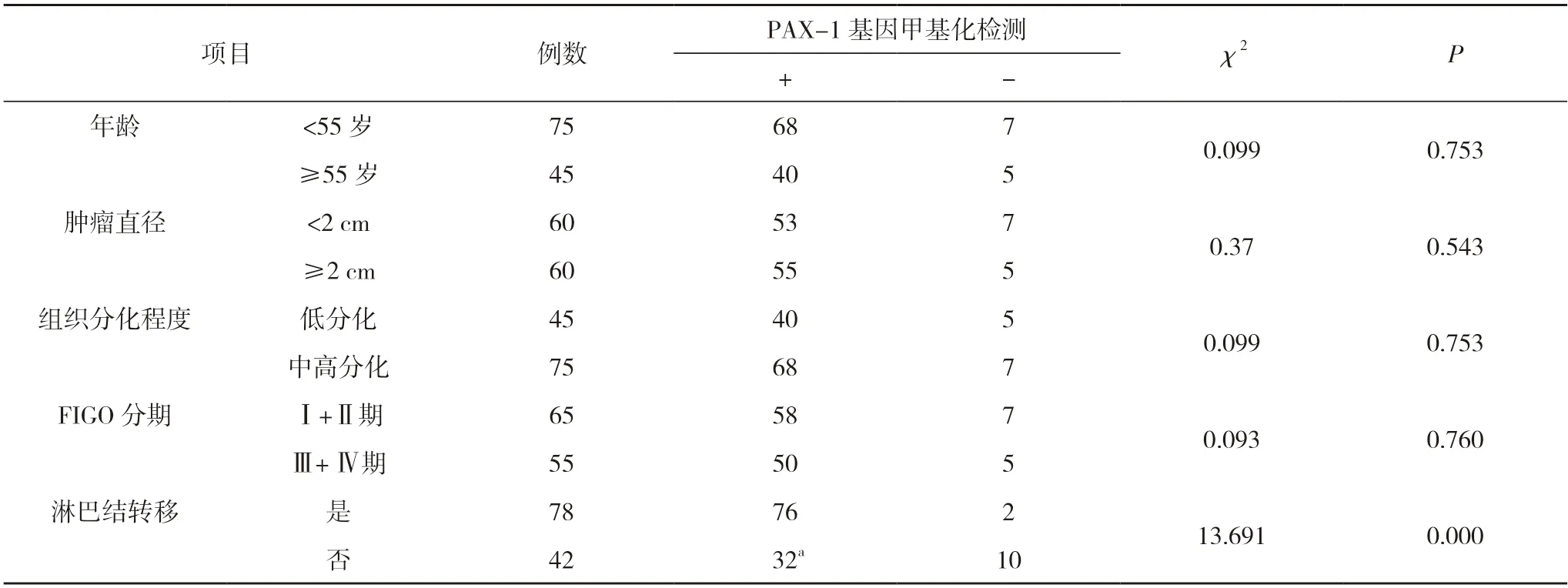
表1 宮頸癌患者PAX-1 基因甲基化檢測(cè)結(jié)果與宮頸癌病理特征的關(guān)系(n)
3 討論
宮頸癌在婦科疾病中十分常見,其發(fā)病率在女性群體中僅僅低于乳腺癌,而近年來(lái)宮頸癌的發(fā)生率還呈現(xiàn)出上升的趨勢(shì),已經(jīng)對(duì)廣大女性群體的健康造成了十分嚴(yán)重的危害。宮頸癌的預(yù)后取決于其臨床分期、分化情況,同時(shí)宮頸癌的遠(yuǎn)處轉(zhuǎn)移是造成患者預(yù)后不佳最重要的決定因素[6,7]。關(guān)于宮頸癌的發(fā)生、發(fā)展的機(jī)制目前并不明確,多認(rèn)為與基因、外界環(huán)境的共同作用有著密切的聯(lián)系。而在宮頸癌的發(fā)生發(fā)展過(guò)程中,轉(zhuǎn)移的發(fā)生是個(gè)較為漫長(zhǎng)的過(guò)程,如果能在宮頸癌診斷早期即對(duì)其轉(zhuǎn)移情況、轉(zhuǎn)移傾向作出預(yù)測(cè),這對(duì)于宮頸癌的治療、預(yù)后預(yù)測(cè)都具有十分重要的意義[8]。
作為最常見的婦科腫瘤,宮頸癌的發(fā)病原因一直倍受國(guó)內(nèi)外學(xué)者重視,1995 年,IARC 專題討論會(huì)明確指出HPV 感染是宮頸癌發(fā)生的主要原因。目前關(guān)于HPV 致宮頸病變的機(jī)制還不十分清楚,但多數(shù)學(xué)者都認(rèn)為HPV 導(dǎo)致宮頸發(fā)生病變的中心環(huán)節(jié)是HPV DNA與宮頸上皮細(xì)胞的整合。目前的研究顯示HPV DNA常常整合到第3 號(hào)和13 號(hào)染色體上,具體多定位于3p14 與13q14,而13q14 是抑癌基因Rb 基因的位點(diǎn),當(dāng)HPV 的DNA 整合到Rb 基因位點(diǎn)時(shí)有可能會(huì)使Rb基因失活從而導(dǎo)致癌癥的發(fā)生。也有研究指出除了整合到Rb 基因位點(diǎn),HPV DNA 也能整合到PAX-1 的基因位點(diǎn),PAX-1 基因是另一種抑癌基因,當(dāng)HPV DNA整合到PAX-1 位點(diǎn)時(shí)能夠促進(jìn)其正常表達(dá)量減少?gòu)亩掳?]。
其中基因的甲基化是一種減少正常表達(dá)量的重要機(jī)制,在DNA 的復(fù)制和修復(fù)中,DNA 甲基化可以保持細(xì)胞原有的信息;DNMT3A 和DNMT3B 的主要功能是催化未發(fā)生甲基化的CpG 雙核苷酸從頭甲基化。富含CpG 位點(diǎn)的區(qū)域形成CpG 島,CpG 島存在于大量的重復(fù)序列中(如逆轉(zhuǎn)錄轉(zhuǎn)座子和端粒DNA)和大約 60%基因的啟動(dòng)子中[9]。重復(fù)序列中CpG 島的甲基化對(duì)于維持染色體穩(wěn)定性具有重要意義,絕大部分CpG 島的甲基化模式在正常生長(zhǎng)發(fā)育過(guò)程中保持不變,但是存在部分CpG 島在發(fā)育過(guò)程中發(fā)生改變,例如生長(zhǎng)發(fā)育中的基因組印記和X 染色體失活。目前對(duì)在不含CpG島的啟動(dòng)子中的DNA 甲基化的認(rèn)識(shí)水平還十分有限。研究顯示,腫瘤細(xì)胞中DNA 甲基化修飾存在明顯改變,表現(xiàn)為抑癌基因局部區(qū)域 CpG 島高甲基化造成其表達(dá)沉默,此外全基因組DNA 低甲基化造成染色體結(jié)構(gòu)穩(wěn)定性降低,逆轉(zhuǎn)錄轉(zhuǎn)座子、原癌基因的激活[10]。一項(xiàng)研究報(bào)道稱,通過(guò)對(duì)比分析正常組織和結(jié)腸癌組織的DNA 甲基化水平,結(jié)果顯示結(jié)腸癌組織的DNA CpG 島的甲基化明顯上升[11]。
本研究分析HPV 陽(yáng)性的宮頸癌患者的PAX-1 基因甲基化情況發(fā)現(xiàn),陽(yáng)性組中PAX-1 基因甲基化的表達(dá)陽(yáng)性率高于陰性組與對(duì)照組,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。PAX-1 基因甲基化檢測(cè)結(jié)果與宮頸癌患者淋巴結(jié)轉(zhuǎn)移有關(guān)(P<0.05)。
綜上所述,PAX-1 基因甲基化在宮頸癌組織中呈高表達(dá)狀態(tài),而在HPV 陽(yáng)性宮頸癌中表達(dá)呈更高狀態(tài),通過(guò)對(duì)PAX-1 基因甲基化水平的檢測(cè)可以指導(dǎo)臨床診斷、治療宮頸癌。
 中國(guó)現(xiàn)代藥物應(yīng)用2022年9期
中國(guó)現(xiàn)代藥物應(yīng)用2022年9期
- 中國(guó)現(xiàn)代藥物應(yīng)用的其它文章
- 右美托咪定對(duì)于膿毒癥患者肝肺等重要器官的保護(hù)作用研究進(jìn)展
- 彩色多普勒超聲對(duì)肝血管瘤的診斷價(jià)值分析
- 不同濃度的A-PRF 膜萃取液對(duì)人牙齦成纖維細(xì)胞增殖及OPG 表達(dá)的影響
- RASSF1 基因表達(dá)水平與肝癌的相關(guān)性及對(duì)細(xì)胞生理活動(dòng)的作用
- 規(guī)范化運(yùn)動(dòng)干預(yù)應(yīng)用于老年高血壓患者的臨床價(jià)值分析
- 某三甲醫(yī)院手術(shù)科室圍術(shù)期蛇毒血凝酶的應(yīng)用合理性調(diào)查
