68例年齡≥70歲乳腺癌患者術后接受輔助化療的安全性分析
呂劍虹,李俏,張金濤,侯立杰,楊陽,馮華超
1北京市朝陽區三環腫瘤醫院內科,北京 100122
2國家癌癥中心/國家腫瘤臨床醫學研究中心/中國醫學科學院北京協和醫學院腫瘤醫院內科,100021
乳腺癌是嚴重威脅中國女性生命健康的惡性腫瘤之一,2020年,乳腺癌新發病例已超越肺癌,達230萬例,發病率居所有惡性腫瘤首位,約為11.7%[1]。年齡是乳腺癌的最重要危險因素,據統計,超過30%的乳腺癌患者的發病年齡超過70歲,且隨著人類平均壽命的增長,老年乳腺癌患者的發病率和病死率日趨升高[2-3]。與年輕患者相比,老年乳腺癌患者的臨床癥狀有其獨特之處,如老年乳腺癌的生物學特性較好,雌激素受體(estrogen receptor,ER)和孕激素受體(progesterone receptor,PR)陽性率高,人表皮生長因子受體2(human epidermal growth factor receptor 2,HER2)陽性率低,表現為腫瘤進展慢、低增殖、侵襲能力弱等特點。上述因素使臨床是否對老年乳腺癌患者進行輔助化療一直存在較大爭議,特別是目前絕大多數輔助化療相關的臨床試驗的納入、排除標準中均排除了年齡≥70歲的患者,因此,有必要對年齡≥70歲患者的輔助化療資料進行分析和總結,以期指導臨床實踐。本研究分析年齡≥70歲、術后接受輔助化療的乳腺癌患者的臨床特征以及輔助化療的耐受性和安全性,現報道如下。
1 資料與方法
1.1 一般資料
選取2011年11月至2020年11月北京市朝陽區三環腫瘤醫院收治的年齡≥70歲術后接受輔助化療的乳腺癌患者。納入標準:①均經中國醫學科學院北京協和醫學院腫瘤醫院病理科確診為乳腺癌;②HER2表達陽性指,免疫組化顯示HER2(+++)或熒光原位雜交實驗證實存在HER2基因擴增;③均為女性,年齡≥70歲;④術后接受輔助化療;⑤病歷資料完整,如一般資料、合并癥、實驗室檢查結果、病理類型、臨床分期、受體表達情況、化療方案及劑量、不良反應發生情況。排除標準:①合并其他原發腫瘤;②合并嚴重心、肝、腎功能不全;③術前影像學檢查結果提示存在可疑遠處轉移。依據納入和排除標準,本研究共納入68例乳腺癌患者,年齡70~79歲,中位年齡72歲。本研究經醫院倫理委員會批準通過,所有患者均知情同意并簽署知情同意書。
1.2 治療方案
所有患者均接受手術治療,其中55例患者行乳腺癌改良根治術,9例患者行保乳手術+前哨淋巴結活檢術,3例患者行單純乳腺切除術+前哨淋巴結活檢術,1例隱匿型乳腺癌患者行腋窩淋巴結清掃術。25例患者術后接受放療,包括5例保乳手術患者,20例乳腺癌改良根治術后合并腋窩淋巴結轉移患者(其中3例患者腫瘤直徑≥5 cm,16例患者腋窩淋巴結≥4個,1例為三陰性乳腺癌患者且淋巴結轉移3個)。所有患者均接受術后輔助化療,包括蒽環類化療方案22例,其中環磷酰胺+表柔比星或吡柔比星序貫紫杉醇+曲妥珠單抗1例,環磷酰胺+表柔比星或吡柔比星序貫紫杉醇8例,環磷酰胺+表柔比星3例,表柔比星+紫杉醇10例;非蒽環類化療方案46例,其中多西他賽+卡鉑+曲妥珠單抗3例,紫杉醇/多西他賽+卡鉑18例,多西他賽/紫杉醇+環磷酰胺15例,紫杉醇+曲妥珠單抗5例,紫杉醇單藥4例,卡培他濱單藥1例。41例ER和(或)PR表達陽性患者接受芳香化酶抑制劑治療。
1.3 不良反應評價標準
采用美國國家癌癥研究所常見不良反應事件評價標準(National Cancer Institute common toxicity criteria,NCICTC)4.0評估患者的不良反應發生情況。
1.4 隨訪
采用電話隨訪的方式對患者進行隨訪,隨訪8~96個月,中位隨訪37個月,隨訪時間截至2021年12月,以疾病復發、遠處轉移、死亡為隨訪終點,記錄患者的生存及復發情況,無失訪患者。無病生存期(disease-free survival,DFS)指手術日起至腫瘤首次復發轉移時間或因其他原因死亡的時間,疾病復發包括局部復發、區域性復發、遠處轉移、任何原因導致的死亡,以最先出現的時間為準,復發風險分級根據《中國抗癌協會乳腺癌診治指南與規范(2021年版)》[4];總生存期(overall survival,OS)指手術當日至任何原因導致死亡的時間或末次隨訪的時間。
1.5 統計學方法
采用SPSS 19.0軟件對所有數據進行統計分析,計量資料以均數±標準差(±s)表示;計數資料以例數和率(%)表示,組間比較采用χ2檢驗;采用Kaplan-Meier法繪制生存曲線,組間比較采用Logrank檢驗;以P﹤0.05為差異有統計學意義。
2 結果
2.1 臨床特征
68例乳腺癌患者均為女性,年齡70~79歲,中位年齡72歲;美國東部腫瘤協作組(Eastern Cooperative Oncology Group,ECOG)體力狀況(performance status,PS)評分:0分10例,1分58例;合并癥:高血壓36例,糖尿病17例,冠心病8例;以乳腺腫物為首發癥狀58例,體檢發現4例,乳腺皮膚呈橘皮樣改變3例,乳頭溢液3例;病理類型:浸潤性導管癌61例,浸潤性小葉癌4例,其他3例;美國癌癥聯合委員會(American Joint Committee on Cancer,AJCC)第 7版臨床分期[5]:Ⅰ期 8例,Ⅱ期 22例,Ⅲ期38例;組織學分型:Luminal型41例(其中Luminal B型HER2陽性6例),HER2過表達型9例,三陰性乳腺癌18例;N分期:N0期16例,N1期(1~3個淋巴結轉移)22例,N2期(4~9個淋巴結轉移)20例,N3期(≥10個淋巴結轉移)10例;脈管內癌栓30例;神經侵犯15例;危險程度分級:高危41例,中危27例,低危0例。
2.2 輔助化療完成情況
68例乳腺癌患者中,按計劃完成化療63例,中斷化療5例(僅治療1個周期即中斷化療3例,治療2個周期后中斷化療2例;化療中斷原因:骨髓抑制不能耐受3例,房顫1例,下肢靜脈血栓1例)。68例乳腺癌患者化療周期為1~12個,中位化療周期6個,按所有化療周期計算,紫杉醇的標準劑量強度(dose intensity,DI)為每周58.3 mg/m2,實際DI為每周(56.1±2.7)mg/m2,相對劑量強度(relative dose intensity,RDI)為96.2%;多西他賽的標準DI為每周25 mg/m2,實際DI為每周(24.6±1.49)mg/m2,RDI為95.8%;表柔比星的標準DI為每周25 mg/m2,實際DI為每周(24.6±1.49)mg/m2,RDI為95.8%。13例患者因不良反應減量和延遲化療,其中2例患者因Ⅱ級肝功能減退減量,11例患者因Ⅲ~Ⅳ級骨髓抑制減量;12例患者減量20%,1例患者累計減量40%(2次減量);7例因骨髓抑制延遲化療,2例因肝功能減退延遲化療,延遲時間5~7天。
2.3 不良反應發生情況
老年乳腺癌患者輔助化療導致的血液學毒性主要表現為中性粒細胞減少和白細胞減少,對血小板的影響較小;非血液學毒性主要表現為不同程度的惡心嘔吐、肝功能損傷、周圍神經毒性和心臟毒性;均未出現非預期的不良反應和不良反應相關死亡。68例患者中9例患者接受了曲妥珠單抗聯合化療,1例患者出現心電圖改變,1例患者出現心律失常,無左室射血分數(left ventricular ejection fraction,LVEF)下降﹥10的患者。(表1)
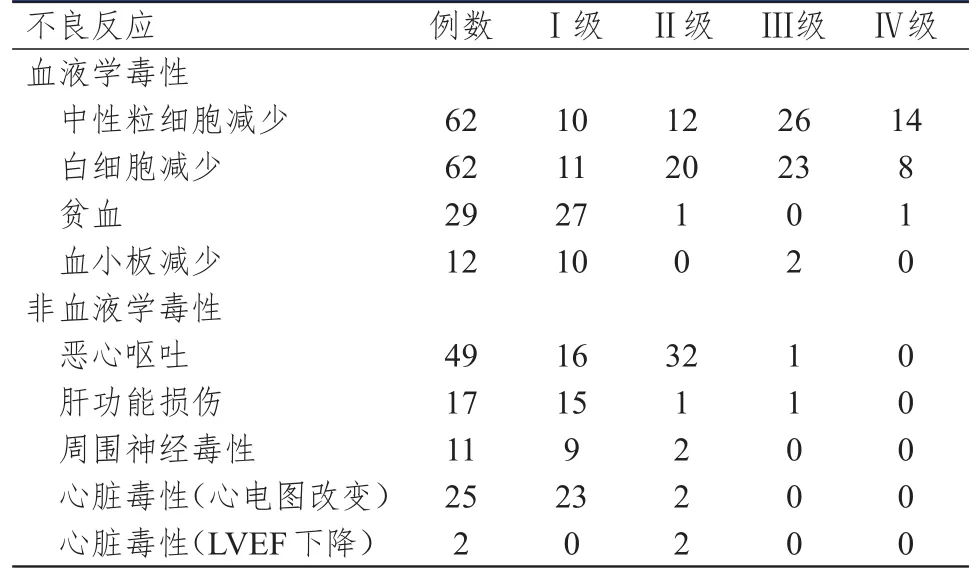
表1 乳腺癌患者術后輔助化療的不良反應發生情況
2.4 蒽環類化療方案與非蒽環類化療方案不良反應發生情況的比較
68例乳腺癌患者中,蒽環類化療方案22例,非蒽環類化療方案46例,不同化療方案患者血液學毒性比較,差異均無統計學意義(P﹥0.05);非血液學毒性方面,蒽環類化療方案患者Ⅱ~Ⅲ級惡心嘔吐、心電圖改變發生率均明顯高于非蒽環類化療方案患者,差異均有統計學意義(P﹤0.01)。(表2)
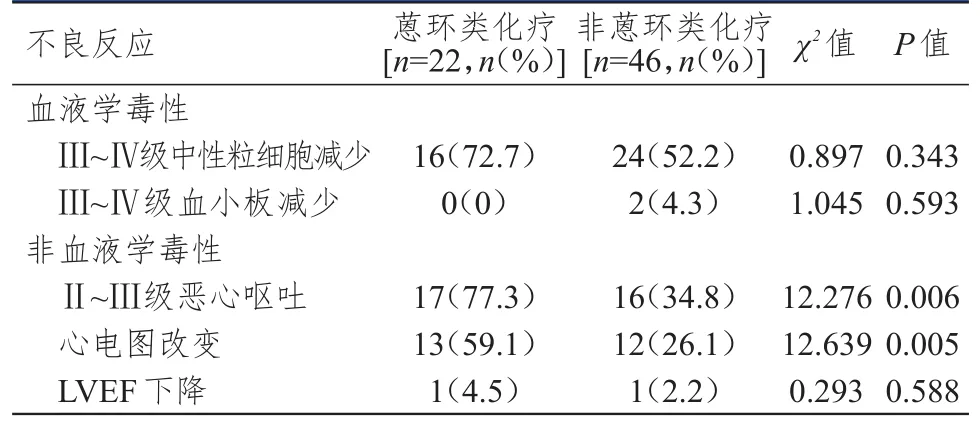
表2 蒽環類化療方案與非蒽環類化療方案患者不良反應發生情況的比較
2.5 預后生存情況的比較
68例乳腺癌患者隨訪8~96個月,中位隨訪37個月,復發轉移19例(1例局部復發;17例轉移;1例同時存在局部復發和轉移,轉移部位按順序排列);死亡16例,均為腫瘤相關性死亡,所有患者均未達到中位DFS和OS,2年無病生存率、2年總生存率分別為83.5%、94.1%(圖1、圖2)。中斷化療的5例乳腺癌患者隨訪期間均未出現復發轉移及死亡;13例化療減量患者中,復發轉移3例,死亡3例;化療未減量的55例患者中,復發轉移15例,死亡13例;化療中斷與化療未中斷患者2年無病生存率及2年總生存率比較,差異均無統計學意義(P﹥0.05);化療減量與未減量患者2年無病生存率及2年總生存率比較,差異均無統計學意義(P﹥0.05)。
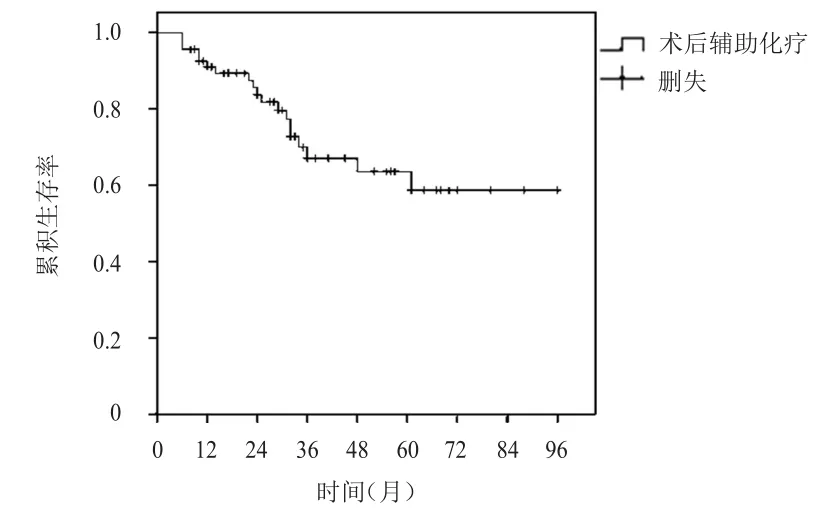
圖1 68例年齡≥70歲術后接受輔助化療的乳腺癌患者的DFS曲線
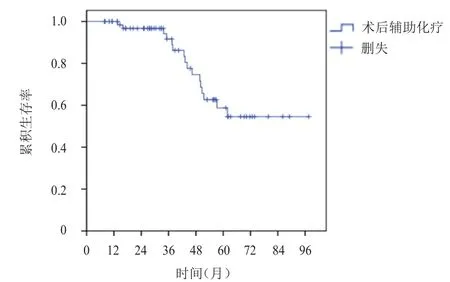
圖2 68例年齡≥70歲術后接受輔助化療的乳腺癌患者的OS曲線
3 討論
老年乳腺癌患者常合并心腦血管疾病、糖尿病、高血壓等基礎疾病,對化療不良反應心存恐懼,對生存的預期下降,且由于經濟壓力及家庭負擔較重,老年乳腺癌患者接受抗腫瘤治療的意愿較差。但隨著年齡的增長,乳腺癌的發病風險顯著提高,老齡化使老年乳腺癌的發病例數顯著升高[6]。研究顯示,30%以上的乳腺癌新發病例為70歲以上的老年患者,與年輕患者相比,老年乳腺癌患者的組織學分級和HER2表達水平均較低,激素受體表達水平相對較高,腫瘤細胞增殖指數較低[7]。但老年患者的治療意識不強,早診早治率不高,就診時腫瘤體積已經較大、臨床分期偏晚,老年患者接受規范抗腫瘤治療的比例降低,使老年乳腺癌患者的病死率更高,預后更差。Reddy等[8]回顧性分析139例≥70歲乳腺癌患者的病歷資料,結果顯示,腔隙型(Luminal型)、HER2過表達型及三陰性乳腺癌患者的比例分別為79%、12%和9%,其中40%的老年患者腋窩淋巴結陽性,但只有16%的患者接受了術后輔助化療,35%的HER2陽性患者接受了曲妥珠單抗輔助治療,因此,盡管所有激素受體陽性患者均接受了內分泌治療,但輔助化療和靶向治療不足也導致老年患者的2年總生存率低于50~69歲患者(86%vs92%,P=0.047)。隨著抗腫瘤藥物和緩和醫療的發展,化療的療效和安全性不斷提高,重新評價老年乳腺癌患者輔助化療的安全性和耐受性,對提高老年乳腺癌患者對治療的信心、改善預后至關重要。
本研究共納入68例≥70歲的乳腺癌術后患者,其中36例合并高血壓,17例合并糖尿病,8例合并冠心病,但患者一般情況良好,ECOG PS評分均為0~1分,化療前的血常規和肝腎功能大致正常。紫杉類和蒽環類化療藥物的初始RDI均超過標準RDI的95%,絕大多數患者(63/68,92.6%)完成輔助化療,僅13例患者因不良反應減量,僅1例患者2次減量,7例因骨髓抑制而延遲化療,2例因肝功能減退而延遲化療,5例患者因不良反應而中斷治療。化療中斷的5例患者隨訪期間均未出現復發轉移及死亡;化療減量的13例患者中,3例患者出現復發轉移,3例死亡;未減量的55例患者,15例患者出現復發轉移,13例死亡。既往研究表明,減量后化療劑量RDI的降低會對DFS、OS造成影響[9],本研究發現,化療中斷與化療未中斷患者2年無病生存率及總生存率比較,化療減量與未減量患者2年無病生存率及總生存率比較,差異均無統計學意義(P﹥0.05),這可能與隨訪時間短、樣本量少有關。本研究結果顯示一般狀況良好的老年患者即使合并其他疾病,絕大多數患者也可以耐受輔助化療。
多項研究結果證實,曲妥珠單抗術后輔助治療1年可以顯著改善HER2陽性早期乳腺癌患者的預后,但曲妥珠單抗可以提高心力衰竭的發生率[10-11]。兩項針對HER2陽性早期老年乳腺癌患者的回顧性研究顯示,接受曲妥珠單抗聯合化療患者的4年無病生存率和總生存率均為99%,心臟毒性僅為3.2%;與多柔比星化療方案相比,紫杉類化療方案的不良反應更輕微,患者的耐受性更好[12-13]。本研究68例患者中HER2陽性15例,其中9例患者接受了曲妥珠單抗聯合化療,1例患者出現心電圖改變,1例患者出現心律失常,無LVEF下降﹥10的患者,無心臟毒性引起的相關死亡。
本研究中最常見的Ⅲ~Ⅳ級不良反應為血液學毒性,表現為中性粒細胞減少和白細胞減少,非血液學毒性主要為惡心嘔吐和心電圖改變。所有患者均未出現非預期的不良反應和化療相關性死亡。本研究結果顯示,蒽環類化療方案患者Ⅱ~Ⅲ級惡性嘔吐、心電圖改變發生率均明顯高于非蒽環類化療方案患者,差異均有統計學意義(P﹤0.01)。
術后輔助化療可提高乳腺癌患者的生存率,降低復發率和病死率,但目前尚缺乏大規模隨機臨床研究來證明化療在老年患者中的作用,對于老年患者輔助化療的方案、劑量及療程也沒有明確的指南推薦[2]。SEER的數據顯示,輔助化療可以降低約15%激素受體表達陰性的老年乳腺癌患者的病死率,其中,淋巴結陽性、高分化和腫瘤直徑較大的患者從輔助化療中獲益最多,推薦老年患者采用蒽環類和(或)紫杉類藥物化療[14]。本研究68例患者中,Ⅲ期患者約占60%,三陰性乳腺癌患者占比超過25%。說明預后仍是影響患者是否選擇輔助化療最重要的影響因素,患者的2年總生存率為94.1%,不低于文獻報道的50~69歲的乳腺癌患者(總生存率為92.0%),表明對于分期較晚及分型較差的老年乳腺癌患者術后接受輔助化療仍能在一定程度上改善患者的生存情況。
本研究68例患者按危險程度分級,均為中高危患者,包括高危41例,中危患者27例,中危患者中7例為三陰性乳腺癌,6例患者為HER2(+),3例患者為T1CN0M0期、激素受體(+)HER2(-)、Ki-67指數均﹥50%,這3例患者的手術時間為2016—2017年,ER、PR雖有表達但表達率較低(﹤20%),考慮內分泌化療獲益不明顯,與患者充分溝通后給予化療;剩余11例患者均存在1~3個淋巴結轉移,腫瘤直徑﹥2 cm,部分﹥5 cm,或合并脈管內癌栓、神經侵犯等高危因素,與患者溝通后給予化療。因本研究為回顧性研究,當時21基因檢測等費用或可及性部分患者不能接受,按2021年美國國立綜合癌癥網絡(National Comprehensive Cancer Network,NCCN)指南[15]及中國抗癌協會乳腺癌診治指南與規范[4],1~3個淋巴結轉移的Luminal型患者,若基因檢測為低危,可豁免化療。
綜上所述,隨著生活及醫學水平的提高,老年患者預期壽命不斷延長,年齡不應該成為決定老年患者是否接受輔助化療的關鍵因素,本研究結果顯示一般狀況良好的老年患者對術后輔助化療的安全性和耐受性良好,臨床上應根據老年患者的臨床特征、復發轉移風險、預期壽命、合并的基礎疾病等來制訂個體化治療方案,旨在為患者帶來臨床獲益并最大程度地規避治療風險。

