抗生素暴露對小鼠腸道菌群的改變及結腸黏膜屏障功能的影響*
楊 夏,呂自力,肖 娟,王永才,陳秀奇,黃 婷,單慶文Δ
(廣西醫科大學第一附屬醫院 1.兒科;2.病理科,南寧 530021;3.廣西壯族自治區水產科學研究院,南寧 530021)
抗生素自發現以來被廣泛應用于多種致命的細菌感染性疾病中,如霍亂、傷寒、流行性腦脊髓膜炎和結核病等。但臨床上不規范使用抗生素現象日趨普遍,抗生素濫用的弊端隨之產生。越來越多的研究發現,抗生素的不規范使用與許多腸道相關疾病或腸道外疾病存在關聯,如抗生素相關性腸黏膜損傷、炎癥性腸病、結直腸癌、哮喘和糖尿病等[1-3]。
抗生素相關性腸黏膜損傷是指臨床上不規范應用抗生素后出現的一種常見不良反應。患者臨床表現大多較輕,表現為腹痛、嘔吐或腹瀉,暫停使用抗生素后癥狀可有不同程度的恢復。部分患者臨床表現較重,可有脫水、電解質紊亂等表現,嚴重者出現偽膜性結腸炎或中毒性巨結腸,短期內較難自行恢復或無法恢復,甚至出現腸穿孔或死亡[4]。健康人群擁有完整的腸道黏膜屏障系統,防止微生物入侵后造成的腸黏膜損傷。腸黏膜屏障系統主要由黏液屏障、腸上皮屏障、免疫屏障和微生物屏障組成。使用抗生素后,腸道內細菌群落穩態失衡,腸道黏膜屏障可能會受到損傷,細菌有可能侵入黏膜層,引發免疫效應[5]。因此,本研究通過抗生素連續灌胃誘導小鼠菌群紊亂,探討抗生素的使用對小鼠腸道黏膜屏障和微生物群落的影響。
1 材料與方法
1.1 實驗動物 選取32只雄性C57BL/J小鼠,5周齡,體重16~20 g。在22~25℃、12 h的光暗周期下,小鼠自由獲取水和食物,適應性喂養1周后進行實驗。所有動物實驗程序均獲得廣西醫科大學倫理委員會批準。
1.2 實驗分組及處理 所有小鼠適應性飼養1周后,隨機分為2組(n=16),分別為:(1)對照組(N組),生理鹽水200μL/只/d,1次/d,灌胃7 d;(2)抗生素組(M組),抗生素混合液200μL/只/d,1次/d,連續灌胃7 d。抗生素混合液配制方案參照既往文獻[6],具體如下:甲硝唑(1 mg/mL)、氨芐青霉素(1 mg/mL)、新霉素(1 mg/mL)、慶大霉素(1 mg/mL)和萬古霉素(0.5 mg/mL)。
1.3 組織取材和處理 實驗期間每天記錄小鼠的精神狀態、體重和糞便性狀,計算糞便含水量,含水量計算公式如下:糞便含水量(%)=(糞便濕重-糞便干重)/糞便濕重×100%。實驗結束時,麻醉小鼠,眼球取血后處死,采集小鼠結腸、盲腸組織,按盲腸數=盲腸重量(mg)/小鼠體重(mg)公式計算盲腸指數并統計結腸長度。取部分結腸組織為PCR實驗做準備,剩余結腸組織放入4%組織固定液中,制作石蠟切片。
1.4 小鼠結腸組織蘇木精—伊紅(HE)染色 結腸組織收集于4%組織固定液中,石蠟包埋,切片為4μmol/L,二甲苯脫蠟、不同濃度酒精溶液中水化(無水酒精→90%→80%→70%),進行HE染色,在光學顯微鏡下觀察結腸組織病理學改變并拍片。
1.5 小鼠結腸組織黏蛋白2(MUC2)蛋白免疫組織化學染色 制作好的石蠟切片脫蠟,水化,高壓抗原熱修復,內源性過氧化物酶失活,封閉非特異性抗原,之后加入MUC2一抗(按1∶2 000稀釋,購于美國Proteintech公司),4℃過夜。次日加入生物素二抗工作液(1∶200),DAB顯色后,用蘇木精染液復染,脫水后封片,顯微鏡下觀察拍照。用Image-Pro Plus 6.0圖像軟件計算MUC2的平均光密度值。
1.6 RT-qPCR檢測小鼠結腸組織MUC2、白介素-10(IL-10)、腫瘤壞死因子-α(TNF-α)和白介素-1β(IL-1β)mRNA的表達 將各組小鼠結腸組織,加入500μL Nuclezol試劑,用研磨儀研磨,提取各組小鼠結腸組織總RNA。測定濃度后,將RNA逆轉錄為cDNA。后續以cDNA為模板對IL-10、MUC2、TNFα和IL-1β進行擴增,PCR反應條件:95℃預變性30 s;95℃變性10 s,60℃退火、延伸30 s,共 40個循環;添加熔解曲線:95℃15 s,60℃60 s,95℃15 s,以GAPDH為內參,引物序列見表1。

表1 PCR引物序列5’~3’
1.7 ELISA檢測血漿二胺氧化酶(DAO)和D-乳酸(D-LA)表達水平 實驗結束后,收集外周血,離心,收集上清,嚴格按ELISA試劑盒(購自武漢華美生物工程有限公司)說明書方法進行DAO和D-LA含量的檢測。
1.8 16SrRNA腸道菌群測序分析 按照文獻的方法[7],提取小鼠糞便總微生物基因組DNA樣品后針對細菌的V3+V4可變區序列設計引物進行PCR擴增,擴增后使用Illumina公司建庫試劑盒構建文庫并質檢,對該文庫使用NovaSeq 6000 PE250平臺上進行測序及分析(深圳微科盟科技集團有限公司)。
1.9 統計學方法 采用Graphpad 7.0統計分析軟件處理數據。計量資料數據以均數±標準差()表示,組間比較采用t檢驗,以P<0.05為差異具有統計學意義。
2 結果
2.1 小鼠一般情況觀察 N組小鼠精神活動、攝食、飲水正常,糞便呈棕褐色干燥成形大便。M組小鼠精神狀態欠佳,糞便呈棕黃色,顆粒濕潤。兩組小鼠體重變化趨勢一致(P>0.05)。與N組相比,M組小鼠糞便含水量升高(P<0.05),見圖1。
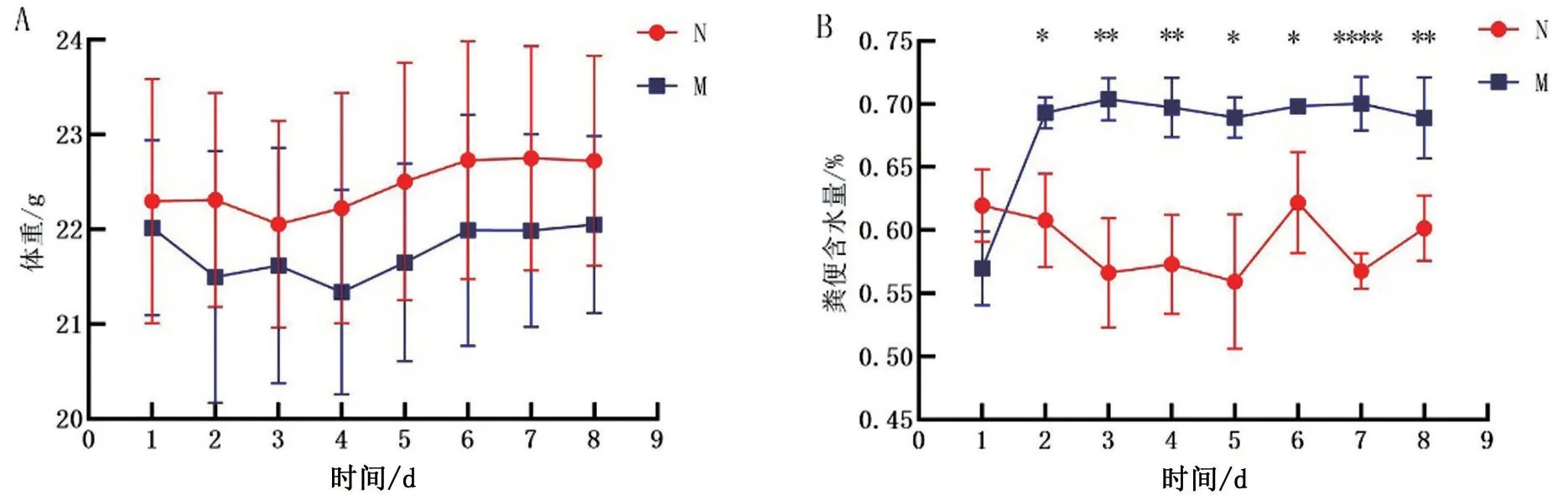
圖1 小鼠體重和糞便含水量的對比
2.2 兩組小鼠結腸和盲腸的變化比較 與N組相比,M組小鼠的結腸縮短(P<0.05)。與N組相比,M組小鼠離體前和清洗內容物后均可看見盲腸明顯脹大,盲腸指數增大(P<0.05),見圖2。
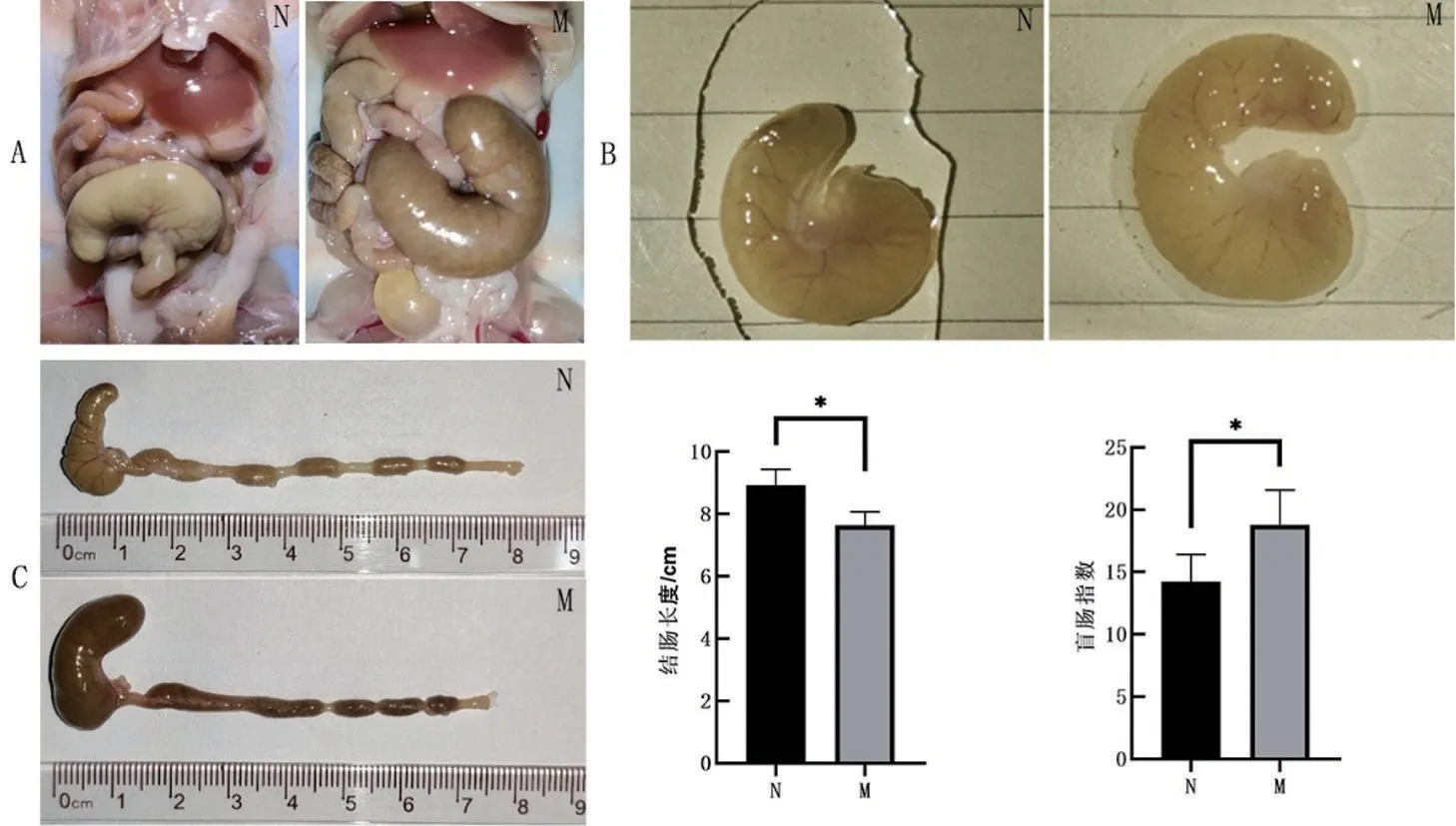
圖2 小鼠結腸長度和盲腸大小的對比
2.3 兩組小鼠的結腸組織病理學形態比較 N組小鼠結腸組織結構完整均勻,腸腺豐富排列規則,隱窩結構形態正常,未見明顯炎癥現象。與N組相比,M組小鼠有明顯腸黏膜受損,表現為上皮完整性破壞,結腸腺體結構紊亂,部分腺體高度、密度下降,隱窩結構萎縮,黏膜下層可見明顯水腫,黏膜及黏膜下層較多炎性細胞浸潤,見圖3。

圖3 小鼠結腸組織病理學形態對比(HE)
2.4 小鼠結腸組織中MUC2 mRNA和蛋白表達情況 M組小鼠結腸組織中MUC2蛋白的陽性細胞數較N組小鼠結腸中MUC2的陽性細胞數少,M組小鼠MUC2mRNA表達降低,MOD值較N組小鼠降低(P<0.01),見圖4。

圖4 抗生素給藥對小鼠結腸組織中MUC2 mRNA和蛋白表達的影響
2.5 兩組小鼠結腸組織中IL-1β、TNF-α和IL-10的表達情況 與N組相比,M組小鼠結腸組織中促炎因子IL-1β和TNF-αmRNA表達水平升高(P<0.01)。與N組相比,M組小鼠結腸組織中免疫調節因子IL-10mRNA表達水平降低(P<0.05),見圖5。
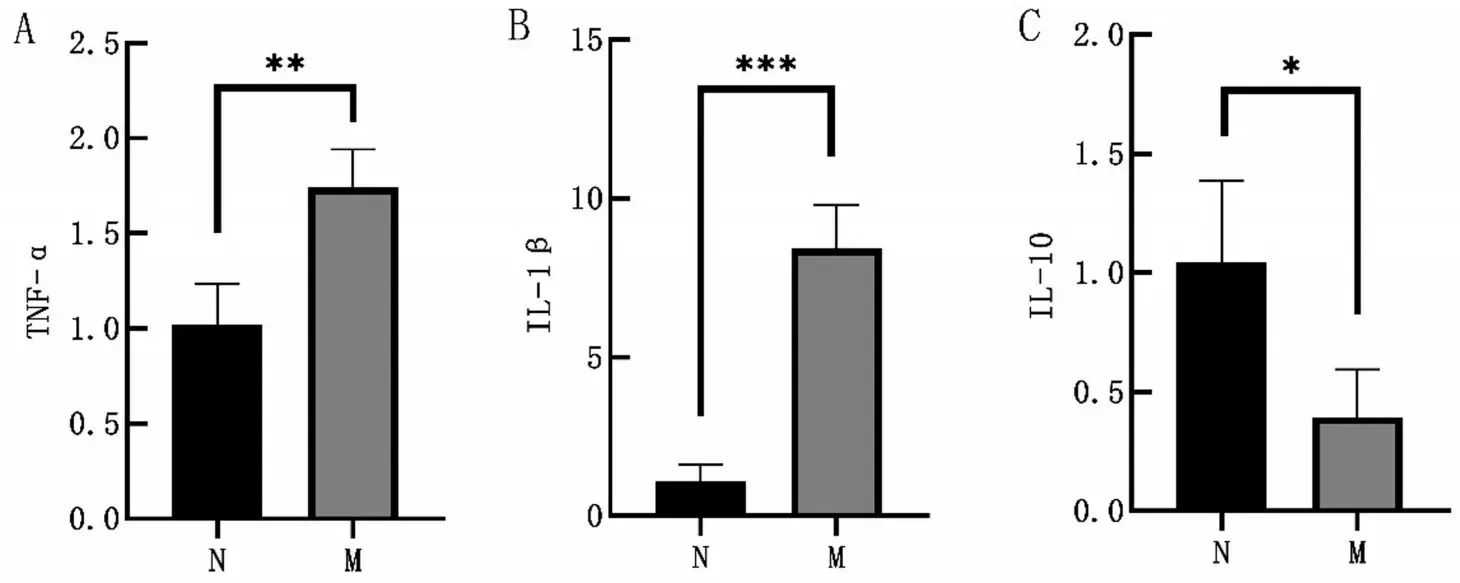
圖5 小鼠結腸組織中TNF-α、IL-1β和IL-10 mRNA表達對比
2.6 各組小鼠外周血中二胺氧化酶(DAO)和D-乳酸(D-LA)含量對比 M組小鼠的外周血中DAO含量較N組升高(P<0.05),M組小鼠外周血中D-LA含量與N組比較,差異無統計學意義(P>0.05),見圖6。

圖6 小鼠外周血中DAO和D-LA含量對比
2.7 各組小鼠腸道菌群分析 由圖7A可知,各樣本的曲線趨向平緩,說明測序深度足以反應菌群結構真實狀況,可進行后續的數據分析。圖7B可以看出,M組小鼠的Shannon指數、Chao1指數和Observed OTU指數均小于N組(P<0.05)。說明M組小鼠菌群Alpha多樣性低于N組。門和屬水平腸道菌群豐度柱狀分別見圖7C和7D,可以看出兩組小鼠菌群組成存在較大的差異,門水平上,M組小鼠中擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)和放線菌門(Actinobacteria)的相對豐度較N組降低,而疣微菌門(Verrucomicrobia)、變形菌門(Proteobacteria)的相對豐度明顯高于N組。圖7D的DESeq2火山圖分析可以發現M組和N組小鼠中差異的菌屬,其中M組中S24_7、普雷沃氏菌屬(Prevotella)、擬桿菌屬(Bacteroides)和異桿菌屬(Allobaculum)等腸道菌屬的相對比例較N組下降(P<0.05),副擬桿菌屬(Parabacteroides)、克雷伯氏肺炎菌屬(Klebsiella)、腸桿菌屬(Enterobacter)、阿克曼氏菌屬(Akkermansia)、變形桿菌屬(Proteus)和埃希式菌屬(Escherichia)等腸道菌屬的相對比例高于N組(P<0.05)。為了研究抗生素暴露后腸道微生物組的功能,本研究使用PICRUSt軟件預測抗生素暴露后的功能改變,圖7E的KEGG L2水平功能預測柱狀圖表明,兩組小鼠代謝功能組成不同,PCA分析圖同樣說明兩組菌群的代謝功能預測存在明顯差異。Dunn test檢驗后發現,在KEGG通路中的代謝(Metabolism),生物系統(Organismal Systems)和人類疾病(Human Diseases)在兩組間比較差異有統計學意義(P<0.05)。
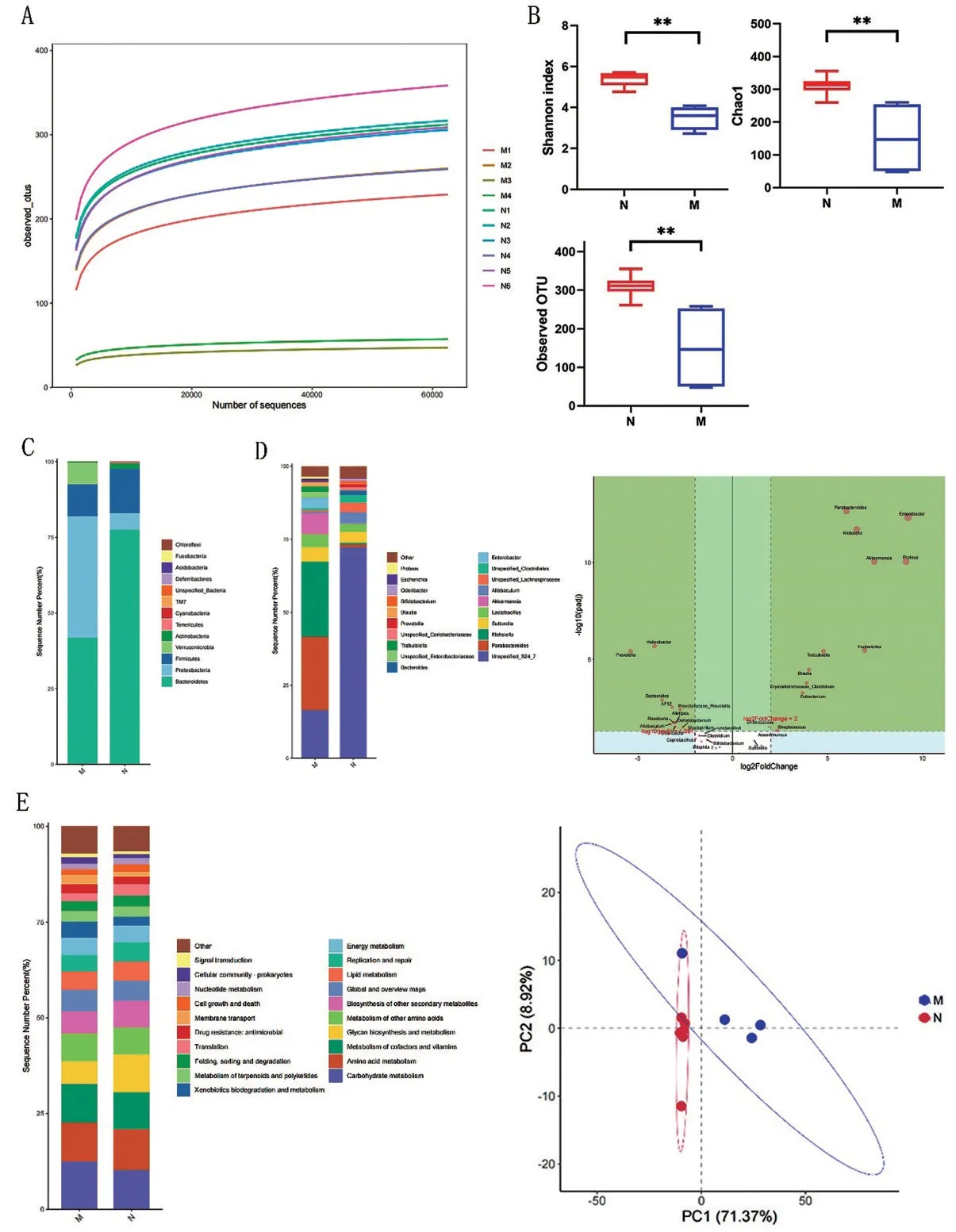
圖7 各組小鼠腸道菌群16SrRNA測序分析結果對比
3 討論
本研究發現,M組小鼠的精神狀態較N組差,糞便含水量較N組增多,提示M組小鼠腸道出現損傷。研究證明,變大的盲腸是腸道菌群紊亂小鼠和無菌小鼠的典型表現[8],本研究亦觀察到M組小鼠的盲腸增大,與既往研究結果相一致。此后進行的腸道菌群測序分析結果說明抗生素暴露可致小鼠的腸道生物屏障破壞,即菌群穩態失調,其主要表現為菌群多樣性降低,與活動性結腸炎的鑒別性微生物譜系的升高(變形桿菌、腸桿菌、肺炎克雷伯菌、腸桿菌和阿克曼氏菌等菌屬)和與結腸炎緩解有關支系的減少(S24-7和擬桿菌等菌屬)[9]。有研究報道,變形桿菌屬(Proteus)和克雷伯氏肺炎菌屬(Klebsiella)的存在與小鼠的潰瘍性結腸炎(UC)發展有關,UC小鼠與野生鼠共飼養時,野生鼠也會發展為結腸炎[10]。也有研究報道,結腸炎治療后小鼠中S24-7豐度則會恢復至更高的水平,且S24-7的豐度與盲腸的丁酸鹽的水平呈正相關關系[11]。說明腸道內菌群的結構組成變化和結腸炎癥損傷密切相關,此后的功能預測顯示兩組小鼠KEGG代謝通路中代謝、生物系統和人類疾病存在顯著性差異,也間接說明小鼠菌群的紊亂使得某些代謝通路發生改變,可能與生物代謝過程和人類疾病相關。
小鼠結腸表面有一層厚的黏液層,覆蓋在結腸上皮層表面,防止微生物的入侵。MUC2是腸道黏液屏障的最主要蛋白。研究證實,MUC2基因敲除小鼠可出現腹瀉、結直腸脫垂、腸道炎癥、自發性結腸炎和結腸癌風險增加等表現[12]。當小鼠腸道菌群發生紊亂,某些嗜黏蛋白菌過度增殖,可能會造成黏膜屏障變薄,從而結腸上皮屏障受損[13]。本研究菌群分析顯示,M組中導致黏液蛋白降解菌阿克曼氏菌(Akkermansia)較N組增多;且前者M組小鼠結腸組織MUC2表達明顯下降,表明抗生素導致小鼠結腸黏液屏障的破壞。
結腸上皮屏障的完整性對于防止菌群侵襲入血具有重要的作用[14]。有研究發現,炎癥性腸病小鼠結腸上皮屏障受損,其小鼠的結腸長度有明顯縮短[15]。本研究結果提示M組小鼠的結腸長度較N組縮短,從形態學上說明M組小鼠造成了結腸上皮屏障的損傷。后續分析的結腸病理組織學同樣證實M組小鼠上皮屏障明顯受損,說明抗生素暴露可破壞結腸上皮屏障完整性。
當腸道黏膜屏障功能遭到破壞時常表現為腸道通透性升高。本研究選擇腸道通透性相關的指標DAO和D-LA進行分析[16-17],結果提示M組小鼠DAO水平較N組升高,而D-LA變化雖無統計學差異但呈升高的趨勢,這表明抗生素給藥可致小鼠結腸通透性升高。
此外,結腸黏膜內的免疫細胞可通過分泌促炎因子和抑炎因子平衡腸道免疫穩態以維持正常的腸道免疫屏障功能。研究發現,炎性相關因子TNFα和IL-1β在炎癥性腸病患者或臨床前期患者中表達水平較高,說明TNF-α和IL-1β可能是導致腸道炎癥的重要因子[18-19]。在缺乏IL-10受體小鼠中發現嚴重的腸道炎癥,表明IL-10對于抑制炎癥反應可能起到重要的作用[20]。本研究分析炎癥細胞因子在結腸組織中的表達水平,發現M組小鼠的促炎因子IL-1β和TNF-α的表達水平較N組升高,抑炎因子IL-10較N組降低,表明抗生素可導致小鼠結腸黏膜的促炎和抗炎反應紊亂。
綜上,抗生素破壞小鼠腸道菌群的平衡,可能是黏液屏障破壞的始發因素,黏液屏障的破壞使得結腸上皮屏障失去物理阻隔,導致結腸上皮受損,從而破壞黏膜屏障功能,導致小鼠結腸處于促炎反應階段,最終導致抗生素相關性腸黏膜損傷。本研究初步說明抗生素對腸黏膜屏障的不利影響,為認識抗生素相關性腸黏膜損傷提供一定的理論依據。

