DEB-TACE在肝癌介入治療中的有效性及安全性分析
李 福 王素平 張 敏 山東省單縣東大醫院消化內科 274300
原發性肝癌(HCC)是惡性程度較高的腫瘤之一,由于HCC早期發病時癥狀隱匿,多數患者確診時已處于中晚期,失去了手術切除的最佳時機,因而經導管肝動脈化療栓塞術(TACE)成為首選的治療方式。TACE治療HCC的理論依據是經過肝動脈注入化療藥物,到達腫瘤部位,一方面通過栓塞腫瘤細胞的供血動脈使其失去養分來源,另一方面通過化療藥物對腫瘤細胞的直接殺傷作用,導致腫瘤細胞壞死[1]。近年來,在嘗試提高TACE的療效并減低其不良反應過程中,引進了新技術DEB-TACE,理論是通過載藥微球系統延長化療藥物與腫瘤細胞的作用時間,并減少其釋放入血,降低副損傷,目前DEB-TACE技術已被應用于臨床,但具體療效國內報道較少。基于此,本文選擇傳統TACE法作為對照,分析DEB-TACE在治療HCC方面的效果和安全性,旨在為新技術的普及提供依據。
1 資料與方法
1.1 一般資料 選取2018年3月—2020年3月我院收治的84例HCC患者為觀察對象,均經臨床、影像學、病理確診。按治療方法不同分為觀察組和對照組,每組42例,觀察組中男30例,女12例;年齡31~67(55.3±6.1)歲;腫瘤分期:Ⅲ期 32例, Ⅳ期 10例;Child-Pugh分級:A級30例,B級12例;單發腫瘤直徑3.9~12.6(6.9±2.1)cm;肝內轉移18例,遠處轉移7例。對照組中男31例,女11例;年齡34~64(53.9±5.8)歲;腫瘤分期:Ⅲ期 34例, Ⅳ期 8例;Child-Pugh分級:A級32例,B級10例;單發腫瘤直徑3.2~11.7(6.5±1.7)cm;肝內轉移17例,遠處轉移6例。兩組患者一般資料差異無統計學意義(P>0.05),具有可比性。納入標準:原發病灶不能切除;肝動脈、門靜脈未受侵襲;預計生存時間>3個月;排除標準: Child-Pugh C級;癌灶占據肝臟50%以上;門體分流;無法糾正的凝血功能異常、血液病;其他重要器官功能障礙;嚴重感染;手術禁忌。
1.2 治療方法 對照組采取傳統TACE治療:常規Seldinger法穿刺股動脈,行腹腔干及腸系膜上動脈造影,了解腫瘤大小、形態、部位、門靜脈及腫瘤供血動脈情況,將化療藥物與30ml碘化油配成的混懸液,經微導管超選擇置入腫瘤供血動脈進行栓塞治療,待碘油沉積良好后拔管。化療藥物選擇:原發性肝癌均加載表柔比星50~100mg(根據60mg每體表面積的平方計算),轉移性肝癌均加載伊立替康100mg。觀察組采用DEB-TACE技術:化療藥物及穿刺方法同對照組,將化療藥物溶解后加入CalliSpheres載藥脂微球靜置30min以上,將微導管超選插至腫瘤供血動脈, 經導管以1ml/min速度緩慢注入CalliSpheres載藥脂微球與化療藥進行栓塞,再次造影觀察腫瘤染色情況,直至染色消失后拔管加壓止血,術后常規行抗感染、保肝、對癥治療,化療周期根據病灶情況,一般間隔6~8周。
1.3 觀察指標 (1)比較治療前及治療1個月AST、ALT、AFP、TBIL、ALB以及Child-Pugh評分;(2)比較治療前及治療1個月bFGF、VEGF水平及MVD值,MVD值檢測方法:在低倍鏡下選取三個腫瘤血管密集區,在200倍鏡下對三個區染色微血管進行計數,取平均值;(3)疾病控制率:2個化療周期后按WHO修訂的實體瘤療效評價標準(mRECIST)統計完全緩解(CR)、部分緩解(PR)、疾病穩定(SD)和疾病進展(PD)例數,疾病控制率=CR+PR+SD/總例數×100%;1年生存率=術后12個月存活例數/總例數×100%;(4)并發癥及不良反應:記錄術后栓塞綜合征、腹水形成及化療藥相關不良反應(腹痛、骨髓抑制等)發生情況。
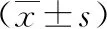
2 結果
2.1 兩組治療前后相關指標比較 治療前,兩組相關指標差異無統計學意義(P>0.05);治療后,觀察組ALT、AST、ALB水平高于治療前,AFP、TBIL水平低于治療前,差異有統計學意義(P<0.05);觀察組ALT、AFP、TBIL水平及Child-Pugh評分均低于對照組,差異有統計學意義(P<0.05),見表1。
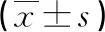
表1 兩組治療前后相關指標比較
2.2 兩組治療前后腫瘤血管指標比較 治療前,兩組患者腫瘤血管指標比較差異無統計學意義(P>0.05);治療后,觀察組患者bFGF、VEGF水平及MVD值均顯著低于治療前及同期對照組,差異有統計學意義(P<0.05),見表2。
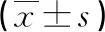
表2 兩組治療前后腫瘤血管指標比較
2.3 兩組患者疾病控制率及1年生存率比較 連續化療2個周期,觀察組與對照組患者疾病控制率分別為 83.3%和61.9%,差異有統計學意義(P<0.05),觀察組與對照組1年生存率分別為53.4%和42.9%,差異無統計學意義(P>0.05),見表3。

表3 兩組患者疾病控制率及1年生存率比較[n(%)]
2.4 兩組術后并發癥及不良反應比較 觀察組化療相關不良反應發生率低于對照組,差異有統計學意義(P<0.05),兩組并發癥發生率差異無統計學意義(P>0.05)。見表4。

表4 兩組術后并發癥及不良反應比較[n(%)]
3 討論
HCC起病隱匿、病情進展迅速、癌細胞浸潤能力強,是惡性程度較高的腫瘤類型之一。HCC發病早期無特異性癥狀,確診時往往已處于中晚期,單純手術切除無法達到臨床緩解,甚至多數患者已失去了手術治療機會[2]。TACE治療中晚期HCC的效果已得到臨床的廣泛認可,目前已被列入歐洲肝病協會(EASL)和美國肝病協會(AASLD)中晚期HCC推薦治療方法[3]。
傳統TACE采用碘油與化療藥物混合進行栓塞治療,碘油作為一種脂性造影劑,能夠暫時栓塞腫瘤血管,并可攜帶化療藥物與腫瘤組織密切結合,從而協助其殺滅腫瘤細胞。但存在兩個重要缺陷:首先,碘油在腫瘤實質不均勻沉積可使局部癌細胞“逃脫”化療藥物的攻擊,成為腫瘤復發和轉移的“火種”[4];其次,碘油是脂質,運載水溶性化療藥物會使藥物迅速釋放至全身循環系統,從而降低藥物的局部作用效果并加重全身不良反應。DEB-TACE是基于傳統TACE的上述兩種缺陷而引進的新技術,通過高分子材料——載藥微球加載所需劑量化療藥物,包裹吸附藥物呈微球狀,使其在循環系統中免遭破壞,并與細胞密切貼合,控制性的持續釋放藥物,盡量延長藥物與腫瘤作用時間并減少其釋放入血[5-6]。一項前瞻性隨機對照試驗顯示,HepaSphere載藥微球可顯著降低化療藥物血藥濃度,延長化療藥物反應時間,與傳統TACE相比具有較高的腫瘤反應率和安全性。國內學者劉金采取國產新型CalliSpheres載藥微球載藥治療12例HCC,臨床緩解率達83.3%,1年和2年生存率分別為66.7%和41.7%[7]。
本文結果顯示,觀察組治療1個月bFGF、VEGF水平及MVD值均較治療前和對照組降低,差異有統計學意義(P<0.05)。VEGF是高特異性血管生成因子,可作用于血管內皮細胞使其增殖并重建,新生微血管形成后,bFGF又可破壞其基底膜和屏障功能,為腫瘤細胞侵襲和轉移創造條件[8],二者與MVD值在DEB-TACE術后顯著降低,說明CalliSpheres載藥微球聯合TACE通過抑制bFGF和VEGF表達、降低腫瘤微血管密度、進一步減少癌細胞血供的方式殺傷腫瘤細胞,且一定程度的抑制其轉移。觀察組治療1個月血清肝酶、白蛋白、膽紅素、腫瘤標志物等指標較治療前和對照組均有不同程度的改善,2個化療周期臨床控制率高達83.3%,高于對照組的61.9%,進一步證實了DEB-TACE殺傷腫瘤細胞的效果優于傳統TACE。但兩組患者的1年生存率差異無統計學意義(P>0.05),說明栓塞術雖然可以短期抑制腫瘤細胞生長,但對遠期腫瘤復發的作用不大,這也是TACE不能代替手術切除作為HCC的首選治療方法的主要原因[9]。除了臨床控制率方面,與傳統TACE相比,DEB-TACE另一項優勢是藥物不良反應方面。本文中觀察組藥物不良反應發生率低于對照組,差異有統計學意義(P<0.05),與載藥微球控制下,外周循環血藥濃度降低有關。根據載藥微球的超選擇特性,術中應注意選擇腫瘤直接供血動脈,避免正常供血動脈的誤栓造成肝細胞副損傷[10]。
綜上所述,CalliSpheres 載藥微球聯合TACE治療HCC能提高臨床緩解率,減少化療藥物不良反應,具有推廣價值。

