后半規管途徑導入不同血清型腺相關病毒轉染小鼠耳蝸內毛細胞的效果比較
劉 珊 郭 瑞 宋新雨 于倩茹 陳鐘壡 梁文琦 滕 琪 龔樹生 柳 柯*
(1.首都醫科大學附屬北京友誼醫院耳鼻咽喉頭頸外科,北京 100050;2.首都醫科大學耳聾疾病臨床診療與研究中心,北京 100050)
聽力損失目前是人類最常見的感官缺陷之一,約有一半的語前聾是由遺傳原因造成的。每1 000個新生兒中就有一位患有先天性耳聾,其中60%以上是由遺傳因素引起的,遺傳性聾的群體發病率已超過27/1 000[1-3]。傳統上可以采用助聽器或是人工耳蝸植入術來治療不同基因突變引起的遺傳性耳聾,但除此之外,尚無有效的藥物治療手段。對于遺傳性耳聾較為理想的干預方法是對基因突變位點精準修復,恢復聽力。近年來的研究[4-6]表明,基因治療已經成為一種治療遺傳性疾病可行且有前途的方法。
在基因治療中,病毒載體的選擇尤為關鍵。目前在基因治療中最有效的病毒載體有腺病毒載體、腺相關病毒(adeno-associated virus,AAV)載體、反轉錄病毒載體和慢病毒載體(lentiviral vectors,LVs)。在體外的基因治療臨床試驗中,反轉錄病毒載體和慢病毒載體作為首選載體,而AAV載體目前是體內治療遺傳性耳聾的首選載體[7-8],它具有高效的轉導效率及良好的安全性,并且可以在體內長期持續表達[9-10],這些特性使得AAV在各個領域的臨床基因治療中有越來越多的應用[11]。但是采用不同血清型、啟動子和轉染路徑都可以影響AAV轉染的效率。
經后半規管注射途徑作為一種內耳局部給藥的方式,使注射試劑在小鼠耳蝸及前庭中廣泛并均勻分布,且對其聽力和前庭功能損害最小,已被證明是一種將局部藥物輸送到內耳簡單且高效的方法[12-15]。
隨著遺傳性耳蝸內毛細胞及帶狀突觸疾病越來越多地被發現和鑒定,針對耳蝸內毛細胞的AAV轉染效率受到了更多的關注。為此在本研究中,通過半規管注射途徑檢測了4種AAV載體:AAV8、AAV9、AAVie、Anc80L65 在小鼠耳蝸內毛細胞中的轉染情況。
1 材料與方法
1.1 實驗動物
本研究采用6~8周齡C57BL/6J小鼠20只,雌雄不限,購于北京斯貝福生物技術有限公司,實驗動物許可證號:SYXK(京)2019-0010,實驗動物的使用遵循醫學實驗動物管理實施細則以及首都醫科大學實驗動物管理細則。實驗動物采用數字表法隨機分為5組,每組4只,均以左耳為手術耳。分為AAV8病毒導入組、AAV9病毒導入組、AAVie病毒導入組、Anc80L65病毒導入組,每只小鼠經后半規管導入病毒溶液2 μL;正常對照組,每只小鼠經后半規管導入0.9%(質量分數)氯化鈉注射液2 μL。術前1天進行聽力初篩,后半規管手術后2周行聽性腦干反應(auditory brainstem response,ABR)檢測后取小鼠耳蝸進行免疫熒光染色觀察轉染情況。小鼠飼養于首都醫科大學實驗動物部,每籠最多5只,可自由進食和飲水,提供12 h/12 h的明/暗環境。所有實驗步驟均通過首都醫科大學動物倫理委員會批準,倫理學審批號:AEEI-2021-298。
1.2 主要材料
攜帶綠色熒光蛋白(green fluorescent protein,GFP)基因的AAV8、AAVie、Anc80L65病毒懸液購于廣州派真生物技術有限公司,效價均為:1E+13GC/mL;AAV9病毒懸液來自于北京大學鄧宏魁教授細胞分化與干細胞研究室的饋贈。
1.3 手術方法
實驗動物用腹腔注射氯胺酮(100 mg/kg, Sigma公司,美國)和甲苯噻嗪(10 mg/kg, Sigma,美國),進行麻醉,麻醉成功后放置保溫毯上進行備皮,乙醇消毒手術區域,采用左耳耳后切口,充分暴露后半規管,用26號注射器針頭在后半規管戳一小孔,將微管插入小孔中(圖1),用微量注射泵導入2 μL病毒溶液。隨后拔出微管同時用一小塊肌肉封堵入口,復位肌肉及皮下組織,用縫線縫合切口。

圖1 經后半規管導入手術示意圖(術耳為左耳) Fig.1 Schematic diagram of operation through posterior semicircular canal (left ear for operation)
1.4 ABR檢測
分別于術前及術后2周對小鼠進行ABR檢測聽力功能。將麻醉后的小鼠置于標準屏蔽隔音室內,用美國TDT RZ6機器進行檢測,將記錄電極置于前額正中皮下,參考電極置于檢測耳后皮下,接地電極置于非測試耳后皮下,外置放大器置于測試耳一側。刺激聲采用短聲和短純音,選擇4、8、16、32 kHz為測聽頻率點,記錄波形。刺激強度從90 dB SPL開始,按10 dB遞減,接近閾值時按5 dB遞減,直到檢測不出重復的ABR波形,此刺激聲強度為小鼠的聽閾。
1.5 內耳標本的制備
術后兩周行ABR測聽后處死動物,取出耳蝸,顯微鏡下于蝸尖處打孔,刺破圓窗膜及卵圓窗膜后放入4%(質量分數)多聚甲醛中4 ℃避光過夜。隨后將耳蝸放于10%(質量分數)乙二胺四乙酸鈉(ethylenediaminetetraacetic acid, EDTA)中脫鈣2 h,在顯微鏡下剝離蝸殼,切除多余血管紋、螺旋韌帶,撕下蓋膜及前庭膜,將基底膜切為頂中轉及中底轉進行免疫熒光染色。
1.6 免疫熒光染色
將制備好的基底膜放于0.3%(體積分數)TritonX-100(Sigma-Aldrich,美國)和5%(體積分數分數)山羊血清(ZSGB-BIO公司, 中國)在室溫下孵育2 h,加稀釋兔源性Myosin(1∶300,Proteus BioSciences 公司,美國 )一抗4 ℃孵育過夜,PBS漂洗3次,加二抗山羊抗兔568(1∶300)室溫孵育2 h,PBS漂洗3次后用DAPI封片,激光共聚焦顯微鏡觀察GFP分布并拍片。
1.7 細胞計數
在激光共聚焦圖像中計數500 μm長度的基底膜,計算每一段基底膜中表達GFP的內毛細胞數比例。
1.8 統計學方法
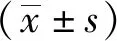
2 結果
2.1 各組術前和術后ABR閾值測試結果
術后1 d發現有2只小鼠拎起尾巴有旋轉現象,術后3 d癥狀消失,恢復正常,其余小鼠未見有歪頭、步態不穩等前庭功能受損等表現。術后2周ABR檢測后取材時肉眼觀中耳清潔,未見中耳積液及內耳炎性反應等表現。將AAV8注射組、AAV9注射組、AAVie注射組、Anc80L65注射組聽力數據分別與術前及對照組聽力數據進行比較,差異均無統計學意義(P>0.05),詳見圖2。

圖2 手術前后小鼠ABR變化 Fig.2 Changes of ABR in mice before and after operation
2.2 耳蝸內GFP表達
在導入2周后對小鼠耳蝸取材進行免疫熒光染色,GFP熒光標記病毒轉染的細胞,Myosin標記毛細胞,DAPI標記細胞核,激光共聚焦顯微鏡下觀察GFP在耳蝸組織中的分布。
激光共聚焦顯微鏡下觀察AAV8在耳蝸基底膜中的表達(圖3),GFP分布在內毛細胞區域,但密度較低,AAV8在耳蝸頂中轉內毛細胞的轉染效率為34.6%±1.8%,中底轉內毛細胞轉染效率為39.0%±5.9%。

圖3 AAV8導入2周后GFP在基底膜的分布Fig.3 Distribution of GFP in Corti 2 weeks after AAV8 introduction
2.3 AAV9、AAVie、 AL80L65在耳蝸中的表達
激光共聚焦顯微鏡下觀察AAV9在耳蝸基底膜的表達,可見其GFP均勻且廣泛分布在內毛細胞區域(圖4),AAV9耳蝸頂中轉內毛細胞轉染效率為92.5%±1.1%,中底轉內毛細胞轉染效率為94.6%±1.0%,其轉染效率在頂中轉及中底轉均顯著高于AAV8及Anc80L65。

圖4 AAV9導入2周后GFP在基底膜的分布 Fig.4 Distribution of GFP in Corti 2 weeks after AAV9 introduction
激光共聚焦顯微鏡下觀察AAVie在耳蝸基底膜的表達,可見其GFP廣泛且高效分布在內毛細胞區域(圖5)。耳蝸頂中轉轉染效率為96.7%±1.5%,中底轉內毛細胞轉染效率為97.7%±0.8%。
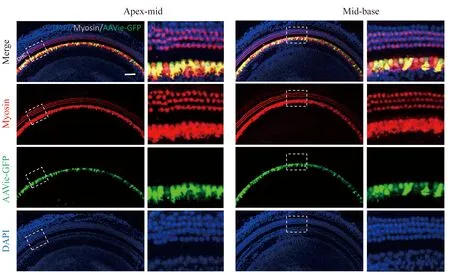
圖5 AAVie導入2周后GFP在基底膜的分布 Fig.5 Distribution of GFP in Corti 2 weeks after AAVie introduction
激光共聚焦顯微鏡下觀察Anc80L65在耳蝸基底膜的表達(圖6),GFP普遍分布于內毛細胞區域,耳蝸頂中轉內毛細胞轉染效率為62.5%±3.3%,中底轉內毛細胞轉染效率為63.1%±6.1%(圖7)。
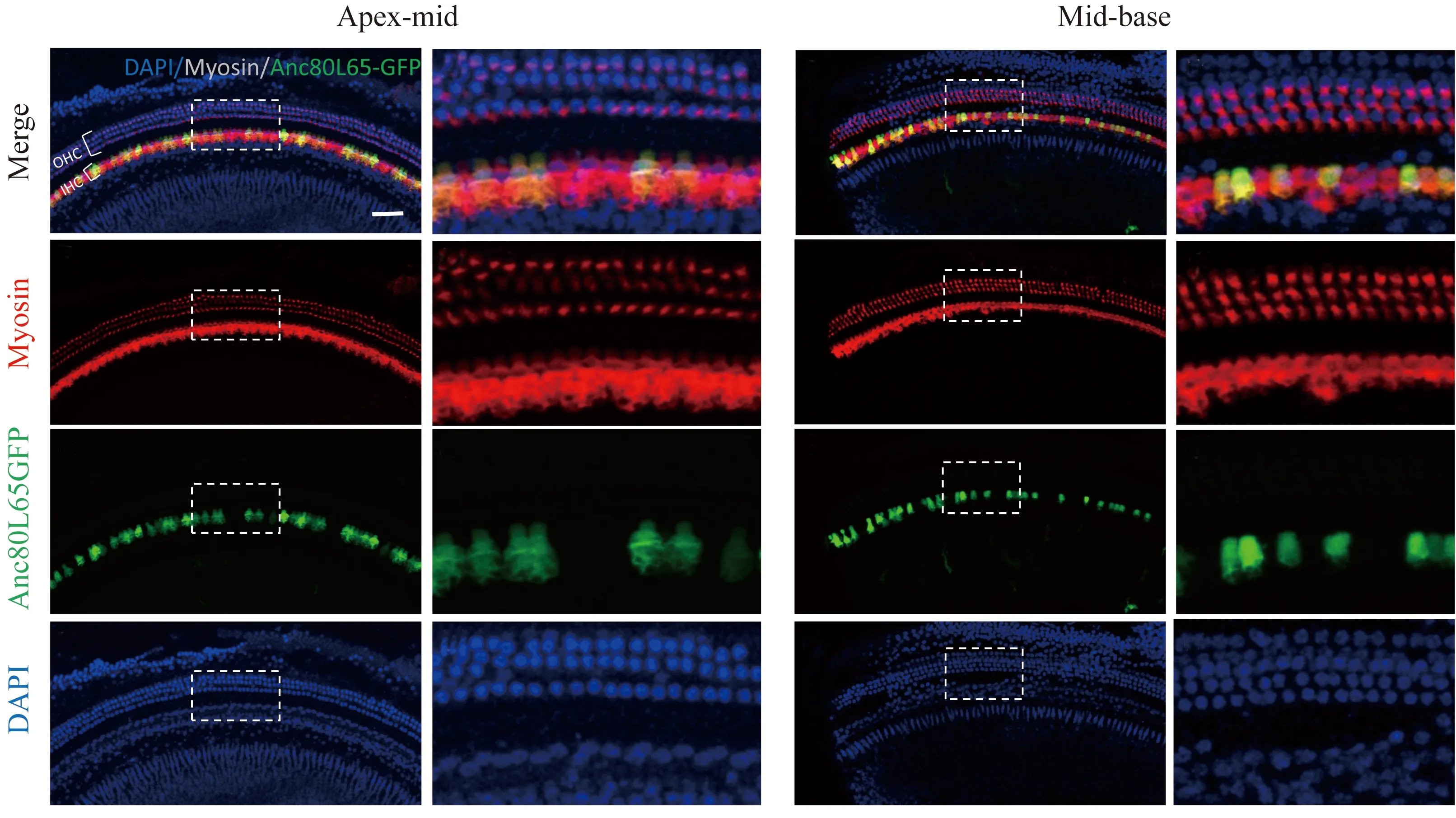
圖6 Anc80L65導入2周后GFP在基底膜的分布 Fig.6 Distribution of GFP in Corti 2 weeks after Anc80L65 introduction

圖7 各組病毒溶液在小鼠耳蝸中的轉染率比較 Fig.7 Comparison of transfection efficiency of virus solution in mouse cochlea
正常對照組未見GFP表達,在耳蝸頂中轉及中底轉中,AAV9、AAVie分別比AAV8、Anc80L65轉染率高,組間差異有統計學意義(P<0.05)。
3 討論
基因治療是隨著DNA重組技術的成熟而發展起來的,是醫學和藥學領域的一次重大技術進步[16]。基因治療目前多采用的方法是通過病毒載體將遺傳物質引入靶細胞,通過糾正或補充有缺陷的基因來治療或預防遺傳性疾病。基因治療的優點效果是長期的,不需要反復進行手術操作。
腺相關病毒是目前研究中最活躍的基因治療的首選載體[17],它具有裝載量大(36 kb)、相對廣泛的趨向性、低免疫原性和非致病性等獨特的臨床引用特點,且可以長期穩定表達。迄今為止,至少有 12 種天然血清型和 100 多種 AAV 變體已被分離出來并作為基因傳遞載體進行研究,并且從這些載體中不斷產生 AAV 突變體,以優化 AAV 用于基因傳遞的用途。然而,盡管AAV載體在臨床上取得了良好的治療效果,但其轉染效率和誘導對AAV轉染細胞的免疫應答的趨勢也引起關注。本研究中,注射AAV病毒的各組與正常對照組ABR閾值比較也可以發現,AAV病毒對小鼠本身ABR沒有影響,且AAVie及AAV9經半規管途徑導入到內耳后在內毛細胞有較高的轉染率,這說明AAV作為一種基因治療的病毒載體是安全且高效的。這為今后在基因治療如OTOF、SLC17A8、SMAD4等基因突變導致的聽神經病中病毒載體的選擇提供了更多思路[18-19]。
經半規管注射方式并未引起小鼠耳蝸ABR閾值的顯著改變,耳后入路經后半規管注射手術創傷較小,所以后半規管手術方式是一種既可以保存聽力,又能有效的將目的基因導入耳蝸的有效路徑。對動物手術來說,相對于耳蝸圓窗手術,半規管更容易暴露,對神經和血管損傷較小,對耳蝸正常結構組織破壞性小,對前庭功能也并無損害。
本研究中發現有2只小鼠術后第1天起尾巴時有旋轉的現象,但是在術后3 d癥狀消失,考慮是術后由于個體差異導致的前庭器官應激反應[20]。之前的研究表明,多種因素包括小鼠年齡、載體血清型、啟動子類型、注射方法和病毒效價都會影響病毒在小鼠內耳的細胞靶向性以及轉導效率[21]。在本實驗結果中AAV8及Anc80L65的轉染效率并不高,AAVie和AAV9雖然在內毛細胞轉染效率較高,但都只能轉染到內毛細胞,外毛細胞和支持細胞均未觀察到GFP表達。分析可能的原因有:以往的研究[18-21]中病毒轉染途徑大多采用經圓窗途徑給藥,因為圓窗在解剖學上比后半規管更靠近耳蝸,但又容易損害小鼠聽力。其次通過后半規管傳遞的病毒溶液可能會被半規管中的淋巴液稀釋,這會降低其濃度并限制其感染整個耳蝸的能力。另外,其他研究中多采用P7以內新生小鼠進行手術,這也是本研究的不足之處,只研究了AAV8、AAV9、AAVie、Anc80L65在成年小鼠經半規管給藥后對內耳的轉染情況,其他手術方式及小鼠年齡有待進一步研究,以尋求更高效的轉染效率。
總之,本研究表明經后半規管注射AAVie、AAV9可以在內耳內毛細胞高效轉染并對聽力沒有顯著影響,因而可以在日后的基因治療中作為一種載體選擇,特別是對耳蝸內毛細胞及帶狀突觸的遺傳性聽力損失干預而言,這種病毒應用價值較大。當然,目前對于腺相關病毒載體的不斷探索以及內對耳局部給藥方式的不斷完善,如經后半規管給藥、經圓窗膜顯微注射、鼓室注射、中階給藥等,為今后在遺傳性疾病的臨床治療打下了堅實的基礎。
利益沖突所有作者聲明無利益沖突。
作者貢獻聲明劉珊:研究設計、數據收集和論文撰寫; 于倩茹:數據收集; 郭瑞、宋新雨、陳鐘壡、梁文琦、滕琪:數據分析; 龔樹生、柳柯:研究設計和論文指導。

