灰飛虱脂肪酶LsLPS的原核表達及Ni-NTA純化
王利華 張玉 鄭州廷 曹越 紀銳 方繼朝




摘要: 灰飛虱是危害中國水稻的3種主要稻飛虱之一。脂肪酶是脂肪代謝的關鍵酶,在昆蟲發育、繁殖等生理活動中具有重要作用。為了深入研究脂肪酶( LsLPS )在灰飛虱生長發育中的功能,本研究克隆了 LsLPS 基因ORF序列,并進行了原核表達和His標簽融合蛋白的純化。結果顯示,灰飛虱 LsLPS 開放閱讀框長1 293 ?bp,可翻譯成430個氨基酸,含有信號肽序列和PF00151結構域。 LsLPS 連接到原核表達載體pET28a(+)-SUMO、pCold I后在表達菌株BL21(DE3)中主要以包涵體形式表達,連接到pET43.1a(+)后可在表達菌株BL21(DE3)中可溶性表達。采用pH 8.0、含20 mmol/L 咪唑的磷酸緩沖液作為平衡液,Ni-NTA純化LsLPS-pET43.1a(+)融合蛋白的純度和產量相對較高。
關鍵詞: 灰飛虱; 脂肪酶; ?LsLPS 基因; 原核表達; Ni-NTA純化
中圖分類號: S435.112+.3?? 文獻標識碼: A?? 文章編號: 1000-4440(2022)03-0611-06
Prokaryotic expression and Ni-NTA purification of lipase ?LsLPS ?from ?Laodelphax striatellus
WANG Li-hua 1,2 , ZHANG Yu 1,2 , ZHENG Zhou-ting2, CAO Yue2, JI Rui2, FANG Ji-chao2
(1.College of Plant Protection, Nanjing Agricultural University, Nanjing 210095, China; 2.Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China)
Abstract: Small brown planthopper (SBPH), ?Laodelphax striatellus , is one of the three main rice planthoppers damaging rice in China. Lipase is the key enzyme in fat metabolism and plays an important role in insect development, reproduction and other physiological activities. In order to investigate the function of lipase in the growth and development of SBPH, the ORF sequence of ?LsLPS ?gene was cloned, and the fusion protein with a His-tag was purified. The results showed that the open reading frame of ?LsLPS ?was 1 293 ?bp in length and could be translated into 430 amino acids, containing signal peptide sequence and PF00151 domain. ?LsLPS ?fusion proteins expressed using prokaryotic expression vectors pET28a(+)-SUMO and pCold I were mainly in the form of inclusion bodies in the expression strain BL21(DE3). After connecting ?LsLPS ?with pET43.1a(+) vector, the obtained proteins were expressed in soluble forms in BL21(DE3). The purity and yield of the fusion protein purified by Ni-NTA were relatively higher using phosphate buffer (pH 8.0) containing 20 mmol/L ?imidazole as equilibrium solution.
Key words: ?Laodelphax striatellus ; lipase; ?LsLPS ?gene; prokaryotic expression; Ni-NTA
灰飛虱( Laodelphax striatellus )屬于半翅目飛虱科害蟲,通過直接刺吸韌皮部或者傳播病毒病危害禾本科作物,是江淮稻區重要水稻害蟲之一。脂肪酶可將甘油三酯水解成甘油和脂肪酸,是生物脂肪水解的關鍵酶。在昆蟲中,還存在許多催化中心基序變異的脂肪酶,不具備水解脂肪的能力,但可在繁殖等其他生理過程中起作用,如某些雙翅目昆蟲中的中性脂肪酶、鱗翅目昆蟲的酸性脂肪酶,可充當卵黃蛋白 [1] 。
原核表達是研究基因離體功能的重要前提和手段。目前用于原核表達的質粒主要有pET、pGEX、pCold等系列質粒。這些質粒含有不同的啟動子和融合表達標簽,可適應不同蛋白質表達的需求。如pET系列載體,含有 T7強轉錄子,具有基礎表達水平低、誘導表達水平較高等優點,在昆蟲外源基因原核表達中被廣泛應用 [2-7] 。
His標簽是蛋白質原核表達常用的融合表達標簽之一,具有促進目標蛋白質表達、對目標蛋白質理化性質和晶體結構影響小、純化操作簡便等優點,在生物蛋白質功能研究中被廣泛使用 [8-12] 。His標簽融合蛋白的純化常采用Ni-NTA瓊脂糖純化樹脂,其His標簽可與Ni 2+ 螯合,從而使融合蛋白結合到純化介質上。純化緩沖液可能影響His標簽融合蛋白的可溶性、穩定性、與基質的競爭性結合等 [13-16] ,從而影響Ni-NTA純化效率。本研究通過篩選不同原核表達載體,實現了灰飛虱脂肪酶 LsLPS 的可溶性表達,在此基礎上,比較了不同化學組成、pH或咪唑濃度緩沖液純化的His標簽融合蛋白的純度和產量,其研究結果不僅可為 LsLPS 的功能研究奠定基礎,也可為His標簽融合蛋白的純化提供參考。
1 材料與方法
1.1 灰飛虱脂肪酶 LsLPS 基因序列分析
灰飛虱脂肪酶 LsLPS 基因序列從轉錄組數據庫中獲得,其ORF序列經RT-PCR克隆測序驗證。采用在線生物學軟件Computer PI/Mw計算LsLPS蛋白的理論相對分子質量和等電點;采用SignalP-5.0 Server預測潛在的信號肽剪切位點及其位置;采用TMHMM Server v. 2.0預測跨膜螺旋區域;采用Pfam分析蛋白質家族;采用ScanProsite預測是否存在絲氨酸活性位點。
1.2 灰飛虱脂肪酶 LsLPS 原核表達
設計含同源臂的引物進行RT-PCR(引物序列見表1),擴增 LsLPS ?ORF序列,然后連接到空白載體pET22b(+)、pET28a(+)、pET28a(+)-SUMO、pCold I、pET43.1a(+),轉化DH5 α 。挑單克隆測序,將測序正確的序列轉化表達菌株BL21(DE3)。擴大培養后取1 ml菌液加入終濃度10%的甘油保存,其余菌液加入終濃度為0.5 mmol/L 的IPTG誘導目標蛋白質表達,收集菌體,超聲破碎后采用12% SDS-PAGE檢測表達情況。對檢測有可溶性表達的菌株,取100 μl甘油保存的表達菌株,加入20 ml LB培養基中過夜培養,然后按照1%的比例轉入新鮮的培養基中,恒溫搖床培養,培養至 OD 600 約為0.6時,加入終濃度為0.5 mmol/L 的IPTG,37 ℃誘導4 h。離心收集菌體后,采用30 ml緩沖液重懸菌體,充分混勻后,平均分為6份,10 000 ?r/min 離心5 min,重新收集菌體,-80 ℃ 貯存用于Ni-NTA純化。
1.3 蛋白質SDS-PAGE凝膠電泳
SDS-PAGE凝膠電泳采用碧云天生物技術公司SDS-PAGE凝膠快速配制試劑盒。上層膠濃度為5%,下層膠濃度為12%。待凝膠凝固后將6 μl樣品加入凝膠孔中,80 V電泳20 min,然后120 V電泳約60 min,至溴酚藍指示帶遷移至凝膠近底部位置。凝膠染色采用R250染色液。
1.4 融合蛋白Ni-NTA純化
分別采用Tris-HCl緩沖液(含20 mmol/L 咪唑,pH 8.0)、磷酸緩沖液(分別含0 mmol/L 、20 mmol/L 、50 mmol/L 咪唑,pH 8.0;或者含20 mmol/L 咪唑,pH分別為7.5或8.5)重懸-80 ℃ 貯存的菌體,超聲破碎后,4 ℃ 12 000 r/min離心20 min,將上清液轉移至新離心管中,相同條件,再離心1次。取上清液,加入平衡好的層析柱中進行Ni-NTA純化,具體步驟參考TransGen試劑盒說明書。待上清液流出后,用10倍柱體積平衡液洗滌層析柱,直到洗出液達到 OD 280 基線值。然后依次采用50 mmol/L 、100 mmol/L 、200 mmol/L 、300 mmol/L 咪唑溶液進行梯度洗脫,收集洗脫液,利用Bradford快速檢測洗脫液中蛋白質的濃度;收集洗脫液,用Bradford試劑檢測,保留有明顯藍色的洗脫液。過夜后透析,即得純化的融合蛋白溶液。
1.5 融合蛋白純度和濃度測定
融合蛋白純度根據SDS-PAGE凝膠電泳條帶灰度值計算。采用ImageJ掃描電泳條帶,以目標條帶灰度值除以所有條帶灰度值總和得到目標蛋白質的純度 [17] 。融合蛋白質濃度測定采用碧云天BCA試劑盒,具體步驟參考試劑盒說明書。融合蛋白產量= 純化蛋白總產量× 融合蛋白純度;純化蛋白總產量=純化蛋白濃度×純化蛋白總體積。
2 結果與分析
2.1 灰飛虱脂肪酶 LsLPS 基因序列特征
灰飛虱脂肪酶 LsLPS 基因開放閱讀框長1 293 ?bp,可翻譯成430個氨基酸(圖1)。理論相對分子質量為47 900 ,等電點為5.47。含有信號肽序列和PF00151結構域,屬于胰脂肪酶家族,與豌豆蚜( Acyrthosiphon pisum )、桃蚜( Myzus persicae )脂肪酶 H 的氨基酸序列具有58%的一致性,但無脂肪酶的絲氨酸活性中心PS00120。其氨基酸序列第238位和243位氨基酸為苯丙氨酸,而絲氨酸活性中心在第238位對應位置的氨基酸為亮氨酸、異亮氨酸或纈氨酸,第243位對應位置的氨基酸為組氨酸、酪氨酸、色氨酸或纈氨酸(圖1)。
2.2 灰飛虱脂肪酶 LsLPS 在不同載體中的原核表達
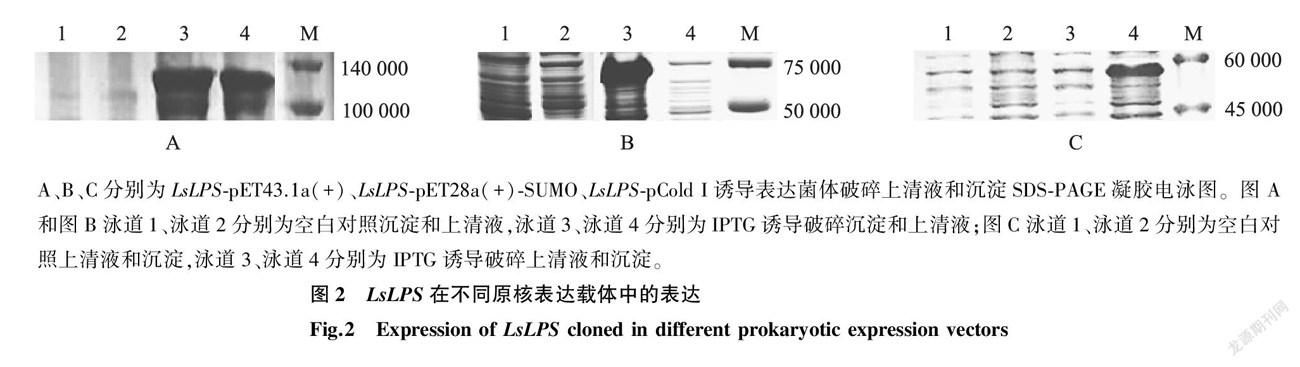
灰飛虱脂肪酶 LsLPS 在5個原核表達載體pET28a(+)、pET22b(+)、pET28a(+)-SUMO、pCold I 、pET43.1a(+)中的表達情況如圖2所示。 LsLPS -pET28a(+)-SUMO、 LsLPS -pCold I表達的融合蛋白存在于重組大腸桿菌包涵體中, LsLPS -pET43.1a(+)表達的融合蛋白存在于菌體破碎的上清液和包涵體中, LsLPS -pET22b(+)、 LsLPS -pET28a(+)在重組大腸桿菌中無明顯表達。
2.3 LsLPS-pET43.1a(+)融合蛋白Ni-NTA純化產量和純度比較
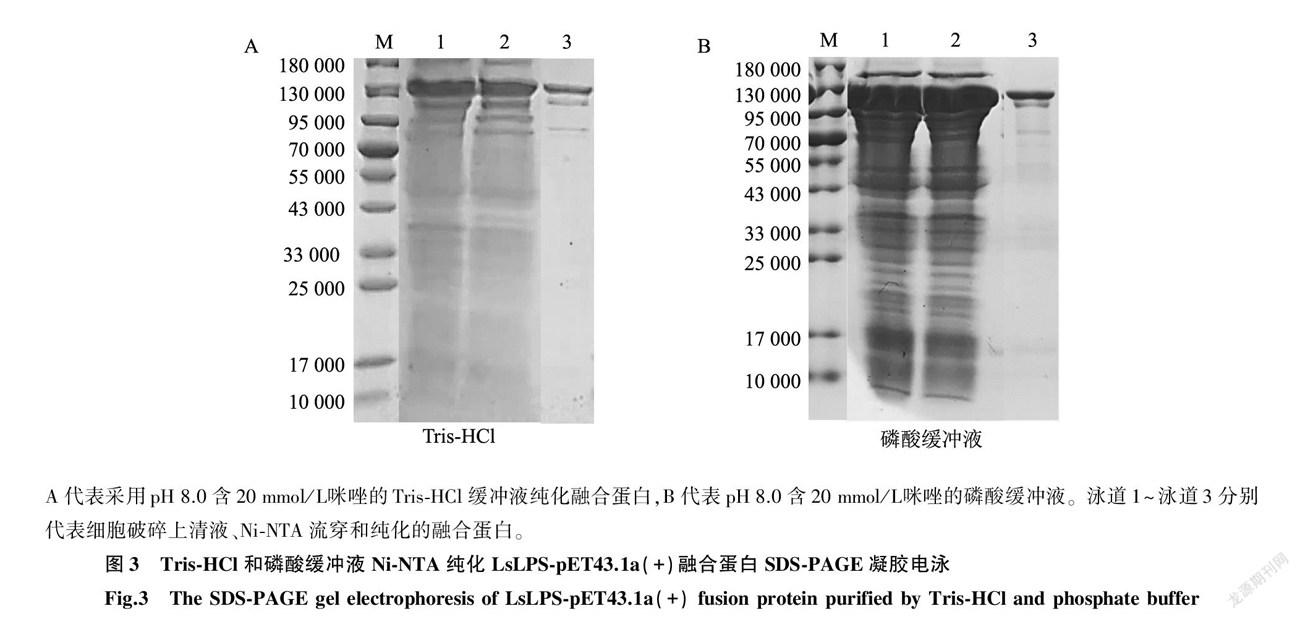
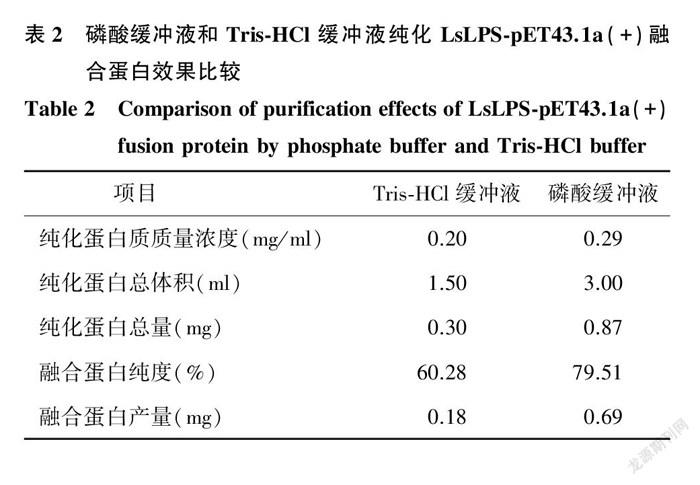
2.3.1 Tris-HCl緩沖液和磷酸緩沖液純化效果比較 采用Tris-HCl或磷酸緩沖液純化LsLPS-pET43.1a(+)融合蛋白時,均可純化到目標蛋白質(圖3),但這2種緩沖液獲得的融合蛋白產量和純度存在較大的差異(表2)。
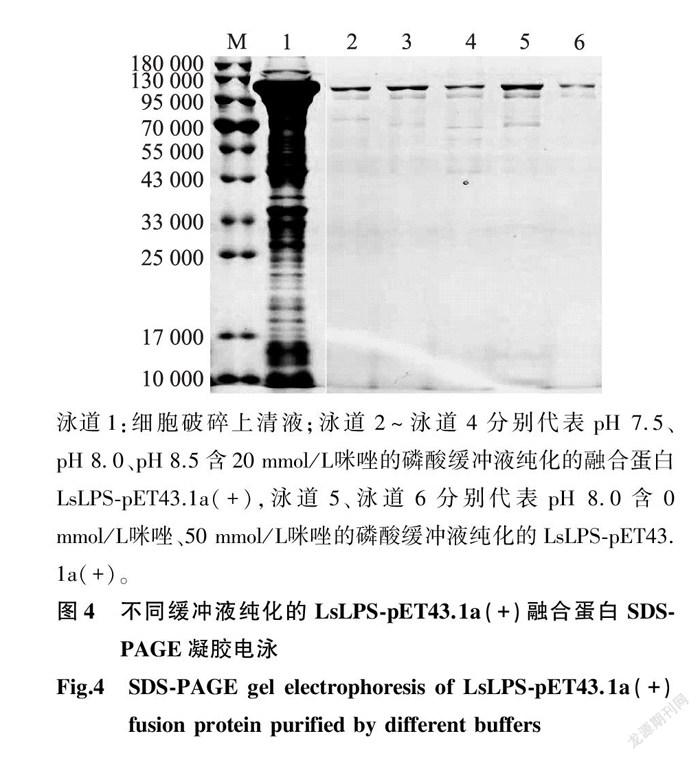
2.3.2 不同pH值磷酸緩沖液純化LsLPS-pET43.1a(+)融合蛋白效果比較 不同pH值磷酸緩沖液純化LsLPS-pET43.1a(+)融合蛋白的產量和純度不同(表3、圖4)。當緩沖液pH值為8.0時,融合蛋白的產量和純度都相對較高。
2.3.3 含不同濃度咪唑的磷酸緩沖平衡液純化LsLPS-pET43.1a(+)融合蛋白效果比較 平衡液采用含不同濃度咪唑的磷酸緩沖液時,LsLPS-pET43.1a(+)融合蛋白的純化效果也不同(表4、圖4)。含20 mmol/L 咪唑的磷酸緩沖液作為平衡液時,融合蛋白產量分別為含0 mmol/L 和50 mmol/L 咪唑的磷酸緩沖液的1.3倍和7.0倍。但融合蛋白的純度以含50 mmol/L 咪唑的磷酸緩沖液最高,其次為含20 mmol/L ,含0 mmol/L 咪唑的磷酸緩沖液獲得的融合蛋白純度最低。
4 討 論
脂肪酶是脂肪水解的關鍵酶,在微生物、植物、動物中普遍存在。中性脂肪酶具有PF00151保守結構域,在其 N 端一般含有信號肽序列,是昆蟲最大的2個脂肪酶家族之一,在脂質消化、儲存、繁殖、免疫應答等多種生理活動中起重要作用 ?[1] 。昆蟲約10%的中性脂肪酶缺少催化活性中心基序,不能水解脂肪,但可作為雌蟲卵黃蛋白、雄蟲副腺蛋白等行使功能 [1,18] 。灰飛虱脂肪酶 LsLPS 含有PF00151結構域, N 端具有信號肽序列、但無催化中心基序,推測該脂肪酶極有可能無水解脂肪的活性,而是在其他生理活動中起作用。
灰飛虱 LsLPS 在大腸桿菌中的表達受表達載體融合表達標簽、啟動子等影響,大腸桿菌轉錄延長的抗終止因子(NusA)等標簽促進 LsLPS 的表達。外源基因原核表達常因表達宿主缺乏合適的轉錄、翻譯后加工機制,使其表達產物不能正確折疊和修飾,難以獲得大量可溶性蛋白質。添加恰當的融合表達標簽是提高外源基因可溶性表達的有效策略 [19-21] 。目前常用的融合標簽有His標簽、硫氧還蛋白質(Trx)、麥芽糖結合蛋白質(MBP)、谷胱甘肽- S 轉移酶( GST )、鏈球菌 G 蛋白質 B1 結構域、小泛素相關修飾蛋白質(SUMO)以及NusA等 [22] 。僅有His標簽的質粒pET22b(+) 、pET28a(+)不能實現 LsLPS 的原核表達,但 LsLPS 與NusA標簽融合后可實現可溶性表達,與SUMO標簽融合后主要以包涵體的形式表達。啟動子、翻譯增強元件等對 LsLPS 的原核表達也有一定的影響。pCold I載體采用冷休克啟動子,含有翻譯增強元件(TEE), LsLPS 連接到該載體后也能以包涵體的形式表達。
灰飛虱 LsLPS 融合蛋白的Ni-NTA純化產量和純度受緩沖液影響。金屬螯合親和層析中蛋白質和金屬離子間的結合強度受金屬離子類型、親和氨基酸殘基數量及暴露程度、緩沖液離子類型、pH值大小等因素的影響 [23-26] 。Ni-NTA是純化His標簽融合蛋白的常用方法,其純化效率受緩沖液化學組成、咪唑濃度、pH值等因素影響。咪唑是His標簽融合蛋白競爭性結合劑,可與Ni 2+ 結合,平衡液中低濃度的咪唑可以減少雜蛋白的非特異性吸附,但咪唑濃度過高,可能影響目標蛋白的吸附,從而降低純化效率 [15,27] 。pH值可能影響蛋白質的溶解性或蛋白質-金屬配基的結合 [28-31] ,從而影響Ni-NTA的純化效率。灰飛虱LsLPS融合蛋白Ni-NTA純化在采用pH 8.0、含20 mmol/L 咪唑的磷酸緩沖液時目的蛋白質產量和純度較高,可能與該配方緩沖液咪唑濃度、pH適中有關,這一結果可為下一步 LsLPS 的離體功能研究奠定基礎,也可為其他重組蛋白質的Ni-NTA純化提供參考。
參考文獻:
[1] HORNE I, HARITOS V S, OAKESHOTT J G. Comparative and functional genomics of lipases in holometabolous insects [J]. Insect Biochemistry & Molecular Biology, 2009, 39(8): 547-567.
[2] 陳 昊,羅巧玉,馬秋雨,等. 松墨天牛漆酶基因MaLac1的克隆,原核表達及表達譜分析[J]. 昆蟲學報, 2020,63(4): 381-389.
[3] 楊 安,梅國紅,張 浩,等. 淡足側溝繭蜂氣味結合蛋白質MpOBP8的基因克隆及原核表達分析[J]. 應用昆蟲學報, 2019, 56(2): 273-282.
[4] 王婷婷,索 倩,孫曉燕,等. 棉鈴蟲激活增強子結合蛋白質AP-4基因的原核表達、多克隆抗體制備、表達譜分析及功能鑒定[J]. 昆蟲學報, 2019, 62(9): 1028-1037.
[5] 魏原杰,王亞美,黃麗娜,等. 棉蚜 P450 CYP6CY3 的克隆,原核表達及多克隆抗體的制備[J]. 中國農業科學, 2017, 50(7): 1351-1360.
[6] 謝紅艷,魯 長,黃春燕,等. 煙粉虱MED隱種氣味結合蛋白質基因BtabOBP2和BtabOBP4的cDNA克隆及原核表達[J]. 環境昆蟲學報, 2017, 39(4):752-761.
[7] 徐秋芳,陳晴晴,倪海平,等. 灰飛虱原肌球蛋白質的基因克隆、原核表達及多克隆抗體制備[J]. 中國農業科學, 2014, 47(19):3791-3798.
[8] BEN-MAHMOUD S, RAMOS J E, SHATTERS R G J, et al. Cloning and characterization of a basic cysteine-like protease (cathepsin L1) expressed in the gut of larval ?Diaprepes abbreviatus ?L. (Coleoptera: Curculionidae) [J]. Journal of Insect Physiology, 2015, 72: 1-13.
[9] PEI Z, BIAN L, ZHANG H, et al. Cloning, expression, and purification of a new antibacterial substance gene from larvae of ?Musca domestica ?(Diptera: Muscidae) [J]. Journal of Insect Science, 2014, 14(1): 253.
[10] ACTON T B, XIAO R, ANDERSON S, et al. Preparation of protein samples for NMR structure, function, and small-molecule screening studies [J]. Methods In Enzymology,2011, 493:21-60.
[11] BLOCK H, MAERTENS B, SPRIESTERSBACH A, et al. Immobilized-metal affinity chromatography (IMAC) [J].Methods in Enzymology,2009, 463: 439-73.
[12] CARSON M, JOHNSON D H, MCDONALD H, et al. His-tag impact on structure [J]. Acta Crystallographica Section D: Biological Crystallography, 2007, 63(3): 295-301.
[13] XU W, CAO H, REN G, et al. An AIL/IL-based liquid/liquid extraction system for the purification of His-tagged proteins [J]. Applied Microbiology and Biotechnology, 2014, 98(12): 5665-5675.
[14] WEI T, KAEWTATHIP S, SHING K. Buffer effect on protein adsorption at liquid/solid interface [J]. Journal of Physical Chemistry C, 2009, 113(6): 2053-2062.
[15] HAMILTON S, ODILI J, PACIFICO M D, et al. Effect of imidazole on the solubility of a his-tagged antibody fragment [J]. Hybrid Hybridomics, 2003, 22(6): 347-355.
[16] LAN Q, BASSI A S, ZHU J X, et al. A modified langmuir model for the prediction of the effects of ionic strength on the equilibrium characteristics of protein adsorption onto ion exchange/affinity adsorbents [J]. Chemical Engineering Journal, 2001, 81(1-3):179-186.
[17] GALLAGHER S R. Digital image processing and analysis with imageJ [J]. Current Protocols Essential Laboratory Techniques, 2014, 9(1): 1-29.
[18] HENS K, LEMEY P, MACOURS N, et al. Cyclorraphan yolk proteins and lepidopteran minor yolk proteins originate from two unrelated lipase families [J]. Insect Molecular Biology, 2004, 13(6): 615-623.
[19] KI M R, PACK S P. Fusion tags to enhance heterologous protein expression [J]. Applied Microbiology and Biotechnology, 2020, 104(6): 2411-2425.
[20] LIU Z, HUANG D, FU X, et al. Comparison of three commonly used fusion tags for the expression of nanobodies in the cytoplasm of ?Escherichia coli ?[J]. Biotechnology & Biotechnological Equipment, 2018, 16: 1-8.
[21] BANEYX F. Recombinant protein expression in ?Escherichia coli ?[J]. Current Opinion in Biotechnology, 1999, 10(5): 411.
[22] 陳愛春,彭 偉,汪生鵬. 親和標簽在重組蛋白質表達與純化中的應用[J]. 中國生物工程雜志, 2012, 32(12): 93-103.
[23] PATHANGE L P, BEVAN D R, LARSON T J, et al. Correlation between protein binding strength on immobilized metal affinity chromatography and the histidine-related protein surface structure [J]. Analytical Chemistry, 2006, 78: 4443-4449
[24] JOHNSON R D, TODD R J, ARNOLD F H. Multipoint binding in metal-affinity chromatography II. Effect of pH and imidazole on chromatographic retention of engineered histidine-containing cytochromes c [J]. Journal of Chromatography A, 1996, 725: 225-235.
[25] YIP T T, HUTCHENS T W. Immobilized metal ion affinity chromatography [J]. Molecular Biotechnology, 1994, 1(2): 151-164.
[26] HEMDAN E S, ZHAO Y J, SULKOWSKI E, et al. Surface topography of histidine residues: a facile probe by immobilized metal ion affinity chromatography [J].Proceedings of the National Academy of Sciences of the United States of America,1989, 86(6): 1811-1815.
[27] LEE J J, BRULEY D F, KANG K A . Manipulation of the affinity between protein and metal ions by imidazole and pH for metal affinity purification of protein C from Cohn fraction IV-1.[J]. Advances in Experimental Medicine & Biology, 2008, 614(614):93-100.
[28] 楊 健,富天昕,張 舒,等. pH值對米糠清蛋白質和球蛋白質的結構、溶解性及表面疏水性的影響[J].食品科學, 2020, 41(18): 51-57.
[29] ZIDANI S, FAHLOUL D, BACHA A. Effects of pH, NaCl, ethanol, and drying methods on the solubility of Saccharomyces cerevisiae proteins[J]. CyTA - Journal of Food, 2012, 10(1): 42-47.
[30] FRANCO L F M, FILHO P D A P. On the solubility of proteins as a function of pH: mathematical development and application [J]. Fluid Phase Equilibria, 2011, 306(2): 242-250.
[31] 宗緒巖,王世富,李 麗. pH及陽離子濃度對柞蠶蛹蛋白質溶解性的影響[J].蠶業科學, 2005(4): 494-496.
(責任編輯:陳海霞)
收稿日期:2021-11-30
基金項目:江蘇省農業科技自主創新基金項目[CX(20)1004];國家自然科學基金項目(31572004);江蘇省自然科學基金項目(BK20170072)
作者簡介:王利華(1979-),女,四川仁壽人,博士,研究員,主要從事水稻害蟲發生規律及防治技術研究。張玉為共同第一作者。
通訊作者:方繼朝,(E-mail) fangjc126@126.com;紀 銳,(E-mail)411526774@qq.com

