實時剪切波彈性成像技術對孕晚期子癇前期胎盤的評估價值
陳 璐,陳 莉,劉志興
(南昌大學第一附屬醫院超聲醫學科,南昌 330006)
子癇前期(preeclampsia,PE)是一種在妊娠20周以后發生的復雜妊娠特異性高血壓伴多系統受累及受損的綜合征[1-2],是孕產婦和圍產期死亡的重要原因。大多數學者[3-5]認為PE的發病機制與胎盤功能不全有關,包括胎盤血管功能障礙、滋養層結構異常、炎癥水平升高、遺傳及營養等。PE孕婦胎盤血管功能異常引起血流減少、纖維蛋白沉積增多,滋養層結構異常導致胎盤功能及彈性發生改變[6]。剪切波彈性成像技術(shear-wave elastography,SWE)通過測量感興趣區組織楊氏模量值反映組織彈性硬度,廣泛應用于肝臟、宮頸、甲狀腺、乳腺、睪丸、腮腺等實質臟器,組織越硬,楊氏模量值越高,而組織硬度增加常反映組織可能發生一系列疾病狀態[7]。該技術應用于產科相對較少,本研究通過SWE測量孕晚期PE及健康孕晚期孕婦胎盤楊氏模量值,評估該量值對預測及診斷PE的臨床應用價值。
1 資料與方法
1.1 資料收集
連續性收集2017年10月至2018年10月就診于南昌大學第一附屬醫院婦產科的PE孕婦76例及正常妊娠監督的孕晚期孕婦210例。患者的既往病史、體格檢查、實驗室檢查等資料均來源于本院電子病歷系統數據庫。
排除標準:1)后壁胎盤;2)孕婦胎盤及臍帶畸形、胎盤內可見粗大鈣化等異常;3)胎兒發育畸形或多胎妊娠;4)不良妊娠史;5)重度貧血(HB<60 g·L-1)或合并其他疾病(如糖尿病、腎病等)的孕婦;6)羊水異常。患者均簽署知情同意書。
1.2 分組
286例孕婦中55例剔出研究隊列,包括23例孕婦胎盤位于后壁,1例胎盤巨大血池,雙胎妊娠5例,7例既往有不良妊娠結局史,5例妊娠合并糖尿病,羊水異常12例(羊水多8例,羊水少4例),2例胎死宮內。最終共納入60例PE孕婦(PE組),171例正常對照組孕婦(正常組)。

A:正常組孕婦,28歲,孕34+1周,胎盤中央Emean值為2.7 kPa;B:PE組孕婦31歲,孕36周,胎盤中央Emean值為31.5 kPa。
正常組:單胎妊娠,前壁胎盤,孕期血壓正常(收縮壓<140 mmHg和舒張壓<90 mmHg,1 mmHg=0.133 kPa);28~32周50例,>32~36周55例,>36~40周66例,正常組不同孕周孕婦年齡、BMI等比較差異無統計學意義。
PE組:單胎妊娠,前壁、側壁及宮底壁胎盤,收縮壓≥140 mmHg和/或舒張壓≥90 mmHg,伴有24 h尿蛋白≥0.3 g,或隨機尿蛋白(+)及以上。由婦產科醫師根據妊娠期高血壓疾病診療指南2015版[4]診斷為PE。28~32周11例,>32~36周18例,>36~40周31例。PE組BMI、年齡,血壓均高于正常組,且差異具有統計學意義(P<0.05)。見表1。

表1 2組一般資料比較
1.3 儀器設備及檢查方法
使用搭配凸陣探頭SC 6-1(頻率:1~6 MHz)法國聲科公司Supersonic Imagine AixPlorer型聲藍系列實時剪切波彈性成像超聲診斷儀。
檢查方法:孕婦取仰臥位,充分暴露腹部,選擇中晚孕檢查模式,常規行測量胎兒生長發育指標(股骨長、雙頂徑、頭圍、腹圍、胎心率),隨后對胎兒胎盤進行掃查,觀察胎盤位置、分級、胎盤形態等。對符合納排標準的孕婦進行胎盤楊氏模量值測定,具體方法:探頭輕放于皮膚,盡可能與胎盤垂直后,操作過程中禁止施壓,掃查至胎盤最大厚度切面,轉換至SWE模式,彈性閾值范圍設置為0~70 kPa,待圖像穩定2~3 s后凍結圖像,將感興趣區域(ROI)(設定Q-BOX直徑5 mm)分別放置在中央部分(胎盤中央的1/3)及邊緣部分,獲得胎盤各部位楊氏模量值Emean。各部位均重復3次測量后取平均值。
1.4 觀察指標
2組孕婦均隨訪至新生兒出生并記錄新生兒1 min Apgar評分。均利用SWE測量胎盤不同部位(中央和邊緣)的Emean值;比較正常組孕婦不同孕周(28~32周,>32~36周,>36~40周)的胎盤整體Emean值,分析該量值診斷PE的診斷效能,及與新生兒1 min Apgar評分的關系。胎盤整體Emean值=(胎盤邊緣Emean值+胎盤中央Emean值)/2。
1.5 統計學方法
2 結果
2.1 2組孕婦胎盤不同部位Emean值比較
2組孕婦胎盤中央和胎盤邊緣Emean值比較,差異無統計學意義(P>0.05)。較正常對照組:PE組孕婦胎盤中央和邊緣的Emean值更高(P<0.05),PE組孕婦胎盤整體Emean值亦更高(P<0.05)。見表2。2組胎盤中央部位Emean值SWE成像見封四圖1。
表2 2組孕婦胎盤不同部位Emean值比較
2.2 正常組孕婦不同孕周的胎盤整體Emean值比較
正常組28~32周、>32~36周、>36~40周孕婦Emean值分別為(6.05±1.24)、(6.39±1.04)、(6.29±1.25)kPa,正常組孕婦不同孕周的胎盤整體Emean值比較,差異無統計學意義(P=0.309)。
2.3 Emean值對PE的診斷效能
胎盤中央、邊緣、整體Emean值診斷PE的ROC曲線下面積(AUC)、其敏感性及特異性見表3、封四圖2。
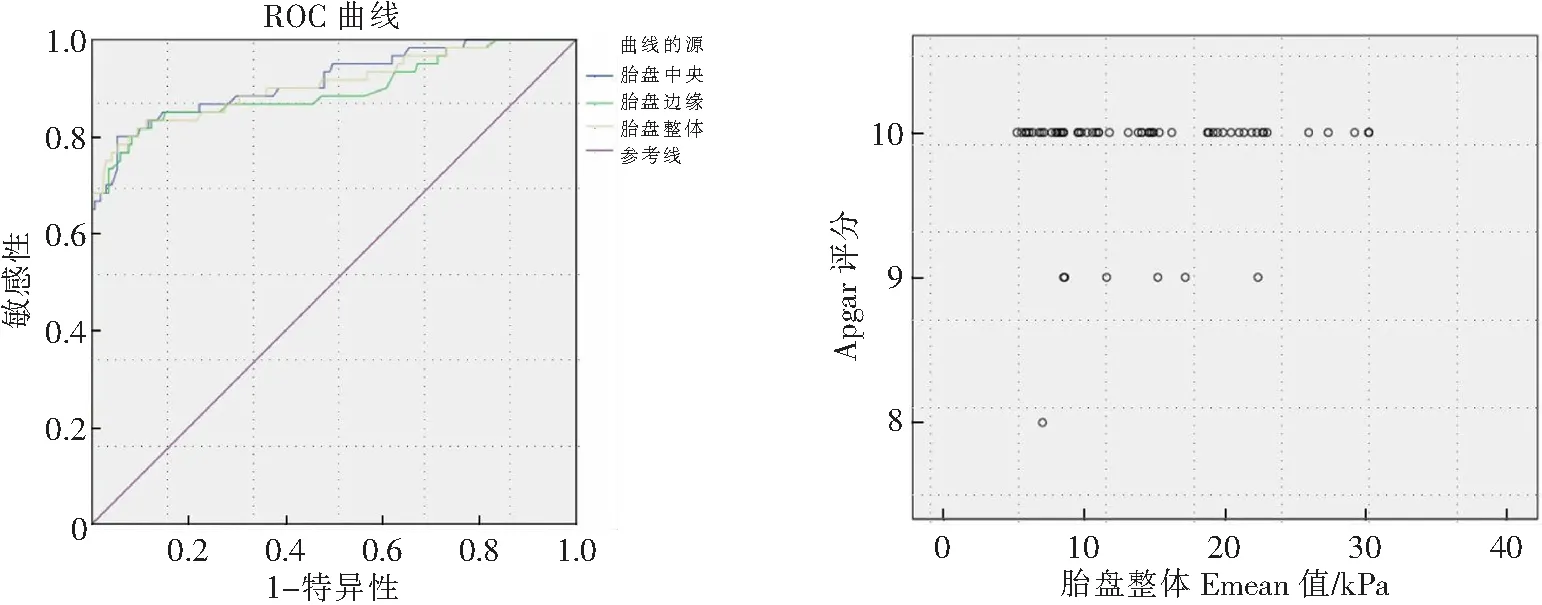
圖2 胎盤不同部位的Emean值診斷PE的ROC曲線 圖3 PE組胎盤整體Emean值與新生兒1 min Apgar評分散點圖
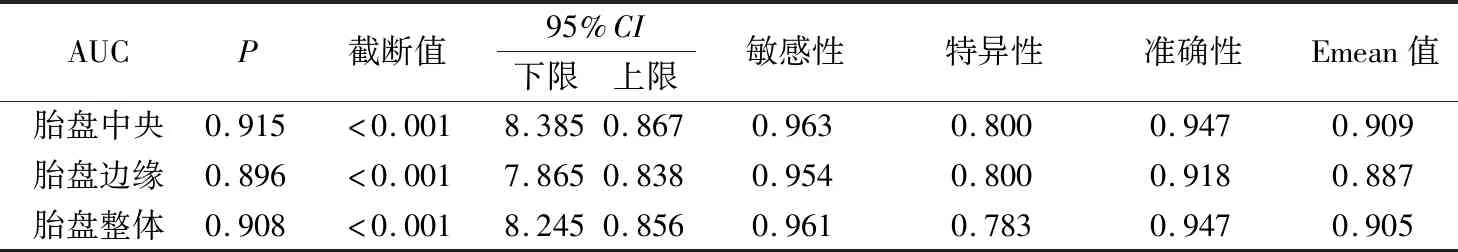
表3 不同部位胎盤Emean值診斷PE的ROC診斷效能
2.4 PE組胎盤整體Emean值與新生兒1 min Apgar評分
PE組孕婦胎盤整體Emean值與新生兒1 min Apgar評分無關(r=0.037,P=0.779),見封四圖3。
3 討論
SWE是基于“馬赫錐”現象,由超高速成像技術收集組織橫向傳播的橫波并計算其速度,通過彩色編碼的二維圖像可直接測量組織楊氏模量值,顏色越紅提示組織越硬。與應變式彈性成像及聲脈沖輻射力彈性成像技術相比具有重復性高、受操作者經驗影響小等優點,越來越多地被應用于臨床的診斷[8],如SWE評價肝纖維化程度可有效減少對肝活檢的依賴[9],而乳腺惡性結節由于其惡性細胞數量增多致密且浸潤周圍組織,使其變性,硬度也隨之增高[10]。
本研究發現2組孕婦中央區及邊緣區胎盤彈性值比較,差異無統計學意義(P>0.05),胎盤是構成蛻膜和絨毛膜板的富含血管的組織網,其隨孕周變化或病變(如高血壓)因素影響程度是均一的,因此胎盤中任意一點的彈性值均可代表整個胎盤,與相關報道一致[11-15]。本研究中PE組胎盤楊氏模量值較正常組高,PE組胎盤硬度增高可能是因為胎盤血管功能障礙及滋養層結構異常,孕婦胎盤缺血缺氧,刺激膠原沉積、血管纖維蛋白沉積以及纖維化發生。
國內有學者[16]比較妊娠晚期高血壓患者與正常孕婦胎盤不同部位(中央與邊緣)的彈性值,結果顯示胎盤中央與邊緣彈性值差異均有統計學意義(P<0.05);本研究發現,健康孕婦和PE孕婦胎盤中央和胎盤邊緣Emean值比較,差異均無統計學意義(P>0.05),兩者結果存在一定的差異。為進一步探尋更多的診療信息,本研究發現SWE技術測量胎盤中央、邊緣和整體楊氏模量值診斷PE病變的ROC曲線下面積分別為0.915、0.896、0.908。KILI?等[17]使用SWE評估PE患者胎盤,發現PE孕婦胎盤楊氏模量值明顯增高,得出PE診斷的最佳SWE Emean截斷值為7.35 kPa,其敏感性,特異性和準確性分別為90%、86%和88%;此外,該作者使用SWE評估PE患者胎盤的彈性,發現PE患者胎盤硬度明顯比正常對照組增高(P<0.05),因此認為SWE可作為PE患者胎盤評估的輔助診斷技術。SUGITANI等[13]研究聲輻射力彈性成像技術測量離體胎盤硬度,發現胎兒生長受限組的離體胎盤楊氏模量值明顯大于正常妊娠組胎盤(P<0.05),繼而提出應用SWE可評估體內胎盤功能。另有學者[12]采用SWE評估早發型PE患者的胎盤彈性,發現早發型患者的胎盤楊氏模量值明顯高于正常對照者(P<0.05)。以上結果與本研究結果相類似,因此筆者認為SWE可成為臨床評價胎盤功能的輔助技術。
有文獻[6]指出,在胎兒生長受限或PE孕婦胎盤中可觀察到合胞體周圍的纖維蛋白樣物質的沉積。既往認為胎盤老化其超聲表現多為胎盤實質內可見鈣化灶,而在乳腺及甲狀腺結節內研究中發現大多數含鈣化結節較無鈣化者楊氏模量值偏高,大多數學者認為鈣化出現可能影響其楊氏模量值[18]。本研究對孕晚期健康孕婦不同孕周胎盤楊氏模量值進行比較,結果顯示不同孕周孕婦的胎盤整體Emean值比較,差異無統計學意義(P=0.309),提示胎盤楊氏模量值與胎盤老化相關性不高;張維維等[19]亦對胎盤鈣化是否對彈性楊氏模量值有影響進行探討,結果顯示Ⅱ級及Ⅲ級胎盤鈣化對胎盤彈性楊氏模量無影響,與本研究結果相類似。但也有學者[20]提出,晚孕期胎盤內鈣化灶是否影響胎盤楊氏模量值仍然需增大樣本量進一步研究。由于本研究排除胎盤粗大鈣化孕婦,且在成像過程中也避開胎盤鈣化處,因此鈣化是否對胎盤硬度有關系,后期需加大樣本量進一步研究分析。
本研究隨訪追蹤發現,PE孕婦胎盤楊氏模量值與新生兒1 min Apgar評分無關,這與袁勝美等[16]觀點一致,其原因可能是納入的新生兒預后均較好、缺乏重癥患兒及Apgar評分具有一定主觀性。
超聲作為一項無創診療技術長期運用于診斷妊娠期病理狀況,有效避免放射性成像或侵入性檢查,SWE頻率與彩超相當,對妊娠期胎兒無明顯不良影響,且多項研究[17-23]均表明SWE評估胎盤硬度不會危害胎兒。總之,SWE可實時、定量評估胎盤硬度,SWE成像具有穩定性高、重復性好、分辨力高的特點,操作簡單且價廉等,為臨床早期預測及診斷子癇前期提供參考。

