BMSCs調節TGF-β1/Smad通路對肝硬化大鼠免疫調節功能的作用研究
盧斯霞 胡旭東 高 欣 程 聰 陳 思 (華中科技大學同濟醫學院附屬武漢金銀潭醫院肝病科,湖北省傳染病臨床醫學研究中心,中國醫學科學院武漢傳染性疾病診治研究中心,中國科學院武漢病毒研究所&武漢市金銀潭醫院感染性疾病與健康聯合實驗室,武漢 430010)
TGF-β1 是引起纖維化的關鍵因子,TGF-β1 可激活Smad,從而誘導纖維化相關基因轉錄和翻譯,導致膠原蛋白(collagen,Col)大量表達,參與纖維化過程[1]。近年研究顯示,機體免疫也參與肝纖維化過程,肝纖維化患者體內存在T淋巴細胞亞群改變,具有抗炎作用的T 輔助細胞17(T helper cells 17,Th17)比例提高,而具有抗炎作用的調節性T 細胞(regulatory T cells,Treg)水平則降低[2]。研究顯示,Th17/Treg 平衡受TGF-β/Smad 通路調控[3]。骨髓間充質肝細胞(bone marrow-derived mesenchymal stem cells,BMSCs)可輕易從骨髓中收集并在體外擴增,并分化為多種細胞類型,且具有免疫耐受優勢,在多種疾病治療中發揮作用[4]。一項臨床研究顯示,通過門靜脈給予BMSCs 可緩解乙型肝炎病毒相關慢性肝衰竭,并保護肝功能[5]。最新研究發現BMSCs可緩解由四氯化碳誘導的肝損傷和纖維化[6]。研究顯示,BMSCs 可誘導Th17/Treg 平衡[7]。但BMSCs 對肝纖維化的影響及作用機制尚不明確。本文主要分析BMSCs 通過TGF-β1/Smad 通路對肝纖維化和免疫情況的影響,為臨床更好地治療肝纖維化提供依據。
1 材料與方法
1.1 材料 SD 大鼠(SPF 級,雄性,6 周齡,體質量210~230 g,北京維通利華動物公司);四氯化碳、TRIzol(美國Sigma 公司);DMEM 培養基和牛血清(美國Gibco-BRL 公司);Ficoll 密度梯度培養基(德國Biochrom 公司);FITC 偶聯的抗大鼠CD29 抗體、PE偶聯的抗大鼠CD34抗體以及CYTOMICS FC 500流式細胞儀(美國Beckman Coulter 公司);ELISA 試劑盒、HE染色、Masson染色和TUNEL染色試劑盒(碧云天公司);Model 680酶標儀、PVDF膜(美國Bio-Rad);流式細胞儀及小鼠Treg/Th17 表型抗體試劑(美國Becton Dickinson 公司);免疫磁珠(美國Invitrogen 公司);組織勻漿機(美國Thermo Fisher Scientific公司);PrimeScript-RT 和SYBR Premix Ex Taq 試劑盒(日本TaKaRa 公司);RIPA 裂解緩沖液(北京Beyotime);BCA 試劑盒(武漢博斯特生物技術有限公司);抗體(美國Abcam公司)。
1.2 方法
1.2.1 BMSCs 分離、純化和鑒定 采用含10%牛血清的DMEM 沖洗大鼠整脛骨和股骨骨髓,根據Ficoll 密度梯度培養基說明書將沖洗的細胞重懸于完全培養基,37 ℃、5%CO2孵育14 d。細胞80%融合時,磷酸鹽緩沖鹽水洗滌2次并消化,為第一代細胞。當細胞傳代到第4代時,分別采用CD29抗體和CD34抗體染色,暗中孵育30 min,流式細胞術鑒定。
1.2.2 大鼠分組、建模和干預 36 只大鼠隨機分為對照組、模型組和BMSCs 組,每組12 只。模型組和BMSCs 組大鼠根據文獻[8]構建肝纖維化模型:將四氯化碳溶于橄欖油,濃度為10%,腹腔注射,1 ml/(kg·次),2 次/周,連續8 周,對照組注射等量生理鹽水。最后1次注射四氯化碳后尾靜脈注射BMSCs(3×106個),移植后第4周處死大鼠進行檢測[9]。
1.2.3 ELISA 檢測肝功能 取大鼠尾靜脈血5 ml,300 r/min離心15 min收集上清,根據試劑盒說明書加入抗體和顯色劑,終止顯色后15 min 內酶標儀檢測450 nm處吸光度,根據標準曲線計算AST和ALT濃度。
1.2.4 HE 染色檢測肝組織損傷 斷頭處死大鼠,收集肝動脈血管組織,多聚甲醛固定48 h,不同濃度乙醇脫水,二甲苯透明處理,石蠟包埋,切片(4 μm)。切片水化后制成玻片標本,加入蘇木精孵育5 min,加入0.5%伊紅染色5 min,洗滌后透化,固定,顯微鏡下觀察。
1.2.5 Masson 染色檢測纖維化 將1.2.4 的玻片標本加入Masson 三色染料染色,根據試劑盒說明書操作,顯微鏡下觀察并拍照,IPP 6.0 圖像分析系統計算膠原蛋白體積分數(collagen volume fraction,CVF)=膠原蛋白陽性藍色面積/組織總面積×100%。
1.2.6 流式細胞術檢測Th17和Treg水平 將外周血經過密度梯度離心后抽吸淋巴細胞層,獲得單個淋巴細胞懸浮液。細胞用20 μl預冷的1×BD Mouse Foxp3 緩沖液4 ℃暗室固定30 min,洗滌固定劑并收集細胞,加入200 μl 通透緩沖液37 ℃避光孵育30 min,透化2 次后洗滌細胞,與20 μl 小鼠Treg/Th17 表型抗體試劑或對照抗體室溫孵育30 min,洗掉抗體,重懸,FACSCalibur 流式細胞儀檢測Th17 細胞和Treg占比。
1.2.7 RT-qPCR 檢測mRNA 水平 密度梯度離心法分離單個核細胞,免疫磁珠分離淋巴細胞,TRIzol獲得肝組織及淋巴細胞中總RNA,逆轉錄1 μg RNA為cDNA(42 ℃60 min,70 ℃5 min,4 ℃保存)。采用SYBR Green PCR Master Mix 和PCR 檢 測 系 統 進 行qPCR 實驗(95 ℃10 min,40 個循環,94 ℃15 s,60 ℃1 min,60 ℃1 min,4 ℃保存)。以GAPDH為內參,通過比較循環閾值分析mRNA表達。
兩人在中南海愉快地住了幾天,到北京城看了看,算是開了眼界,見了世面,然后就準備回湖南老家。臨行前,毛澤東用自己的稿費為他們每人做了一套新衣服。
1.2.8 Western blot 檢測蛋白表達 勻漿機均勻研磨肝組織及淋巴細胞萃取總蛋白,BCA 試劑盒測量濃度。分別取40 μg 總蛋白采用10%聚丙烯酰胺凝膠進行電泳(PAGE,80~120 V,90 min)。100 mV 恒定電壓下濕轉至PVDF 膜,5%牛血清白蛋白(BSA)中室溫孵育1 h,加入一抗(1∶500 稀釋)4 ℃孵育過夜,洗滌,添加二抗室溫孵育1 h,化學發光試劑顯影,以GAPDH 為內參,Image J 軟件分析目標條帶灰度值。
1.3 統計學處理 采用SPSS19.0軟件進行統計學分析,數據以±s表示。多組間比較采用單因素方差分析,兩兩比較采用SNK-q檢驗,P<0.05 為差異具有統計學意義。
2 結果
2.1 BMSCs 鑒定結果 流式細胞術結果顯示,CD29 和CD90 呈陽性,CD34 呈陰性,提示BMSCs 分離成功(圖1)。

圖1 流式細胞術鑒定BMSCsFig.1 Identification of BMSCs by flow cytometry
2.2 BMSCs 對肝纖維化模型大鼠肝功能指標的影響 模型組大鼠ALT 和AST 水平顯著高于對照組(P<0.05),BMSCs 組大鼠ALT 和AST 水平顯著低于模型組(P<0.05,表1)。
表1 BMSCs 對肝纖維化模型大鼠肝功能指標的影響(±s,n=12,U/L)Tab.1 Effect of BMSCs on liver function indexes of liver fibrosis model mice(±s,n=12,U/L)

表1 BMSCs 對肝纖維化模型大鼠肝功能指標的影響(±s,n=12,U/L)Tab.1 Effect of BMSCs on liver function indexes of liver fibrosis model mice(±s,n=12,U/L)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
AST 109.43±10.64 252.67±25.491)174.82±21.902)86.315 0.000 Groups Control Model BMSCs F P ALT 38.62±421.00 142.35±17.181)85.18±10.442)136.743 0.000
2.3 BMSCs 對肝纖維化模型大鼠肝組織損傷的影響 對照組大鼠肝組織染色均勻,細胞核呈圓形,排列有序,肝小葉結構清晰;模型組大鼠肝細胞膨大,肝小葉結構損傷,并出現嚴重出血和炎癥浸潤;BMSCs 組大鼠可觀察到肝小葉結構,炎癥浸潤情況較模型組減輕(圖2)。
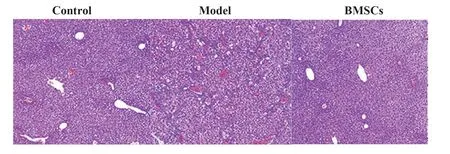
圖2 HE 染色檢測BMSCs 對肝纖維化模型大鼠肝組織損傷的影響(×200)Fig.2 HE staining to detect effects of BMSCs on liver tissue damage in mice with liver fibrosis(×200)
2.4 BMSCs 對肝纖維化模型大鼠肝纖維化的影響 紅色為細胞,藍色為被染色的Col 等纖維化組織。模型組大鼠CVF 水平顯著高于對照組(P<0.05),BMSCs 組大鼠CVF 水平顯著低于模型組(P<0.05,圖3、表2)。
表2 BMSCs 對肝纖維化模型大鼠肝纖維化的影響(±s,n=12)Tab.2 Effects of BMSCs on liver fibrosis in mice with liver fibrosis(±s,n=12)

表2 BMSCs 對肝纖維化模型大鼠肝纖維化的影響(±s,n=12)Tab.2 Effects of BMSCs on liver fibrosis in mice with liver fibrosis(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
CVF/%0.91±0.12 11.47±1.451)4.82±0.792)159.431 0.000 Groups Control Model BMSCs FP
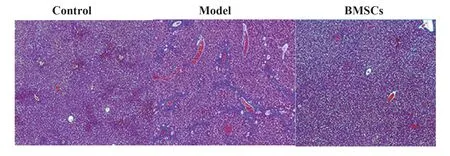
圖3 Masson染色觀察BMSCs對肝纖維化模型大鼠肝纖維化的影響(×200)Fig.3 Effect of BMSCs on liver fibrosis in mice with liver fibrosis detected by Masson staining(×200)
2.5 BMSCs 對肝纖維化模型大鼠Col Ⅰ和Col ⅢmRNA 表達的影響 模型組大鼠Col Ⅰ和Col ⅢmRNA 表達平顯著高于對照組(P<0.05),BMSCs 組Col Ⅰ和Col ⅢmRNA 表達顯著低于模型組(P<0.05,表3)。
表3 BMSCs 對肝纖維化模型大鼠Col Ⅰ和Col ⅢmRNA表達的影響(±s,n=12)Tab.3 Effects of BMSCs on expressions of Col Ⅰand ColⅢmRNA in liver fibrosis model rats(±s,n=12)
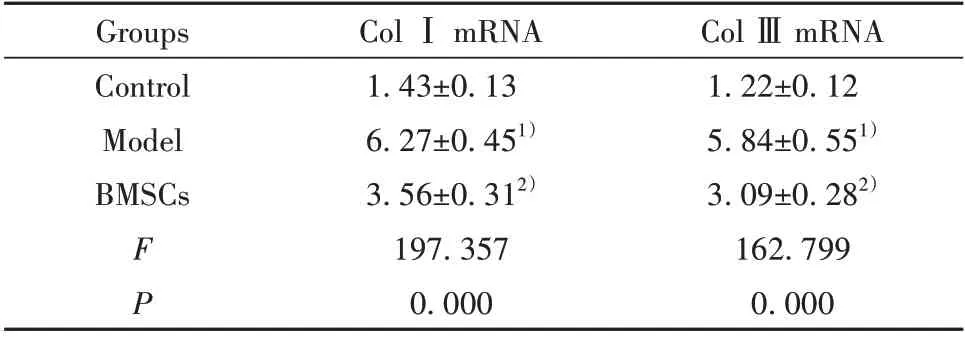
表3 BMSCs 對肝纖維化模型大鼠Col Ⅰ和Col ⅢmRNA表達的影響(±s,n=12)Tab.3 Effects of BMSCs on expressions of Col Ⅰand ColⅢmRNA in liver fibrosis model rats(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Col ⅢmRNA 1.22±0.12 5.84±0.551)3.09±0.282)162.799 0.000 Groups Control Model BMSCs FP Col ⅠmRNA 1.43±0.13 6.27±0.451)3.56±0.312)197.357 0.000
2.6 BMSCs對肝纖維化模型大鼠Col Ⅰ和Col Ⅲ蛋白表達的影響 模型組大鼠Col Ⅰ和Col Ⅲ表達顯著高于對照組(P<0.05),BMSCs 組Col Ⅰ和Col Ⅲ表達顯著低于模型組(P<0.05,圖4、表4)。
表4 BMSCs 對肝纖維化模型大鼠Col Ⅰ和Col Ⅲ表達的影響(±s,n=12)Tab.4 Effects of BMSCs on expressions of Col Ⅰand Col Ⅲin liver fibrosis model rats(±s,n=12)
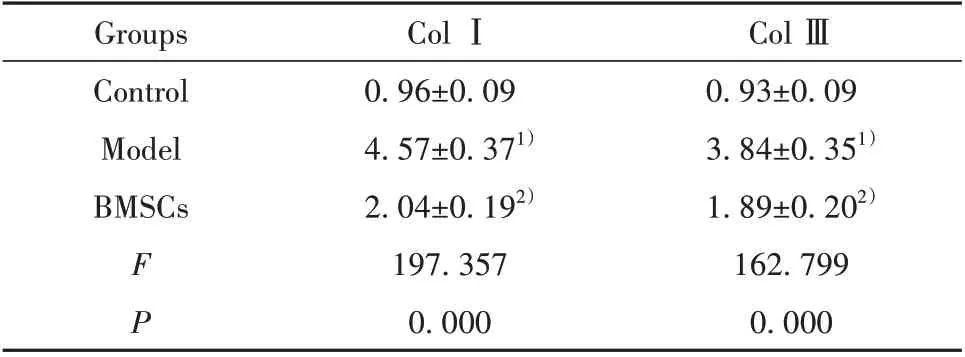
表4 BMSCs 對肝纖維化模型大鼠Col Ⅰ和Col Ⅲ表達的影響(±s,n=12)Tab.4 Effects of BMSCs on expressions of Col Ⅰand Col Ⅲin liver fibrosis model rats(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Col Ⅲ0.93±0.09 3.84±0.351)1.89±0.202)162.799 0.000 Groups Control Model BMSCs FP Col Ⅰ0.96±0.09 4.57±0.371)2.04±0.192)197.357 0.000
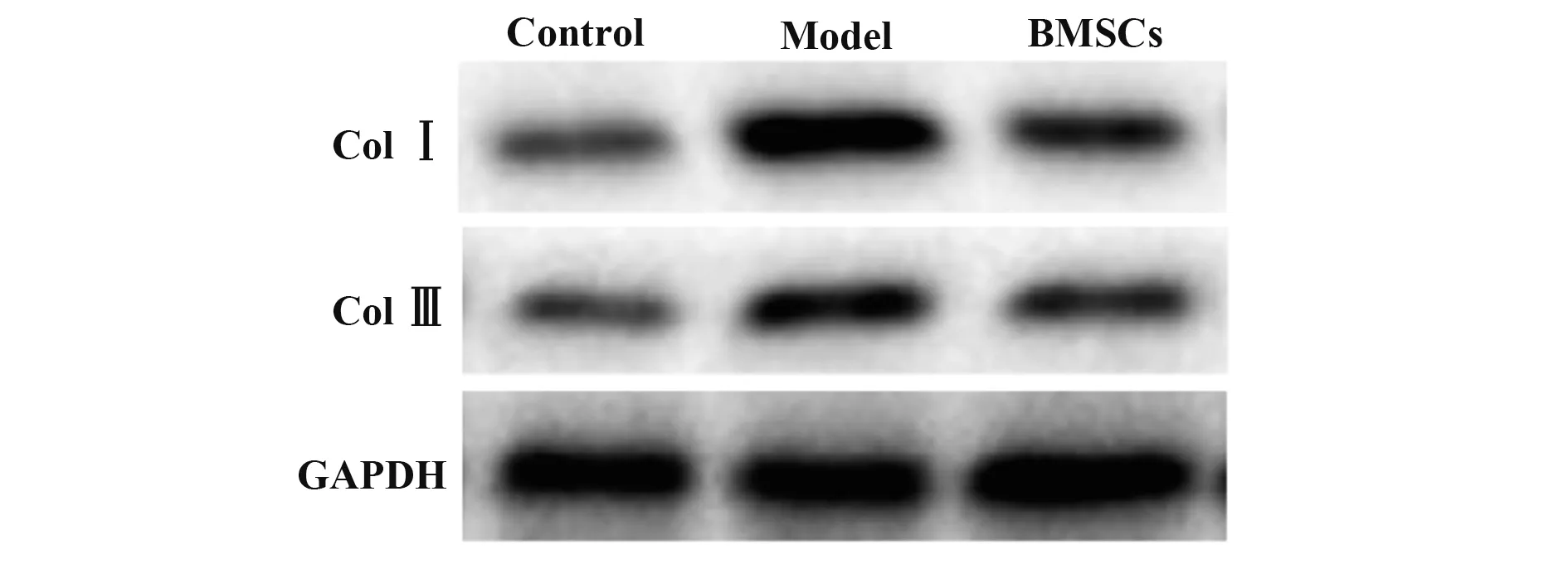
圖4 Western blot檢測BMSCs對肝纖維化模型大鼠Col Ⅰ和Col Ⅲ表達的影響Fig.4 Western blot detection of effect of BMSCs on expressions of Col Ⅰand Col Ⅲin liver fibrosis model rats
表5 BMSCs 對肝纖維化模型大鼠TGF-β1 和Smad mRNA表達的影響(±s,n=12)Tab.5 Effect of BMSCs on expressions of TGF-β1 and Smad mRNA in liver fibrosis model rats(±s,n=12)
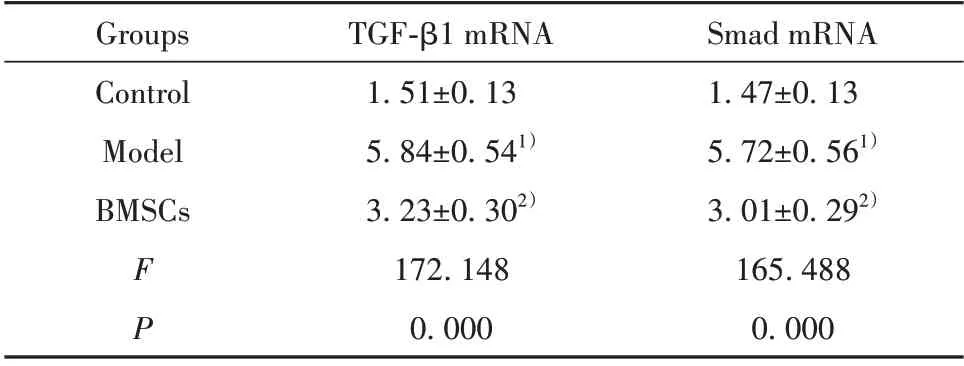
表5 BMSCs 對肝纖維化模型大鼠TGF-β1 和Smad mRNA表達的影響(±s,n=12)Tab.5 Effect of BMSCs on expressions of TGF-β1 and Smad mRNA in liver fibrosis model rats(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Smad mRNA 1.47±0.13 5.72±0.561)3.01±0.292)165.488 0.000 Groups Control Model BMSCs FP TGF-β1 mRNA 1.51±0.13 5.84±0.541)3.23±0.302)172.148 0.000
2.8 BMSCs 對肝纖維化模型大鼠TGF-β1/Smad 通路中蛋白表達的影響 模型組大鼠TGF-β1和Smad蛋白表達顯著高于對照組(P<0.05),BMSCs 組TGF-β1和Smad蛋白表達顯著低于模型組(P<0.05,圖5、表6)。
表6 BMSCs 對肝纖維化模型大鼠TGF-β1/Smad 通路中蛋白表達的影響(±s,n=12)Tab.6 Effect of BMSCs on protein expressions of TGF-β1/Smad pathway in liver fibrosis model rats(±s,n=12)
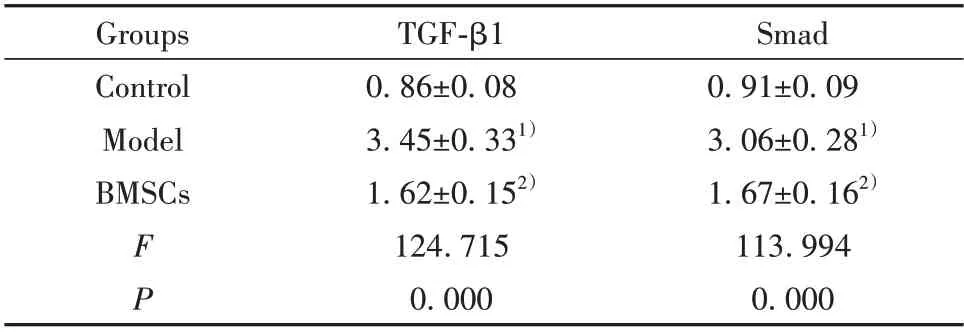
表6 BMSCs 對肝纖維化模型大鼠TGF-β1/Smad 通路中蛋白表達的影響(±s,n=12)Tab.6 Effect of BMSCs on protein expressions of TGF-β1/Smad pathway in liver fibrosis model rats(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Smad 0.91±0.09 3.06±0.281)1.67±0.162)113.994 0.000 Groups Control Model BMSCs FP TGF-β1 0.86±0.08 3.45±0.331)1.62±0.152)124.715 0.000
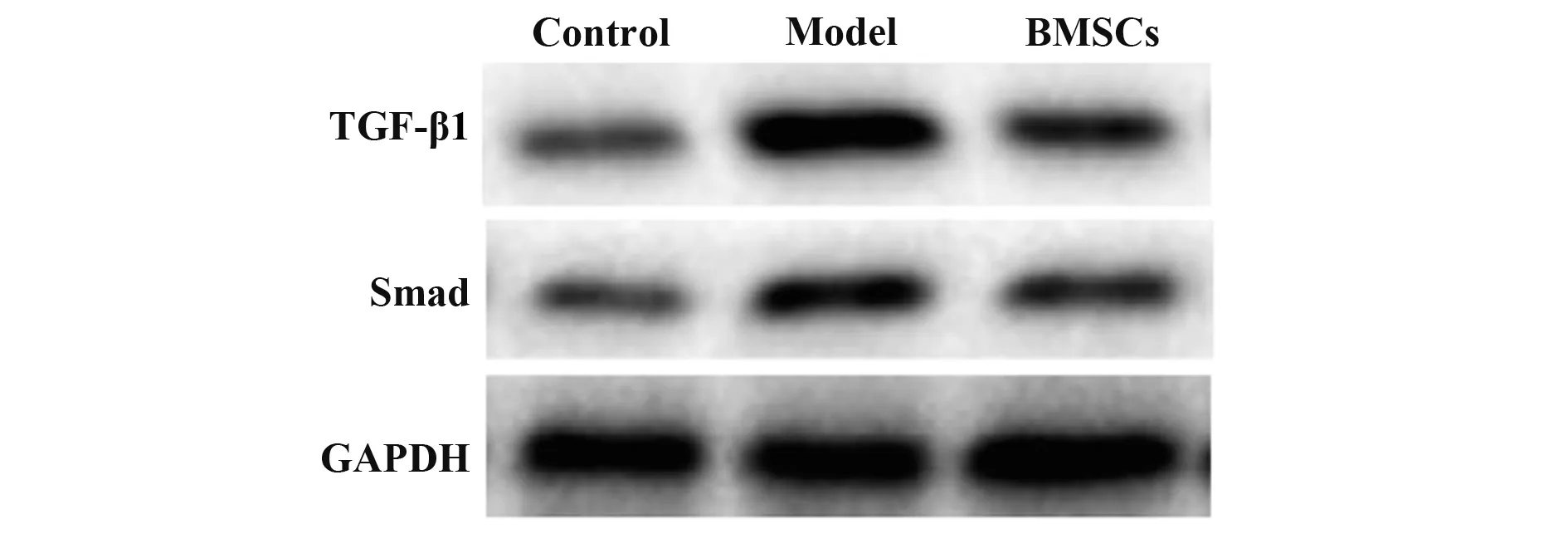
圖5 Western blot檢測BMSCs對肝纖維化模型大鼠TGF-β1/Smad通路中蛋白表達的影響Fig.5 Western blot detection of effect of BMSCs on pro?tein expressions of TGF-β1/Smad pathway in liver fibrosis model rats
2.9 BMSCs對肝纖維化模型大鼠Th17/Treg水平的影響 模型組大鼠Th17 水平和Th17/Treg 顯著高于對照組,Treg水平顯著低于對照組(P<0.05)。BMSCs組Th17水平和Th17/Treg顯著低于模型組,Treg水平顯著高于模型組(P<0.05,圖6、表7)。
表7 BMSCs 對肝纖維化模型大鼠Th17 細胞、Treg 水平的影響(±s,n=12)Tab.7 Effect of BMSCs on Th17 cells and Treg levels in liver fibrosis model rats(±s,n=12)
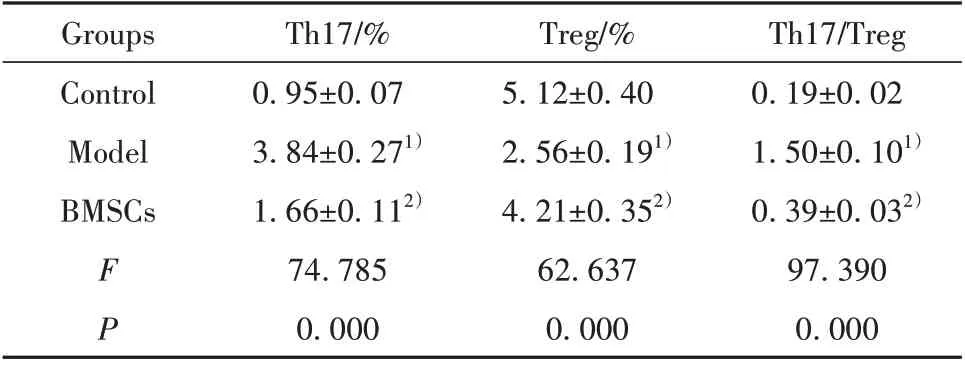
表7 BMSCs 對肝纖維化模型大鼠Th17 細胞、Treg 水平的影響(±s,n=12)Tab.7 Effect of BMSCs on Th17 cells and Treg levels in liver fibrosis model rats(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Th17/Treg 0.19±0.02 1.50±0.101)0.39±0.032)97.390 0.000 Groups Control Model BMSCs FP Th17/%0.95±0.07 3.84±0.271)1.66±0.112)74.785 0.000 Treg/%5.12±0.40 2.56±0.191)4.21±0.352)62.637 0.000

圖6 流式細胞術檢測BMSCs 對肝纖維化模型大鼠Th17細胞、Treg水平的影響Fig.6 Flow cytometry to detect effect of BMSCs on Th17 cells and Treg levels in liver fibrosis model rats
2.10 BMSCs對外周血淋巴細胞TGF-β1/Smad通路的影響 模型組大鼠單個核細胞中TGF-β1和Smad蛋白水平顯著高于對照組(P<0.05),BMSCs 組單個核細胞中TGF-β1 和Smad 蛋白顯著低于模型組(P<0.05,圖7、表8)。
表8 BMSCs 對外周血淋巴細胞中TGF-β1/Smad 通路的影響(±s,n=12)Tab.8 Effect of BMSCs on TGF-β1/Smad pathway in pe?ripheral blood lymphocytes(±s,n=12)
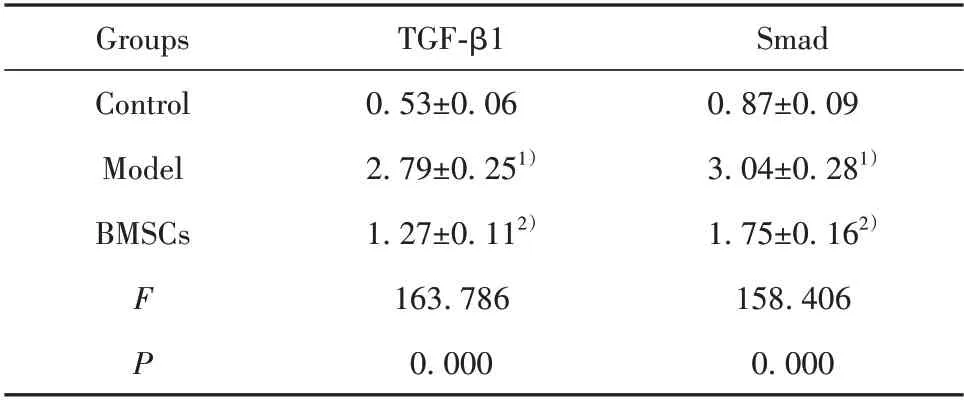
表8 BMSCs 對外周血淋巴細胞中TGF-β1/Smad 通路的影響(±s,n=12)Tab.8 Effect of BMSCs on TGF-β1/Smad pathway in pe?ripheral blood lymphocytes(±s,n=12)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
Smad 0.87±0.09 3.04±0.281)1.75±0.162)158.406 0.000 Groups Control Model BMSCs F P TGF-β1 0.53±0.06 2.79±0.251)1.27±0.112)163.786 0.000

圖7 Western blot 檢測BMSCs 對外周血淋巴細胞TGF-β1/Smad通路的影響Fig.7 Western blot detection of effect of BMSCs on TGF-β1/Smad pathway in peripheral blood lymphocytes
3 討論
肝纖維化是持續性和慢性肝損傷的結果,肝纖維化過程中,肝細胞凋亡,內皮屏障受損,炎癥細胞被募集,肝星狀細胞被激活,從而導致細胞外基質合成和降解失調,最終導致肝功能衰竭[10-11]。肝纖維化發病機制尚不清楚,研究認為病毒性肝炎、酒精、藥物、代謝性疾病和自身免疫性疾病均可能引起慢性肝損傷導致肝纖維化,肝纖維化若得不到控制會發展為肝硬化甚至肝衰竭,嚴重影響患者生活質量和生命健康,但目前尚無可用于治療肝纖維化的特異性有效療法[12]。尋找可有效緩解肝纖維化的方法具有重要臨床意義。
BMSCs 具有歸巢效應,當組織損傷時,機體中的干細胞會向損傷部位遷移并分泌各種因子保護組織損傷,研究顯示BMSCs 移植可有效緩解肝衰竭,保護肝功能[13]。近年研究發現BMSCs 對組織纖維化也具有緩解作用,如肺纖維化[14]。肝纖維化中,BMSCs 也具有緩解作用,但其效果和作用機制尚不明確。本研究顯示,BMSCs 抑制可明顯緩解肝組織損傷,抑制Col Ⅰ和Col Ⅲ轉錄和翻譯,并抑制纖維化保護肝功能。此外,本研究顯示,BMSCs 也可減少肝組織TGF-β1/Smad通路關鍵蛋白轉錄和翻譯。TGF-β1是纖維化的最關鍵因子之一,其高表達會激活Smad 轉錄功能,從而促進Col Ⅰ和Col Ⅲ轉錄和翻譯,導致肝纖維化[15]。王磊等[16]研究顯示,BMSCs抑制可通過抑制肺組織TGF-β1/Smad信號通路緩解炎癥反應,從而減輕大鼠急性肺損傷。胰腺炎大鼠模型中,BMSCs 也通過調控TGF-β1/Smad 信號通路緩解胰腺組織損傷[17]。BMSCs 也會通過外泌體抑制TGF-β1/Smad 途徑誘導子宮內膜修復[18]。提示四氯化碳誘導的肝纖維化大鼠模型中,BMSCs可能通過抑制肝組織中TGF-β1/Smad通路從而抑制Col轉錄和翻譯,進而緩解肝纖維化,保護肝功能。
近年研究顯示免疫炎癥反應在肝纖維化進程中發揮重要作用,肝纖維化病理過程中,Th17 細胞比例升高,誘導巨噬細胞、中性粒細胞等活化誘發炎癥反應,并可通過誘導IL-6和TGF-β1表達促進纖維化[19]。Treg 可拮抗Th17 細胞功能,分泌抗炎因子IL-4 和IL-10 等,從而抑制纖維化[20]。本研究顯示,BMSCs移植不僅可誘導Th17/Treg平衡向Treg偏移,還可抑制淋巴細胞TGF-β1/Smad通路。王凱等[21]研究顯示,BMSCs對不同淋巴細胞的影響不同,BMSCs可抑制Th17 細胞增殖并誘導Treg 增殖。BMSCs 可通過分泌鞘氨醇1 調節再生障礙性貧血患者Treg/Th17平衡[22]。也有研究顯示BMSCs通過調節TGF-β相關通路上調Treg水平并下調Th17細胞水平,從而緩解系統性紅斑狼瘡[23]。
綜上所述,BMSCs 可能通過抑制TGF-β1/Smad通路減少肝組織中Col 表達,并誘導Th17/Treg 向Treg 偏移,從而緩解肝纖維化。但BMSCs 抑制肝纖維化的療效仍需臨床研究,其作用機制需進一步探究。

