溫度對真眼點藻生長、總脂及二十碳五烯酸(EPA) 合成的影響
許瑾 李濤,,3 李楚琳 朱順妮 王忠銘 向文洲,3
(1. 中國科學院廣州能源研究所 廣東省新能源和可再生能源研究開發與應用重點實驗室 中國科學院可再生能源重點實驗室,廣州 510640;2. 中國科學院南海海洋研究所 中國科學院熱帶海洋生物資源與生態重點實驗室 廣東省海洋藥物重點實驗室,廣州 510301;3. 南方海洋科學與工程廣東省實驗室(廣州),廣州 511458)
二十碳五烯酸(C20:5,EPA)是一種人體不能合成但又不可缺少的ω-3長鏈多不飽和脂肪酸,它具有降低膽固醇、預防心腦血管疾病的功能[1],此外,它也是許多水生甲殼類動物生長發育不可缺少的營養物質[2]。自然界中許多微藻可以合成EPA,藻細胞合成的EPA主要存在于膜脂中[3-5],EPA對藻細胞具有儲存能量和碳源、清除胞內自由基和調節膜流動性等作用,對維持藻細胞生命活動具有重要意義[6]。
微藻細胞EPA的合成主要有ω-3和ω-6兩種途徑[6],乙酰輔酶a經脂肪酸從頭合成途徑生成C16:0,隨后在鏈延長酶、Δ9和Δ12去飽和酶的作用下,生成C18:2(ω-6)。ω-3途 徑 具 體 為C18:2(ω-6)→C18:3(ω-3)→C18:4(ω-3)→C20:4(ω-3)→EPA,其中涉及的酶依次為Δ15去飽和酶、Δ6去飽和酶、鏈延長酶和Δ5去飽和酶[6]。ω-6途徑具體為C18:2(ω-6)→C18:3(ω-6)→C20:3(ω-6)→C20:4(ω-6)→EPA,涉及的酶依次為Δ6去飽和酶、鏈延長酶、Δ5去飽和酶和Δ17去飽和酶[6]。許多脂肪酸去飽和酶并非以脂酰CoA或脂酰ACP為底物,而是以甘油脂為底物(如磷脂酰膽堿PC、單半乳糖甘油二脂MGDG、雙半乳糖甘油二脂DGDG和磷脂酰乙醇胺PE等),并且甘油酯的合成存在葉綠體與其他膜系統之間復雜且高度調控的相互作用[7],例如,EPA存在于類囊體膜的MGDG和DGDG中,而C16:0合成EPA需經鏈延長酶、Δ5和Δ6去飽和酶的催化,鏈延長酶存在胞質中,Δ5和Δ6去飽和酶存在于內質網中,因此葉綠體外合成的EPA必須穿梭回葉綠體,才能參與MGDG和DGDG合成[8],對高等植物的研究表明這一穿梭載體可能是PC或者二酰甘油[7],但對于產EPA微藻,這一過程仍然未被解析。
影響微藻EPA合成的因素主要包括光強、營養鹽、溫度和鹽度等,研究表明低溫有利于微藻多不飽和脂肪酸的合成,而高溫不利于多不飽和脂肪酸的合成[8]。真眼點藻(Eustigmatos sp.)可以積累高含量的EPA受到廣泛關注,目前該藻已完成了全基因組測序,有望成為EPA研究的新模式物種[9]。溫度作為影響真眼點藻EPA合成的重要因素,目前鮮有報道。本研究以一株自行分離的真眼點藻JHsu-01為材料,設置高溫(30℃)和低溫(15℃)兩種培養條件,通過測定藻細胞生長、脂類組成、脂肪酸組成和分布,研究溫度對真眼點藻EPA合成規律的影響,隨后利用轉錄組技術,探究脂肪酸和脂類合成相關酶基因轉錄水平的變化,研究結果為后續通過基因改造提高真眼點藻EPA產量提供理論依據。
1 材料與方法
1.1 材料
以真眼點藻(Eustigmatos sp. JHsu-01)為實驗材料,該藻株分離自廣東省韶關市丹霞山國家公園[10],現保藏于中國科學院廣州能源研究所。
1.2 方法
1.2.1 培養方法 該藻利用BG-11培養基培養[11],培養至對數生長期的藻細胞離心后重新懸浮于新鮮BG-11培養基中,初始接種OD750為0.50 ± 0.02,培養容器為500 mL三角燒瓶,置于三溫區光照培養箱中進行培養,培養時間為12 d。
設置2個處理組,分別為高溫處理組(30℃)和低溫處理組(15℃),每個處理組設置3個生物學重復。光強為300 μmol photons/(m2·s),連續照明,在培養周期中,每2 d測定生長參數(生物量和細胞密度)和光合效率,并收集藻泥利用FD-1-50冷凍干燥機(北京博醫康實驗儀器有限公司,中國)進行干燥,并保存在-20℃冰箱中備用。收集第6天藻泥,利用液氮速凍后,置于-80℃冰箱保存用于轉錄組測定。
1.2.2 細胞形態和細胞密度 使用BX41光學顯微鏡(Olympus,日本)觀察藻細胞形態,并用XB-K-25血球計數板(上海求精生化試劑儀器有限公司,中國)測定細胞密度。
1.2.3 生物量 取藻液10 mL過濾到預先烘好的混合纖維濾膜(重量為m1,g)上,將帶有藻細胞的濾膜置于80℃烘箱24 h,放置干燥器中冷卻至室溫后稱重(重量為m2,g)。
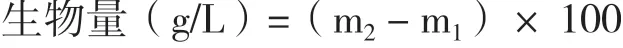
1.2.4 總脂含量和脂類層析分級 80 mg藻粉加入3 mL 10%二甲亞砜-甲醇溶液,分別于50℃抽提30 min、冰浴抽提30 min后,離心收集上清液于預先烘干的玻璃小瓶中,藻渣加入乙醚/正己烷6 mL(1∶1,V∶V),冰浴抽提1 h,離心收集上清液至同一玻璃小瓶中,重復上述過程直到藻渣變白。在合并的抽提液中加入3 mL純水,震蕩分相,移取有機相,并氮氣吹干至恒重,即得總脂含量[12]。
以一定體積的氯仿/甲醇(1∶1,V∶V)溶解總脂,利用500 mg Cleanert Silica硅膠柱(博納艾杰爾科技有限公司,天津)進行總脂層析分級,首先用10 mL的氯仿洗脫得到中性脂(主要為三酰甘油),然后用10 mL丙酮洗脫得到粗糖脂,最后用10 mL甲醇洗脫得到磷脂,收集每一組份于小玻璃瓶中,在通風櫥中用氮氣吹至較小體積,將濃縮液轉移至預先稱重的1.5 mL 塑料離心管中,用氮氣吹干至恒重,得到不同脂類組分的重量[13]。
1.2.5 脂肪酸組成和含量 稱25 mg藻粉,加入2 mL 2% H2SO4無水甲醇∶甲苯(90∶10,V∶V),充氬氣后,置于80℃的水浴加熱攪拌1.5 h,加入1 mL純水和1 mL正己烷震蕩分層,將上層有機相轉移到1.5 mL樣品瓶中,用氮氣吹干,同時加入1 mL碳十七烷酸甲酯,利用氣相色譜進行測定,獲得的脂肪酸峰與標準品圖譜比較,分析獲得其組成和含量。氣相色譜測定條件為DB-5毛細管柱(30 m × 0.25 mm),以高純氮氣為載氣,檢測器為FID檢測器,進樣口溫度260℃,程序升溫(60℃保留2 min→30℃/min升溫至120℃→1.5℃/min升溫至250℃保留2 min)[13]。
1.2.6 光合效率測定 利用脈沖調制式葉綠素熒光儀PAM-100(Walz,德國)測定光系統II的實際光量子產量Y(PSII)和調節性能量耗散的量子產量Y(NPQ)。取藻液5 mL,于黑暗處適應60 min,測定時,首先打開測量光(8 μmol photons·m-2·s-1)照射30 s, 測得初始熒光F0,隨后開啟飽和脈沖光(4 000 μmol photons·m-2·s-1)照射0.8 s,測得最大熒光Fm,打開光化光(300 μmol photons·m-2·s-1)照射10 min,測得最小熒光強度Fs,再次打開飽和脈沖光 (4 000 μmol photons·m-2·s-1)照 射0.8 s,測 得Fm′,根據以下公式計算得到Y(II)和Y(NPQ)。

Y(II)為光系統II的實際光量子產量,F′m為光化光條件下的最大熒光強度,Fs為光化光條件下的最小熒光強度,Fm為暗適應后的最大熒光強度。
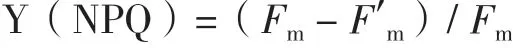
Y(NPQ)為光系統II調節性能量耗散的量子產量,F′m為光化光條件下的最大熒光強度,Fm為暗適應后的最大熒光強度。
1.2.7 轉錄組分析 (1)RNA提取、cDNA文庫構建及測序:利用RNA提取試劑盒提取總RNA,RNA純度和完整性分別利用NanDrop 1000 spectrophotometer(Termo Scientific,USA)和Agilent 2100 Bioanalyzer(Agilent,USA)進行檢測。去除rRNA后,利用mRNA Capture Beads富集真核生物mRNA,采用高溫和金屬離子作用實現mRNA的片段化。以mRNA為模板,用六堿基隨機引物合成單鏈cDNA,隨后進行雙鏈cDNA的合成反應,再用DNA Clean Beads純化雙鏈cDNA,純化的雙鏈cDNA先進行末端修復、加A尾并連接測序接頭,再用DNA Clean Beads進行片段大小分選。最后進行PCR擴增,并用DNA Clean Beads純化PCR產物,得到最終的文庫。構建好的文庫用Agilent 2100 Bioanalyzer進行質檢。最后,利用Illumina HiSeq2000進行測序。(2)De novo組裝及基因注釋:對原始數據進行去除接頭序列及低質量Reads的處理,獲得Clean Data;用短reads組裝軟件Trinity組裝,對組裝獲得的unigene進行BLAST,分別將unigene注釋到NR、Nt、Swiss-Prot、GO、KEGG和COG。(3)差異基因分析:利用FPKM(Fragments Per Kilobase of transcript per Million fragments mapped)計算基因表達量。FPKM代表的是每一百萬個能對比上Reads中每kb外顯子的片段數。錯誤發現率(false discovery rate,FDR)<0.001且log2(fold change)>±1作為篩選條件評價基因的差異性。
1.2.8 統計分析 本文中所有圖表所示的平均值和標準偏差均由3個生物學重復和3個測定重復計算獲得,利用SPSS 18.0進行數據分析(ANOVA),樣品均值之間的差異用最小顯著性差異(LSD)進行分析,置信度為0.05。
2 結果
2.1 溫度對真眼點藻生長的影響
真眼點藻JHsu-01在30℃和15℃培養條件下的生長情況如圖1-A和1-B所示,15℃處理組獲得了更高的生物量(0.57 g/L),較30℃(0.48 g/L)提高了18.8%。細胞密度的變化趨勢與生物量一致,15℃比30℃提高了17.8%。圖1-C和1-D是真眼點藻在30℃和15℃培養條件下的細胞形態,結果表明,溫度對真眼點藻JHsu-01的細胞形態影響較大,30℃時葉綠體分界不明顯,葉綠體出現片段化,細胞黃綠色,可見多個大且分散的眼點,眼點呈鮮紅色,15℃處理組,葉綠體結構完整,周生裂葉狀,細胞深綠色,存在1-2個眼點,眼點呈暗紅色。
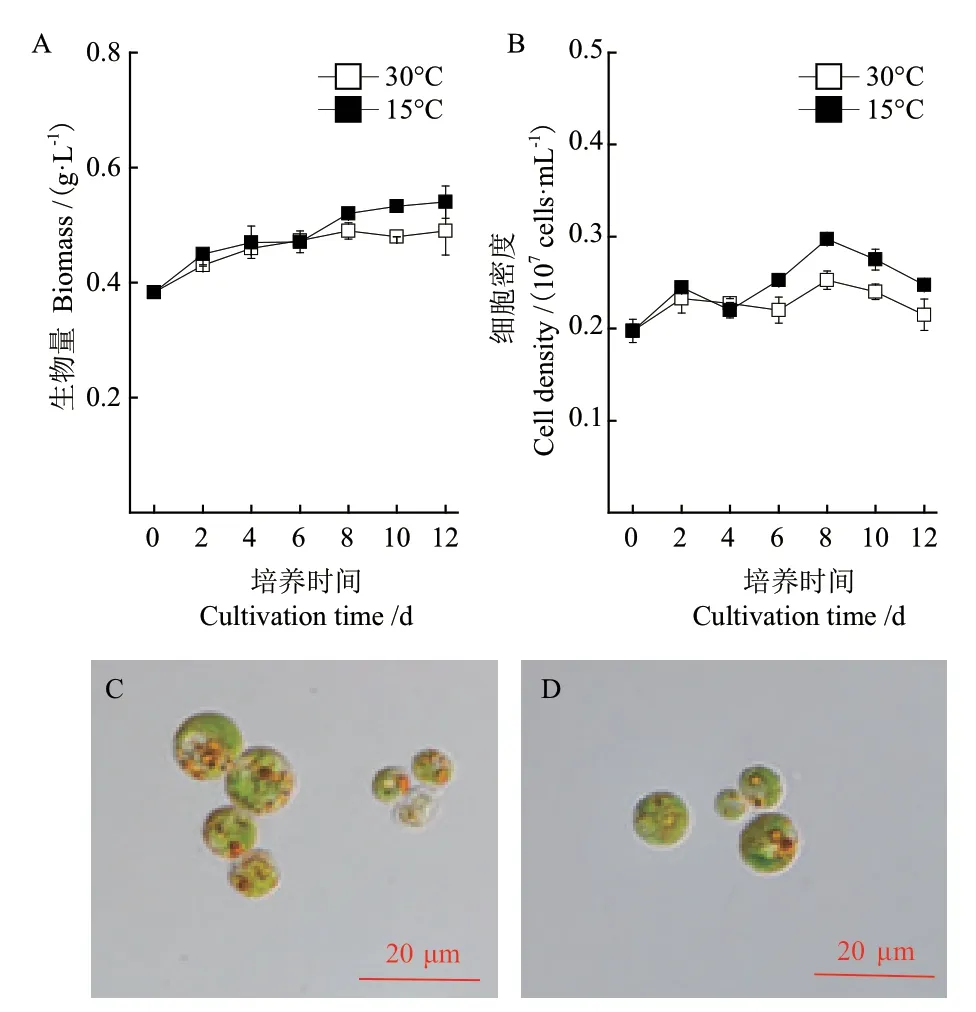
圖1 不同溫度培養下真眼點藻JHsu-01的細胞形態及生長特性Fig.1 Cell morphology and growth characteristics of Eustigmatos sp. JHsu-01 cultured at different temperatures
2.2 溫度對真眼點藻光合效率的影響
Y(PSII)表示藻細胞光系統II的實際光量子產量,如圖2-A所示,隨著培養時間的延長,30℃條件下,藻細胞的Y(PS II)均呈現降低趨勢,至培養結束,Y(PS II)降低幅度達到98.5%,說明30℃培養條件顯著抑制了藻細胞光系統II的活性。15℃條件下,藻細胞的Y(PS II)相對穩定。Y(NPQ)是光系統II的調節性能量耗散的量子產量,如圖2-B所示,30℃條件下,藻細胞的Y(NPQ)顯著高于15℃,說明藻細胞在30℃條件下將更多能量用于熱耗散。
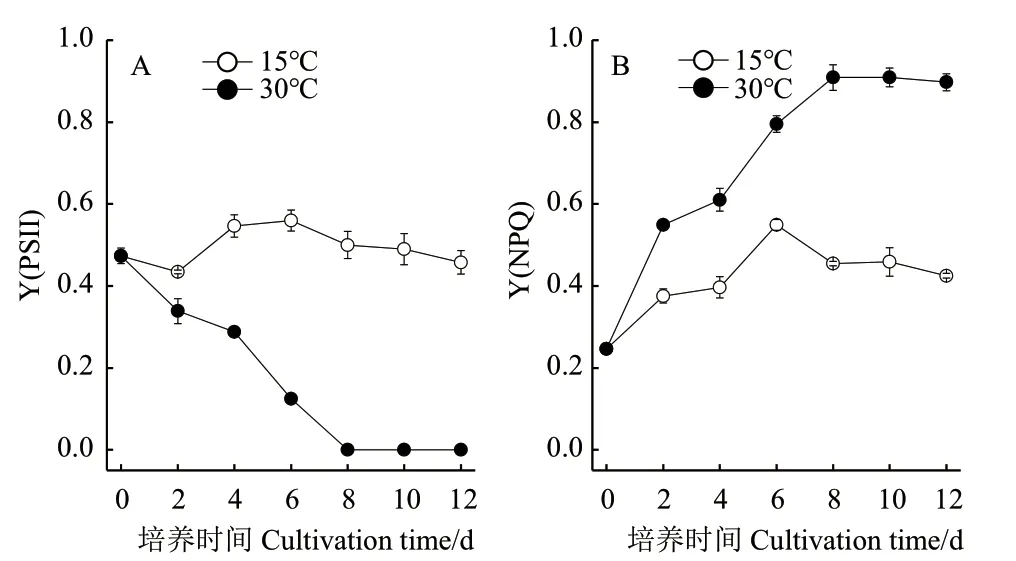
圖2 溫度對真眼點藻JHsu-01的PSII的實際光量子產量(A)和PSII的調節性能量耗散的量子產量(B)的影響Fig.2 Effects of temperature on the effective photochemical quantum yield of PSII(A)and quantum yield of the light-induced non-photochemical fluorescence quenching of PSII(B)of Eustigmatos sp. JHsu-01
2.3 溫度對真眼點藻脂類積累的影響
溫度對真眼點藻JHsu-01油脂含量的影響如圖3-A所示,30℃組從第2天開始總脂含量呈降低趨勢,而15℃組總脂含量逐漸增加,培養結束時,15℃組的總脂含量為20.3% DW,30℃處理組的總脂含量為16.0% DW。30℃培養條件下,中性脂比例逐漸增加,從初始的40.7% TL(total lipid)增加至62.3% TL,膜脂(糖脂+磷脂)的比例由59.3% TL降低至37.8% TL(圖3-B);15℃培養條件下,中性脂由40.7% TL增加至46.8% TL,膜脂(糖脂+磷脂)的比例由59.3% TL降低至53.3% TL(圖3-B),上述結果表明,30℃加速了中性脂的積累,但不利于膜脂的積累,而15℃有利于膜脂的積累,而不利于中性脂的積累。
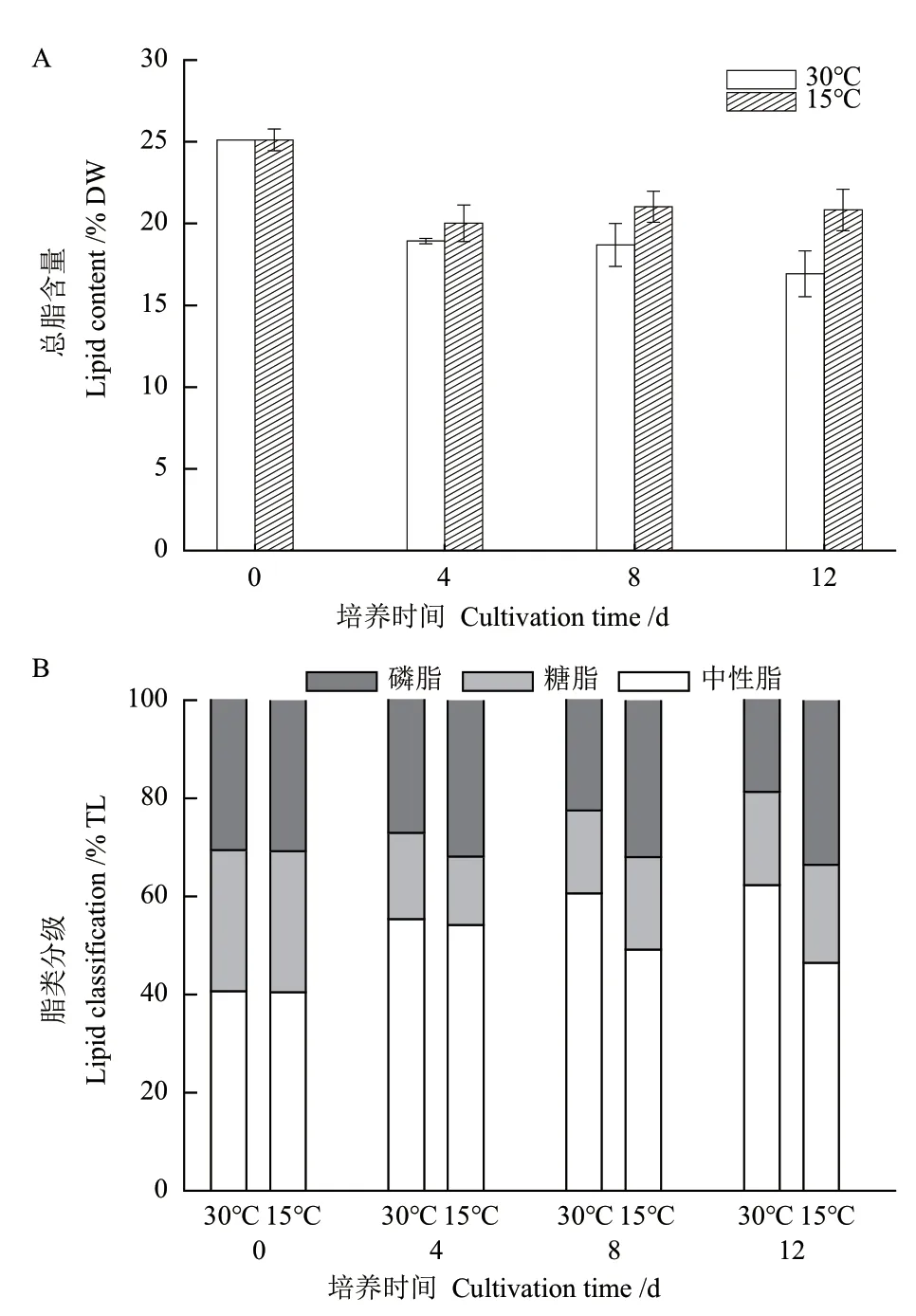
圖3 溫度對真眼點藻JHsu-01總脂含量(A)和脂類分級(B)的影響Fig.3 Effects of temperature on the total lipid content(A)and lipid classification(B)of Eustigmatos sp. JHsu-01
2.4 溫度對真眼點藻脂肪酸組成的影響
真眼點藻JHsu-01脂肪酸組成的時相變化如圖4所示,C16:0、C16:1、C18:1和C20:5是該藻的主要脂肪酸,30℃培養顯著提高了C16:1的比例,由培養初始的37.6% TFA(total fatty acid)增加至50.4% TFA,15℃培養時,C16:1的比例變化較小(在35.7%-37.6% TFA范圍變化)。30℃條件下,EPA由培養初始的23.8% TFA逐漸降至14.1% TFA,而15℃條件下,EPA的含量穩定在27.7%-28.7% TFA,上述結果表明,15℃有利于EPA的合成,而30℃不利于EPA的合成。
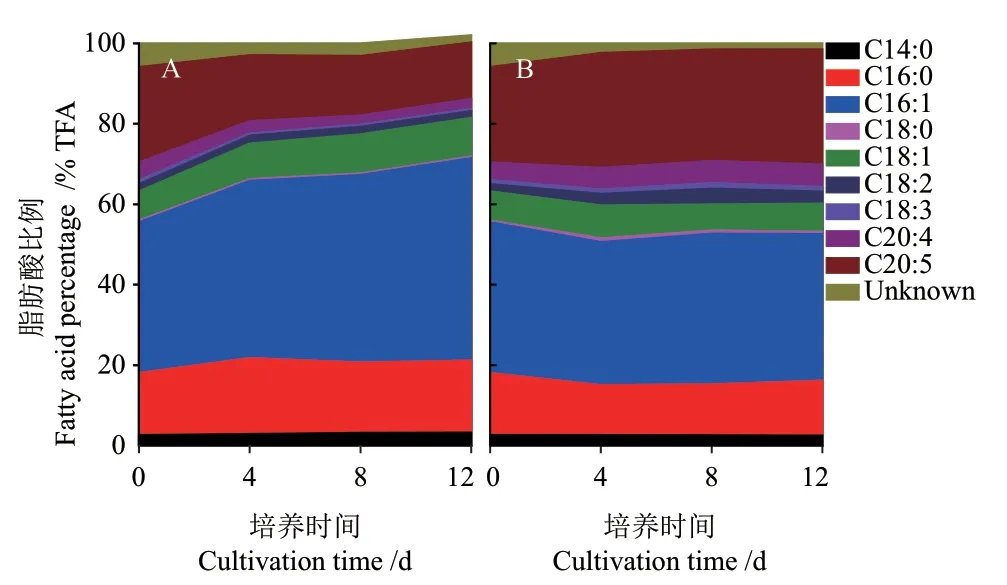
圖4 30℃(A)和15℃(B)培養溫度對真眼點藻JHsu-01脂肪酸組成的影響Fig.4 Effects of 30℃(A)and 15℃(B)on the fatty acid composition of Eustigmatos sp. JHsu-01
2.5 溫度對真眼點藻EPA分布的影響
由圖5-A和5-B可知,30℃培養顯著降低了真眼點藻的EPA含量,藻細胞EPA含量由2.30% DW(0 d)降低至1.37% DW(12 d),降低幅度達到40.6%(P<0.01),而15℃條件下,藻細胞中EPA含量由2.30% DW(0 d)增加至2.78% DW(12 d),增加幅度達到20.86%(P<0.05),說明15℃比30℃更有利于EPA的合成。進一步測定了不同脂組分的EPA含量(圖5-A和5-B),30℃培養條件下,中性脂的EPA含量變化較小,糖脂和磷脂的EPA含量明顯降低,至培養結束,糖脂和磷脂的EPA含量分別降低65.44%和69.95%(P<0.05),上述結果表明,膜脂中EPA含量的降低是導致EPA總量減低的原因。
為了分析藻細胞合成EPA后的去向問題,本研究分析了總EPA在中性脂、糖脂和磷脂的比例,由圖5-C和5-D可知,溫度可以影響藻細胞EPA在不同脂組分間的分布,15℃培養條件下,總EPA在中性脂、糖脂和磷脂中的比例分別為22.0%、62.0%和16.0%(第12天),而30℃培養條件下,總EPA在中性脂、糖脂和磷脂中的比例分別為40.9%、51.4%和8.3%(第12天),30℃培養條件下,EPA在中性脂的比例較15℃增加了85.9%(P<0.05),而在糖脂的比例較15℃降低了17.1%(P<0.05),上述結果表明,15℃條件下,微藻更多的EPA分布在糖脂和磷脂中,而30℃條件下,微藻將更多的EPA分布在中性脂中。
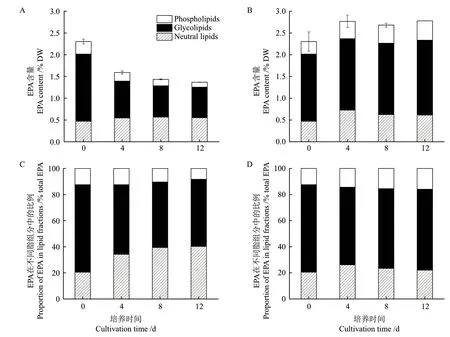
圖5 EPA在中性脂、糖脂和磷脂中的分布Fig.5 Distribution of EPA in neutral lipids,glycolipids and phospholipids
2.6 溫度對真眼點藻脂肪酸代謝相關通路的影響
測序及注釋:高通量測序獲得Raw Reads經過低質量數據過濾后,得到高質量Clean Reads分別為55.1 M(30℃)和49.8 M(15℃),GC含量均超過55%,Q20均大于98%,N堿基比例低于0.01%,表明轉錄組測序質量較高,可用于進一步的生物信息學分析;將Clean Reads數據de novo組裝獲得參考序列,獲得unigene數目為106 864個,將unigene與數據庫進行比對,共有67 363個成功得到了注釋,注釋率為63.0%。同源物種分布結果顯示物種相似度最高的5個物種分別為水云(22.4%)、伽得擬微綠球藻(13.1%)、玉米(6.1%)、大豆疫霉菌(6.0%)和抑食金球藻(5.2%)(圖6-A);E-value分布結果顯示31.8%的mapped sequences展示出較強的可信度(小于10-45),仍然有68.2%的mapped sequences展示出在10-5-10-45的可信度(圖6-B);序列覆蓋度結果顯示相似度大于80%的mapped sequences只有2.7%,其余mapped sequences展示出17-80%的相似度(圖6-C)。
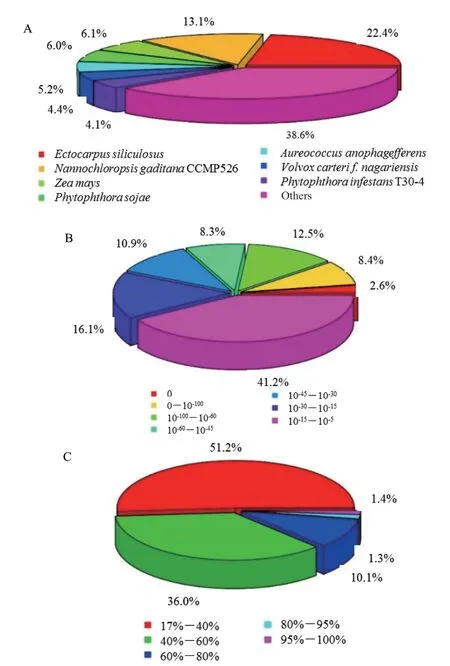
圖6 注釋基因的統計分析Fig.6 Statistical analysis of annotated genes
脂肪酸合成:乙酰輔酶a經乙酰CoA羧化酶(ACCase)催化生成丙二酸單酰-ACP,隨后經過縮合、還原、脫水和還原4步反應進行鏈延長,每循環一次增加2個碳,4步反應分別在3-酮酰基-ACP合成酶(fabF)、3-酮酰基-ACP還原酶(fabZ)、3-酮酰基-ACP脫水酶(fabG)和烯酯酰ACP還原酶I(fabI)進行,最終合成C16:0和C18:0。結果顯示accA、fabF、fabG、fabZ、fabI四個基因在15℃條件下均顯著上調,說明15℃條件下較30℃條件更有利于脂肪酸的合成(圖7和表1)。
脂肪酸去飽和:EPA合成中的3個關鍵去飽和酶(Δ5、Δ6和Δ15脂肪酸去飽和酶),在15℃條件下,均顯著上調(圖7和表1),說明15℃條件下較30℃條件更有利于EPA的合成,未注釋到Δ17脂肪酸去飽和酶,因此無法確定ω-6合成途徑是否存在。
硫脂和糖脂合成:SQDG合成中的兩個關鍵酶硫代異鼠基轉移酶(SQD2)和UDP-硫代異鼠糖合酶(SQD1)在15℃條件下均顯著上調;MGDG和DGDG合成中的兩個關鍵酶二酰基甘油3-β-半乳糖基轉移酶(MGD)和二半乳糖二酰基甘油合酶(DGD)在15℃條件下均顯著上調(圖7和表1),說明15℃條件下較30℃條件更有利于硫脂和糖脂的合成。
磷脂合成:PC、PE和磷脂酰絲氨酸(PS)合成中的3個關鍵酶CPT1、EPT1和PTDSS2下調,磷脂酰甘油(PG)的關鍵酶pgsA和GEP4無顯著性變化,磷脂酰肌醇(PI)合成中的關鍵酶CDIPT上調(圖7和表1)。
三酰甘油合成:磷酸二羥丙酮分別經3-磷酸甘油酰基轉移酶(GPDH)、甘油磷酸脫氫酶(GPAT)、1-酰基甘油-3-磷酸酰基轉移酶(plsC)、磷脂酸磷酸酶(PLPP)、二酰基甘油酰基轉移酶(DGAT)合成三酰甘油,其中,GPAT、plsC、PLPP和DGAT在15℃條件下均上調(圖7和表1),說明15℃條件下較30℃條件更有利于甘油酯的合成。
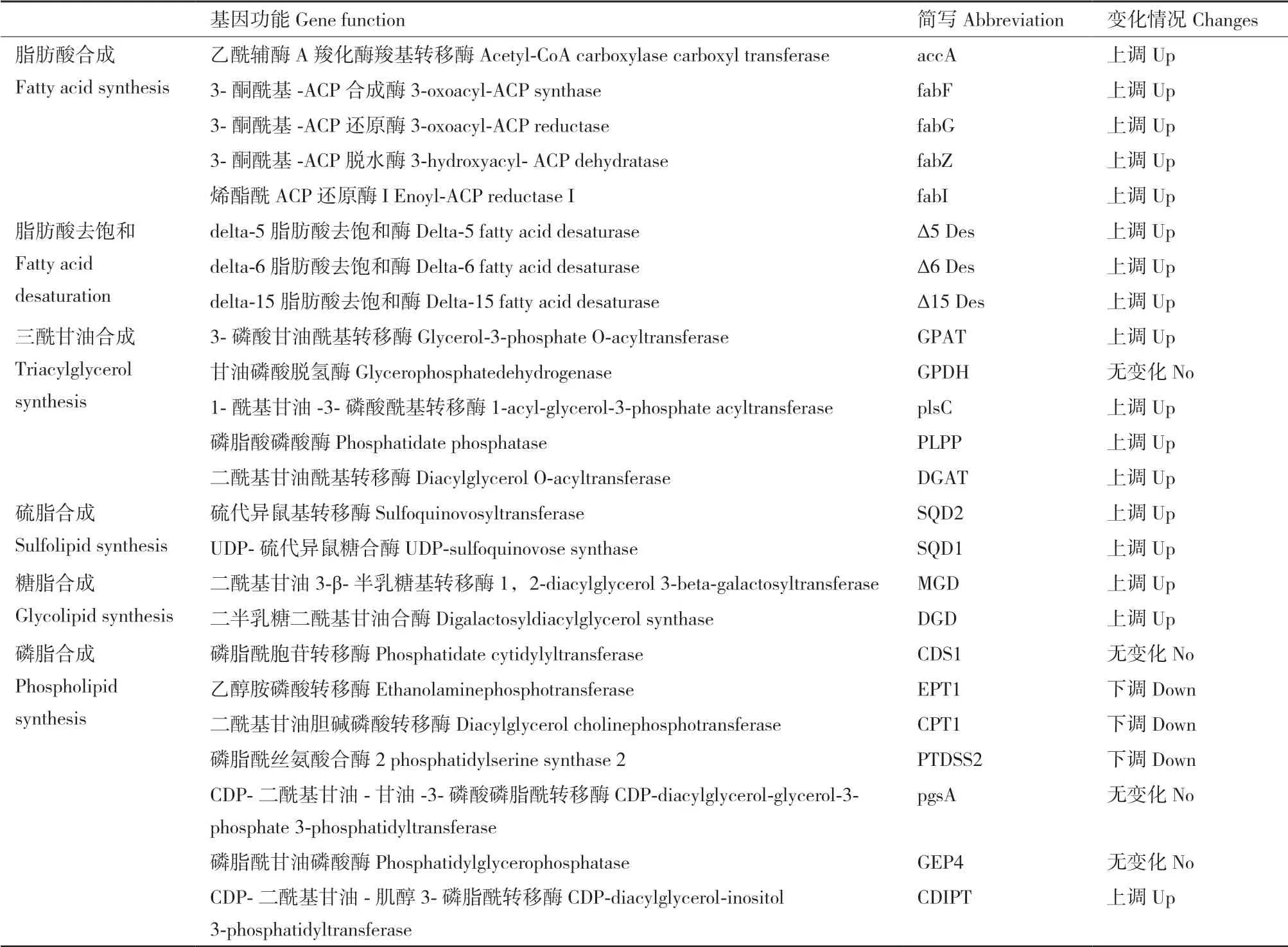
表1 脂肪酸合成相關酶基因的變化情況Table 1 Expression changes of genes in lipid and fatty acid biosynthesis pathways
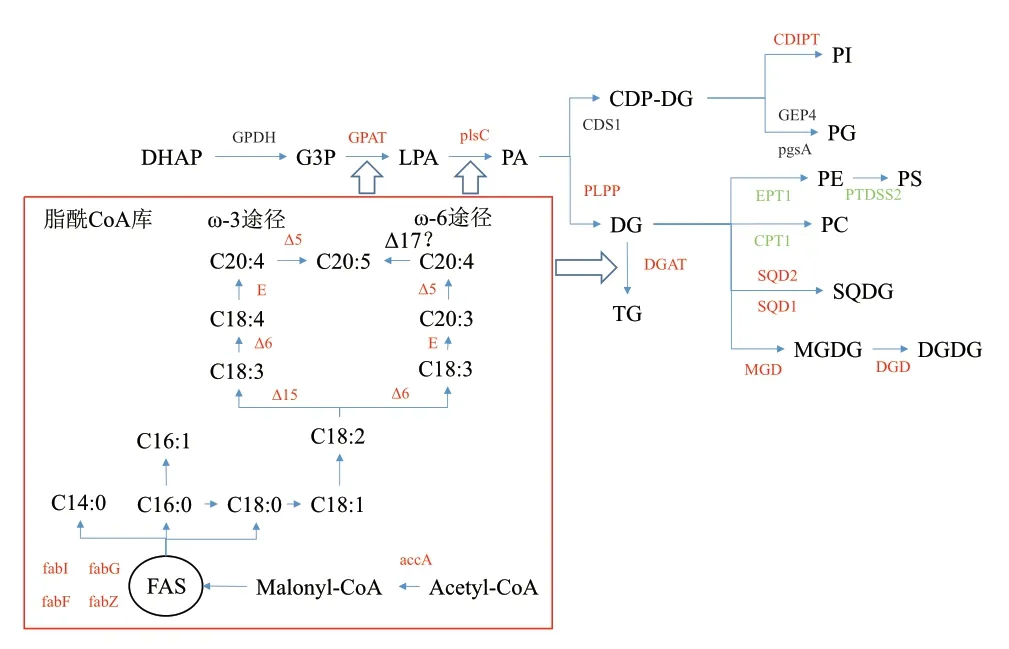
圖7 溫度對真眼點藻JHsu-01脂肪酸代謝通路的變化Fig.7 Changes of temperature on the fatty acid metabolic pathways of Eustigmatos sp. JHsu-01
3 討論
3.1 溫度影響真眼點藻的生長和脂類積累
溫度是影響微藻生長的重要環境因素之一,針對一些具有生物餌料潛力的微藻,研究溫度的影響尤為重要。本研究表明,真眼點藻JHsu-01在15℃條件下的細胞密度、生物量和光合效率均高于30℃培養條件,由于該藻株采集自廣東地區,生境溫度可達30℃以上,但實際上降低培養溫度更有利于其生長。大部分微藻在15-30℃均可以生長,但適宜生長的溫度卻各有不同,三角褐指藻(Phaeodactylum tricornutum CCMM2012)、微擬球藻(Nannochloropsis sp. CCMM6004)和 柵 藻(Scenedesmus quadricauda CCMM4002)的適宜生長溫度均為25℃[14],瑞典四爿藻(Tetraselmis suecica FIKU032)可以在40℃條件下生長[15]。真眼點藻綱共有1目6科13屬28種,它們在淡水、海水和土壤表面等環境中都有分布[16],大部分已報道的真眼點藻研究中,培養溫度通常為25℃[17],具體到真眼點藻綱的某一種類,適宜生長的溫度可能存在較大差異,適宜眼點擬微球藻(Nannochloropsis oculata)生長的溫度為21℃[18],大洋擬微球藻(Nannochloropsis oceanica)在18-28℃條件下都可以正常生長[19]。本研究重點探究低溫和高溫對真眼點藻JHsu-01多不飽和脂肪酸代謝的影響,對于適宜其生長的具體溫度,則需要更為細化的溫度梯度實驗進行驗證。
溫度可以影響微藻的脂類合成[20]。真眼點藻JHsu-01在15℃培養條件下獲得了更高的總脂含量,分析脂類組成發現,15℃條件下總脂含量提高的原因是由于膜脂比例增加引起,膜脂提高通常是微藻增強環境適應性的一種策略。不同種類微藻對溫度的響應存在差異,改變小球藻(Chlorella sp. MACC-728)的培養溫度,其油脂含量并沒有顯著變化[21],四尾柵藻(Scenedesmus quadricauda)在30℃時,脂類積累效率最高[22],由于脂類合成涉及的酶種類多,因此溫度影響脂類合成的潛在調控位點可能存在多個,目前對于這一調控機制仍不清楚。
3.2 溫度影響真眼點藻JHsu-01脂肪酸的組成和EPA的分布
溫度可以影響微藻的脂肪酸組成[20]。研究表明,微藻脂肪酸的不飽和度隨溫度降低而增加,而飽和脂肪酸比例隨溫度升高而增加[20,23]。本研究也發現了類似規律,真眼點藻JHsu-01在30℃時的EPA含量為1.37% DW,而15℃時EPA含量達到2.78% DW,提高幅度達到102.9%,說明15℃比30℃更有利于EPA的合成。利用10、15、20、25和30℃培養三角褐指藻(P. tricornutum MP-2),結果表明15℃處理組的EPA含量最高[24];當培養溫度由10℃提高到25℃時,菱形藻(Nitzschia paleacea)的EPA相對含量由28.4% TFA降低至18.1% TFA,韋氏海鏈藻(Thalassiosira weissflogii)的培養溫度由16℃提高到20℃,其EPA含量明顯降低[25]。低溫有利于EPA合成的原因可能與藻細胞調節膜的流動性有關,膜脂中不飽和脂肪酸增加,可以保證膜在低溫條件仍具有較好的流動性,從而執行正常的生理功能[26]。
溫度可以改變真眼點藻EPA在中性脂、糖脂和磷脂中的分布,低溫使更多的EPA分配在糖脂中,糖脂是類囊體膜的主要成分,分布在糖脂中的EPA增加,預示著類囊體膜的流動性增加,類囊體膜上的色素蛋白復合物可以更好的橫向運動,提高光能吸收和傳遞效率。30℃培養使藻細胞合成的EPA更多的分布在中性脂中,結合“EPA總量減少”、“膜脂比例降低而中性脂比例增加”這一結果,我們推測30℃條件下,中性脂的EPA可能有一部分來源于磷脂,藻細胞中存在磷脂轉化為三酰甘油的途徑,這步反應在磷脂酰膽堿-二酰基甘油酰基轉移酶(PDAT)催化作用下進行,衣藻的PDAT擁有酰基轉移酶及脂肪酶兩種活性,在膜脂分解的過程中,伴隨TAG的產生,使藻細胞在各種脅迫條件下更好地生存[27]。
3.3 溫度對脂類相關代謝通路的影響
轉錄組測序可以全面快速地獲得藻細胞在某一狀態下幾乎所有轉錄本的序列信息,是一種探究微藻代謝規律的理想技術。真眼點藻JHsu-01在15℃培養條件下合成脂肪酸的能力增強,并且合成EPA的3個關鍵酶基因(Δ15、Δ5和Δ6去飽和酶)上調,這結果可以解釋15℃比30℃更有利于EPA的合成。球等鞭金藻(Isochrysis galbana)IgFAD5基因僅在低溫15℃處理6-12 h期間表達水平較高[28],球等鞭金藻3011的Δ4、Δ5、Δ6、Δ8、Δ9和Δ12在18℃的相對表達量最高[29],上述結果與本研究結果相似,均表明低溫可以誘導一些脂肪酸去飽和酶的表達。
微藻細胞中存在原核和真核兩種膜脂合成途徑,原核途徑發生在質體內,而真核途徑發生在內質網,原核途徑合成的膜脂主要有磷脂酰甘油PG、MGDG、DGDG和SQDG,而真核途徑合成的脂類主要有PE、PS、PC和PI等[7]。15℃培養條件下,合成糖脂(MGD和DGD)和硫脂(SQD1和SQD2)關鍵酶基因的表達上調,說明低溫條件下,葉綠體膜脂合成旺盛,藻細胞可能具有更強的光需求。三酰甘油合成中的幾個關鍵酶基因(GPAT、plsC、PLPP和DGAT)在15℃條件下的表達均上調,說明TAG合成加強,但15℃條件下的中性脂比例比30℃有所降低,推測上述結果可能與糖脂與中性脂的合成速率有關,15℃條件下糖脂合成增強,當糖脂合成速率快于TAG合成速率時,就會出現中性脂比例降低的現象,后續可以通過熒光定量PCR對糖脂和TAG合成通路的關鍵酶基因更加更準確的量化分析。
真眼點藻JHsu-01的EPA主要分布在糖脂中,根據轉錄組數據并不能得出EPA分布在糖脂中原因。大量研究表明,許多微藻合成的EPA同樣分布在糖脂中,如紫球藻[5]、三角褐指藻[4]、微擬球藻[4]等,三角褐指藻84%的EPA存在于糖脂中,而僅有11%的EPA存在于TAG中[4],紫球藻可以積累占總脂肪酸約47%的EPA,但分布在TAG中的EPA僅有2%[5],這一分配機制可能與某些酶對特定脂肪酸選擇性有關,大洋微擬球藻(Nannochloropsis oceanica)中存在的2種類型的DGAT(NoDGAT2J和NoDGAT2K),它們對某一種多不飽和脂肪酸具有偏好性,因此可以調節EPA在TAG中的比例[30]。真眼點藻JHsu-01的EPA傾向于分配在糖脂中,推測可能與MGD和DGD對脂肪酸選擇的特異性有關系,對這一機制更深入的分析,需要借助脂組學技術,盡可能多的鑒定脂類分子,并通過生物信息學分析,獲得它們之間的關聯性,進而闡釋EPA分布的內在調控機制。
4 結論
15℃較30℃更有利于真眼點藻JHsu-01的生長、膜脂和EPA的合成,EPA含量最高達到2.78% DW。溫度可以改變EPA在糖脂和中性脂之間的分布比例,15℃條件下,微藻更多的EPA分布在糖脂和磷脂中,而30℃條件下,微藻將更多的EPA分布在中性脂中。低溫條件下,脂肪酸從頭合成、三酰甘油、糖脂、硫脂和ω-3合成途徑加強。綜上所述,低溫是促進微藻EPA合成的重要條件,同時也是一種獲得高含量糖脂型EPA的理想培養方式。

