慢病毒介導Occludin過表達影響B(tài)VDV感染BALB/c小鼠的研究
王萬順 付強 魏玉榮 胡新艷 陳俊貞 李澤宇 史慧君
(新疆農業(yè)大學動物醫(yī)學學院,烏魯木齊 830052)
牛病毒性腹瀉/黏膜病(bovine viral diarrhea/mucosal disease,BVD/MD)是由牛病毒性腹瀉病毒(bovine viral diarrhea virus,BVDV)引起的牛傳染性疾病,我國農業(yè)農村部將其列為三類動物疫病。BVDV感染范圍廣泛,能夠在牛、羊等多數偶蹄動物之間傳播,甚至在野生動物中也出現感染。主要以幼齡動物表現明顯,以高溫發(fā)熱、腹瀉、黏膜出現病理性炎癥為主要的臨床癥狀[1-2]。目前該病呈現世界性分布,并在澳大利亞、美國、英國、中國等畜牧業(yè)發(fā)達國家傳播迅速,非致細胞病變型(noncytopathogenic effect,NCP)BVDV感染早期妊娠母牛造成犢牛持續(xù)性感染(persistent infection,PI),PI牛成為潛在感染源,終身攜帶病毒并且通過自身的唾液、尿液以及乳汁傳播[3-4]。BVDV還能夠對牛源生物制品中如血清、凍精、胚胎、疫苗等造成污染,使得畜牧業(yè)之間的商業(yè)領域損傷嚴重[5-6]。
Piontek等[7]在20世紀60年代發(fā)現一種膜內多蛋白復合物,在上皮細胞和內皮細胞單層的相鄰細胞之間提供頂端細胞間連接,這種復合物被稱為緊密連接蛋白(tight junction proteins,TJs)。OCLN作為TJs蛋白重要蛋白之一,主要參與TJs的屏障作用和柵欄作用。OCLN的編碼基因保守,通過對OCLN的cDNA和氨基酸序列的分析,在不同種屬之間的同源性高達90%,在肺臟、腎臟、肝臟、睪丸及腦組織的上皮細胞中OCLN都能夠高水平表達[8]。Liu等[9]研究發(fā)現利用小干擾RNA(small interference RNA,siRNA)干擾OCLN蛋白的表達,可抑制丙型肝炎病毒(hepatitis C virus,HCV)病毒進入人肝癌細胞Huh7.5.1,沉默OCLN蛋白的表達不會影響其他TJ蛋白JAM、CLDN1 和ZO-1的表達。
本課題組前期研究發(fā)現敲除OCLN能夠有效抑制BVDV體外復制[10],然而OCLN是否影響B(tài)VDV體內復制尚不清楚,本研究采用慢病毒介導OCLN在BALB/c小鼠過表達,建立動物模型,感染BVDV后檢測OCLN過表達對BVDV體內復制的影響,為研究BVDV的防控機制提供科學依據。
1 材料與方法
1.1 材料
1.1.1 細胞、動物和病毒 牛腎細胞(Madin-Darby bovine kidney,MDBK)和人胚腎細胞HEK-293T購自中國科學院典型培養(yǎng)物保藏委員會細胞庫;4-5周齡健康BALB/c小鼠購自新疆醫(yī)科大學醫(yī)學動物中心;BVDV新疆分離株TC株由新疆農業(yè)大學病毒學實驗室保存。
1.1.2 試劑和儀器 QuantiNova SYBR Green PCR Master Mix購自Qiagen公司;TRIzol細胞裂解液購自Ambion公司;D2000 DNA Marker(MD114)、無內毒素質粒大量提取試劑盒(DP120)、cDNA第一條鏈合成試劑盒(KR103)、DNA瓊脂糖凝膠回收試 劑 盒(DP219)和Taq PCR Master Mix(KT201)購自天根生化科技(北京)有限公司;限制性內切酶Xho I(1094A)和Xba I(1093A)購自寶日醫(yī)生物技術(北京)有限公司;Trypsin-EDTA、高糖DMEM、胎牛血清(fetal bovine serum,FBS)、馬血清(horse serum,HS)均購自BI公司;辣根過氧化物酶標記山羊抗兔IgG(H+L)購自Proteintech公司;兔抗OCLN抗體購自Thermo公司;低溫高速離心機Thermo Fisher Scientific公司;實時熒光定量PCR儀(Fast 7500)購自ABI公司。
1.2 方法
1.2.1 慢病毒表達載體構建
1.2.1.1 引物合成 參考GenBank數據庫中牛OCLN的基因序列(登錄號:NM_001082433.2)設計OCLN基因擴增引物:OCLN-F1:5′-CCGCTCGAGAT GTCATCCAGGCCTTTTGAAAG-3′和OCLN-R1:5′-T GCTCTAGATGTTTTCCGTCGGTCGTAATCTC-3′;引物均由蘇州金唯智生物科技有限公司合成。
1.2.1.2 PCR基因擴增鑒定 收集MDBK細胞加入適量的TRIzol細胞裂解液,提取總RNA,測定RNA濃度,并使用cDNA第一條鏈合成試劑盒反轉錄成cDNA,以cDNA為模板,以引物OCLN-F和OCLN-R,PCR擴增基因OCLN。PCR反應體系為2×Taq PCR Master Mix 10.0 μL、OCLN-F1/R1(10 μmol/L)各0.6 μL、cDNA 2.0 μL、ddH2O 6.8 μL;PCR擴增程序:預變性94℃ min;變性94℃ 40 s、退火68℃ 40 s、延伸72℃ 90 s、循環(huán)40次;終延伸72℃ 10 min、終止4℃。使用1%瓊脂糖凝膠電泳檢測PCR結果,并使用DNA瓊脂糖凝膠回收試劑盒回收目的基因。
1.2.1.3 慢病毒表達載體構建 Xho I和Xba I雙酶切pLVML-Myc-MCS-linker-GFP-IRES-Puro和OLCN基因回收產物,電泳檢測后回收載體和目的基因,使用T4 DNA連接酶連接目的基因和載體,置于4℃連接過夜,次日轉化到大腸桿菌Stbl3感受態(tài)細胞中,置于37℃培養(yǎng)過夜,PCR檢測陽性克隆菌落,PCR反應條件和程序同1.2.1.2;將陽性克隆菌落送至蘇州金唯智生物科技有限公司進行測序鑒定,測序結果使用Blast進行比對分析并制作進化樹。
1.2.2 慢病毒包裝及滴度測定 使用無內毒素質粒大量提取試劑盒分別提取pLVML-Myc-bOCLN-linker-GFP-IRES、pLVML-Myc-Mcs-linker-GFP-IRES-Puro、pSPAX2、pMD2.G質 粒,將pLVML-Myc-bOCLNlinker-GFP-IRES-Puro/pLVML-Myc-Mcs-linker-GFPIRES-Puro與輔助質粒共轉染至HEK-293T細胞;轉染48 h后觀察綠色熒光GFP表達情況,收集細胞培養(yǎng)液,2 000 r/min離心5 min后取上清,使用0.45 μmol/L濾器過濾細胞碎片,病毒懸液轉移至Amicon超濾離心管,4℃ 7 800 r/min離心90 min,轉移濃縮柱內病毒液至EP管,-80℃保存?zhèn)溆茫话凑彰靠?.5×105個細胞的密度將HEK-293T接種至24孔細胞培養(yǎng)板中,分別加入0.5、1、2、5 μL濃縮病毒液,并加入聚凝胺溶液(終濃度為8 μg/mL),慢病毒感染48 h后加入適量4%多聚甲醛固定細胞10 min,DAPI 染色20 min,使用熒光顯微鏡隨機選擇不同視野進行拍照,用ImageJ軟件統(tǒng)計DAPI陽性細胞及綠色熒光陽性細胞數量,按照如下公式計算病毒滴度:病毒滴度(IU/mL)=(綠色熒光細胞/藍色熒光細胞)/加入的病毒液體積×1.5×105×103[11]。
1.2.3 慢病毒感染BALB/c小鼠和BVDV攻毒 將30只4-5周齡BALB/c隨機分為A(0 d)、B(4 d)、C(8 d)、D(10 d)、E(15 d)五組,每組6只,3只為實驗組,3只為對照組。尾靜脈注射5×107IU慢病毒,注射劑量200 μL,連續(xù)注射兩次,每次間隔48 h,第二次注射慢病毒后96 h時,用1.68×105TCID50/只劑量的BVDV進行攻毒;攻毒后0、4、8、10、15 d處死一組小鼠,解剖后采集腎臟、肝臟、 脾臟、肺臟、小腸等組織,提取總RNA和各組織總蛋白;取少量組織浸潤福爾馬林溶液,后續(xù)制作病理切片,觀察病變情況。
1.2.4 qRT-PCR檢測各組織OCLN mRNA水平 稱取1 g各組織,加入液氮研磨后,加入500 μL TRIzol細胞裂解液,提取各組織的總RNA,反轉錄成cDNA,qRT-PCR檢測各組織中OCLN mRNA水平。qRT-PCR反 應 體 系 為:2×QuantiNova SYBR Green PCR Master Mix 10.0 μL,OCLN-F2/R2(10 μmol/L)各1.4 μL,cDNA 模 板 1.0 μL,QN ROX Reference Dye 0.1 μL,RNase Free ddH2O 6.1 μL;引物為OCLN-F2:5′-ACCTCTCCTCCCGGAGTAAT-3′;OCLN-R2:5′-GCTACCAAAGGCACTTCCTG-3′;qRT-PCR反應條件為:95℃ 2 min;95℃ 5 s、60℃ 30 s、40循環(huán);按照如下公式計算OCLN mRNA水平:2-ΔΔCt=2-[(實驗組目的基因Ct-實驗組內參基因Ct)-(對照組目的基因Ct-對照組內參基因Ct)]。
1.2.5 Western blot檢測各組織OCLN蛋白表達水平 稱取1 g各組織,加入液氮研磨后加入RIPA蛋白裂解液提取總蛋白,使用BCA蛋白濃度測定試劑盒測定蛋白濃度;分別取80 μg總蛋白使用SDS-PAGE分離總蛋白,并轉膜至PVDF,使用5%脫脂奶粉封閉2 h后,加入兔抗OCLN抗體(1∶1 000稀釋)置于4℃孵育過夜,使用PBST洗滌3次后加入辣根過氧化物酶標記山羊抗兔IgG(H+L),使用ECL化學發(fā)光底物進行顯色和曝光,并拍攝相應的圖片。
1.2.6 qRT-PCR檢測BVDV病毒載量 各組織處理、RNA提取、cDNA合成、qPCR反應體系和程序同1.2.1.2。BVDV病毒載量qRT-PCR檢測引物為5′UTR-F:5′-CCTAGCCATGCCCTTAGTAGGACT-3′;5′UTR-R:5′-GGAACTCCATGTGCCATGTACA-3′;qRT-PCR標準曲線參照田瑞鑫等[12]報道。
1.2.7 組織病理切片檢測 福爾馬林溶液固定小鼠各組織后,經脫水浸蠟、包埋、切片、H&E染色步驟制備病理切片,觀察各組織的病理變化情況。
1.2.8 統(tǒng)計分析 數據以mean±SD(平均值±標準誤)表示。使用SPSS 17.0軟件進行單因素t檢驗分析,使用graphpad prism 5.0進行柱狀圖作圖;*P<0.05表示差異顯著,**P<0.01表示差異極顯著。
2 結果
2.1 慢病毒質粒構建
pLVML-Myc-bOCLN-linker-GFP-IRES-Puro和pLVML-Myc-Mcs-linker-GFP-IRES-Puro慢病毒質粒圖譜見圖1-A和1-B。使用PCR鑒定單克隆菌落,結果如圖1-C,PCR擴增OCLN基因后電泳檢測可見大小約為1 566 bp條帶,與OCLN基因大小一致。使用Blast進行分析發(fā)現OCLN基因與GenBank數據庫中牛OCLN基因(登錄號:NM_001082433.2)序列同源性為100%(圖1-D)。
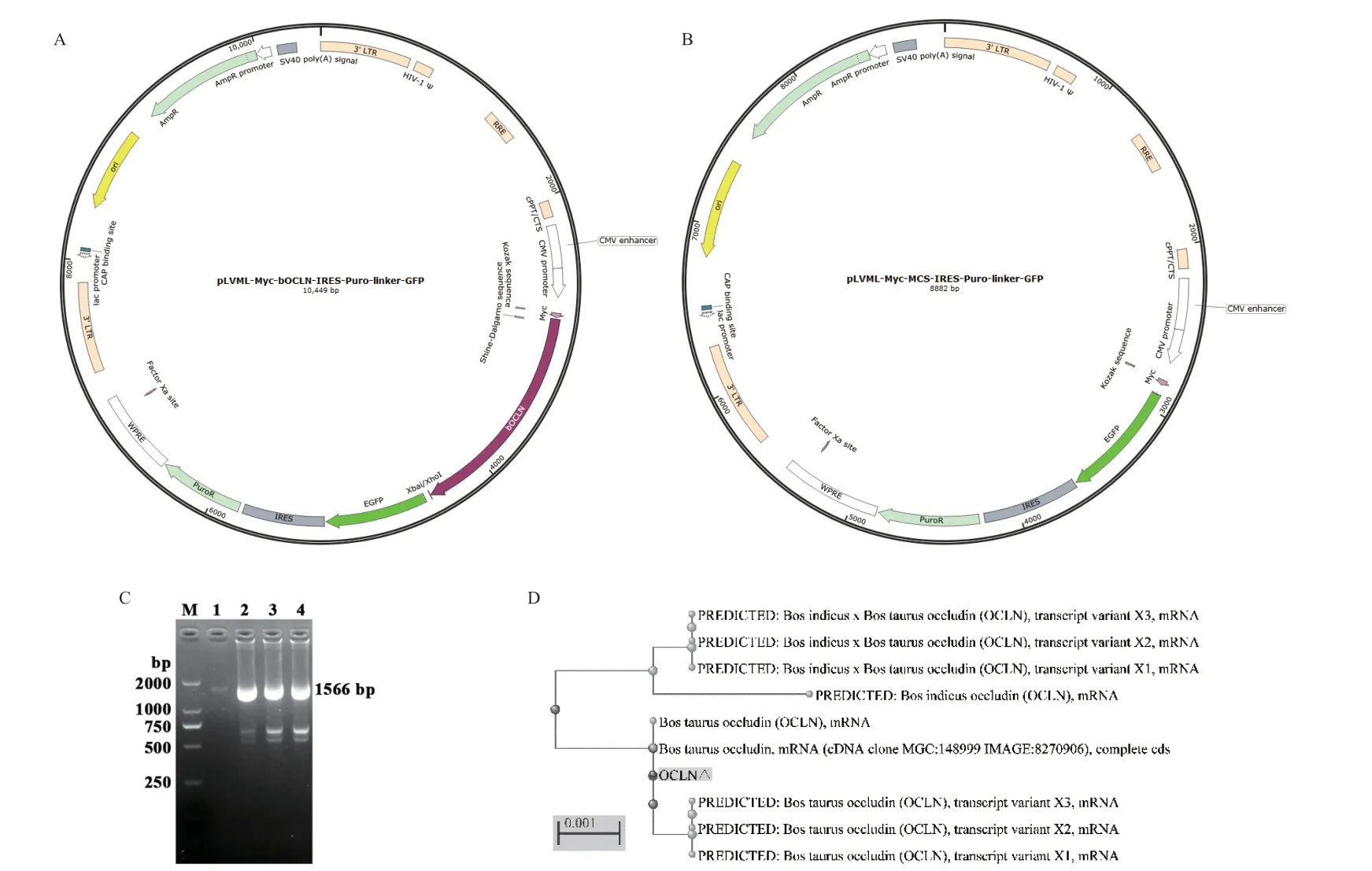
圖1 慢病毒質粒圖譜和載體鑒定Fig. 1 Lentivirus plasmid map and vector identification
2.2 慢病毒包裝結果
分別將過表達質粒pLVML-Myc-bOCLN-linker-GFP-IRES-Puro、對照質粒pLVML-Myc-Mcs-linker-GFP-IRES-Puro與包裝輔助質粒(pSPAX2和pMD2.G)轉染HEK-293T細胞,轉染48 h后收集慢病毒懸液,并感染HEK-293T細胞,感染48 h后發(fā)現大量綠色熒光,根據公式計算得出慢病毒滴度為5×108IU/mL(圖2)。
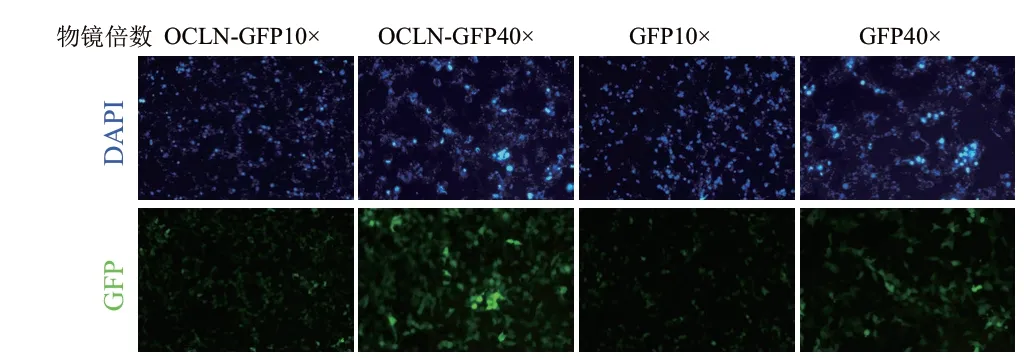
圖2 慢病毒感染HEK-293T細胞后綠色熒光表達情況檢測Fig. 2 Detection of green fluorescence expression in the HEK-293T cells infected with lentivirus
2.3 qRT-PCR檢測小鼠各組織中OCLN mRNA水平
慢病毒尾靜脈注射BALB/c小鼠,采集各組織提取總RNA,qRT-PCR檢測各組織中OCLN mRNA水平變化。結果如圖3所示,與對照GFP慢病毒感染相比,OCLN-GFP慢病毒感染BALB/c小鼠96 h后,小腸、肝臟、肺臟和脾臟等組織中OCLN mRNA水平顯著性增加,其中肝臟中OCLN mRNA量最高。
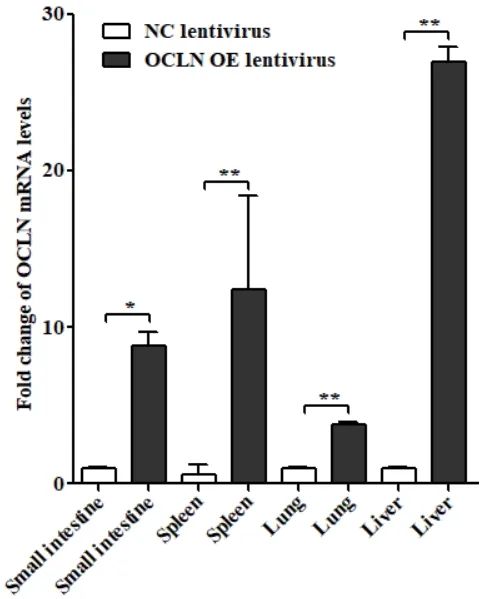
圖3 qRT-PCR檢測各組織中OCLN mRNA表達量Fig. 3 Detection of OCLN mRNA expressions in various tissues by qRT-PCR
2.4 Western blot檢測小鼠各組織中OCLN蛋白表達水平
慢病毒注射BALB/c小鼠96 h后,采集各組織器官,提取總蛋白,Western blot檢測各組織中OCLN蛋白表達水平。結果如圖4所示,與對照GFP慢病毒感染相比,OCLN-GFP慢病毒感染后各組織中OCLN蛋白表達顯著增加。
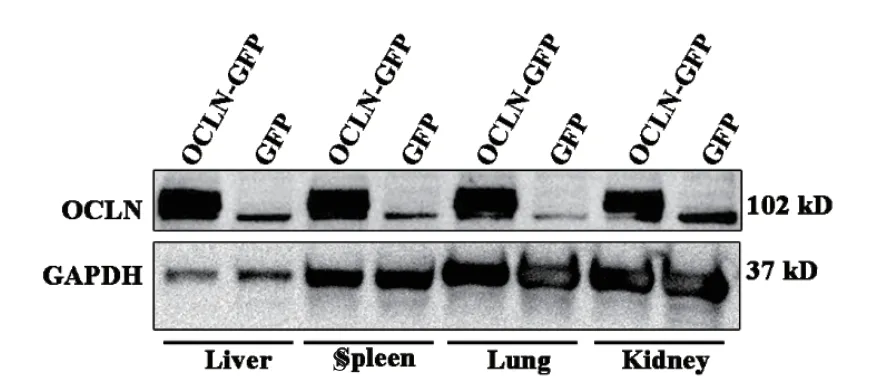
圖4 Western blot檢測各組織中OCLN蛋白表達水平Fig. 4 Expressions of OCLN protein in various tissues by Western blot
2.5 qRT-PCR檢測各組織中BVDV載量
慢病毒感染BALB/c小鼠后進行BVDV攻毒處理,不同時間后使用qRT-PCR檢測各組織中BVDV載量。結果如圖5所示,與對照GFP慢病毒感染相比,BVDV攻毒OCLN-GFP慢病毒感染BALB/c小鼠0和4 d時,各組織中BVDV 5′ UTR拷貝數未出現明顯的差異;BVDV攻毒后8、10和15 d時,OCLN-GFP慢病毒感染BALB/c小鼠各組織中BVDV 5′ UTR拷貝數差異逐漸明顯,在攻毒后15 d時,BVDV 5′UTR拷貝數增加最顯著,表明OCLN-GFP感染BALB/c小鼠造成OCLN蛋白過表達,有助于BVDV載量的增加。
圖5 qRT-PCR檢測各組織中BVDV載量Fig. 5 BVDV loading in various tissue by qRT-PCR
2.6 病理切片檢測BALB/c小鼠各組織病變情況
慢病毒注射BALB/c小鼠后BVDV攻毒,制作組織病理切片并進行H&E染色觀察各組織病變情況。結果如圖6所示,BALB/c小鼠各組織感染BVDV后都不同程度的病變。肝臟組織大量動、靜脈以及肝竇充血,并伴有大量炎性細胞浸潤,不同程度的顆粒變性、壞死現象;脾臟組織病變主要表現為淤血、組織局部出血,有少量淋巴細胞浸潤;肺臟組織病變特征主要為出血、淤血、空泡,肺泡間隔顯著增寬,肺泡壞死現象;腎臟組織病變特征主要出血、顆粒變形和少量淋巴細胞浸潤,皮質髓質分界模糊,間質增生;小腸組織腸絨毛固有層淋巴細胞浸潤,小腸毛細血管出血,腸黏膜固有層水腫,腸絨毛上皮細胞壞死。
圖6 病理切片檢測BALB/c小鼠各組織病變情況Fig. 6 Detection of pathological changes of various tissues in BALB/c mice by pathological section
與對照GFP慢病毒感染相比,BVDV攻毒OCLN-GFP慢病毒感染組各組織病變更為嚴重。BVDV攻毒4 d時,病變最先出現于肺臟,肺泡壞死出血,炎性細胞浸潤;其次是肝臟中肝細胞壞死,炎性細胞浸潤,其余組織較為輕微;BVDV攻毒10和15 d時,肺臟組織出血嚴重,肝細胞大量顆粒變形以及壞死現象出現;肺臟不同程度出血、淤血和空泡,肺泡壞死;腎臟出血,淤血、大量淋巴細胞浸潤;脾臟炎性細胞浸潤;小腸上皮細胞壞死,淋巴細胞浸潤。
3 討論
近年研究發(fā)現,細胞的分化、增殖、遷移、信號轉導和基因表達中都有TJs的參與[13-16]。TJs功能喪失將導致癌癥、中風、糖尿病視網膜病變、肺疾病和炎癥性腸病等各種疾病的發(fā)生,據報道,至少有9種不同病毒家族的成員使用緊密連接相關蛋白作為受體[17]。TJs家族重要蛋白OCLN可作為HCV侵入的關鍵受體。OCLN主要表達于細胞膜,其蛋白結構包括2個細胞外環(huán)(extracellular loops,EL)和4個跨膜區(qū)域(transmembrane,TM)[18],其中EL2能與HCV囊膜蛋白E2發(fā)生互作,從而介導HCV侵入。BVDV與HCV屬于同科病毒,其復制過程是否受到OCLN蛋白的介導,進而受OCLN調控?前期本課題組已通過CRISPR/Cas9基因敲除和RNAi敲低等技術敲除/低OCLN在BVDV靶細胞MDBK中的表達,進而研究其對BVDV復制影響,結果發(fā)現OCLN敲除/低都將嚴重影響B(tài)VDV在宿主細胞中復制,而OCLN是否影響B(tài)VDV體內復制?國內外尚未見報道。本研究采用慢病毒介導OCLN在BALB/c小鼠體內過表達,進而研究OCLN過表達對BVDV體內復制的影響,結果發(fā)現OCLN過表達造成BVDV在BALB/c小鼠體內病毒載量顯著性增加,而感染造成的病變更加嚴重,表明OCLN過表達增加BVDV體內復制。
阮文強等[19]采用3株不同來源的CP型BVDV毒株,通過BALB/c小鼠為實驗動物進行攻毒,病理切片可見攻毒小鼠肝臟和腸道炎性細胞浸潤,上皮細胞脫落壞死,脾臟脾內吞噬細胞增多和脾小結反應性增生,肺泡萎縮和出血。田瑞鑫等[12]BVDV攻毒小鼠之后病理切片可見大部分臟器出現不同程度組織病變,心臟及肝臟組織局部出血、淤血,心肌細胞壞死癥狀明顯,肺臟及脾臟顆粒變形并伴有大量淋巴細胞浸潤,小腸上皮細胞壞死并有輕微出血現象。本實驗在攻毒BVDV之后,與GFP組小鼠對比,OCLN-GFP組各個臟器均出現出血、淤血以及淋巴細胞浸潤的現象且與對照組相比更為嚴重,根據病理切片結果發(fā)現,最先出現病變的部位在肺臟及肝臟,與BVDV感染小鼠體內的研究報道相似,因對實驗動物周圍環(huán)境進行控制可排除繼發(fā)感染因素造成動物組織的病變。
OCLN基因作為一種保守基因,在不同種屬之間同源性高達90%,且OCLN mRNA能夠在肺、腎和肝中高水平表達[8]。采用慢病毒作為載體進行介導,通過慢病毒載體在宿主體內介導外源基因能夠穩(wěn)定表達且不會出現基因沉默現象的特性。實驗通過采集慢病毒注射96 h后的RNA和蛋白使用qRTPCR和Western Blot技術來測定動物體內OCLN基因,與GFP組相比,肝、脾等組織均出現OCLN基因過表達情況,能夠成功建立動物模型,為BVDV感染動物之后與OCLN基因的關系提供前期實驗基礎。田瑞鑫等[12]利用慢病毒介導pre-miR-29b在小鼠體內,采用相同時間段進行檢測,并成功建立BALB/c小鼠模型。該結果與本研究類似。此外,本課題組前期研究發(fā)現OCLN能與BVDV囊膜蛋白E2發(fā)生互作,而具體OCLN哪些基序或位點與BVDV E2結合尚不清楚,亟待研究探索。
4 結論
本研究通過慢病毒介導OCLN在BALB/c體內過表達,發(fā)現OCLN過表達促進BVDV體內復制,將為BVDV感染機制研究及藥物作用靶點提供依據。

