超聲剪切波頻散成像對代償期肝硬化高風險食管胃靜脈曲張的診斷價值
王佳音, 周洪雨, 李庭紅, 趙 蕾, 徐佰國, 尹偉利, 王 芳,梁 靜, 經 翔, 向慧玲
1 天津醫科大學三中心臨床學院, 天津 300170; 2 天津市第三中心醫院, 天津市重癥疾病體外生命支持 重點實驗室, 天津市人工細胞工程技術研究中心, 天津市肝膽疾病研究所 a.超聲科,b.消化(肝病)科, 天津 300170
食管胃底靜脈曲張(esophageal gastric varices,EGV)是肝硬化門靜脈高壓患者常見癥狀之一,而曲張靜脈破裂出血的患者6周病死率仍高達20%左右[1]。因此,早期識別高風險食管胃底靜脈曲張(high risk esophageal gastric varices,HREGV),對改善患者預后有著重要意義。多家指南[2-4]推薦肝硬化患者定期應接受胃鏡檢查,以篩查有無靜脈曲張以及判斷靜脈曲張出血風險。但因胃鏡檢查的侵入性和痛苦,患者的耐受性及依從性較差。隨著檢測設備和技術的發展,無創監測并早期識別HREGV成為近年來的研究熱點。二維超聲剪切波彈性成像(shear wave elastography,SWE)與組織硬度相關,對預測肝硬化患者是否存在靜脈曲張有一定臨床價值,但對HREGV的診斷價值有限[5]。SWE受頻散斜率影響,有研究[6-8]表明,剪切波頻散成像(shear-wave dispersion,SWD)與組織炎癥壞死相關,可用于評估組織的黏度,但在預測肝硬化患者HREGV中未見報道,因此本研究在代償期肝硬化患者中檢測肝SWD/SWE,并探討其預測HREGV的臨床價值。
1 資料與方法
1.1 研究對象 選取2020年2月—2021年2月在天津市第三中心醫院就診的各種病因接受胃鏡檢查的代償期肝硬化患者。同時排除:(1)入組時及既往存在消化道出血者;(2)入組時及既往出現腹水者;(3)入組時及既往出現II級以上肝性腦病、膿毒癥及肝腎綜合征者;(4)既往接受過內鏡治療、脾切除手術及經頸靜脈門腔靜脈分流術(TIPS)者;(5)入組時診斷肝臟惡性腫瘤者。
代償期肝硬化診斷依據《肝硬化診治指南》標準[9]:(1)組織學符合肝硬化診斷;(2)內鏡顯示食管胃靜脈曲張或消化道異位靜脈曲張,除外非肝硬化性門靜脈高壓;(3)B超、肝臟硬度測定(LSM)或CT等影像學檢查提示肝硬化或門靜脈高壓特征;(4)無組織學、內鏡或影像學檢查者,需符合以下4條中2條,①PLT<100×109/L,無其他原因可以解釋;②血清白蛋白<35 g/L,排除營養不良或腎臟疾病等其他原因;③INR>1.3或PT延長;④AST/PLT比率指數(APRI)>2。出現腹水、食管胃靜脈曲張破裂出血、膿毒癥、肝性腦病、肝腎綜合征任何一種并發癥即為失代償期。
1.2 腹部超聲檢測肝SWD/SWE 由1名具備10年以上超聲操作經驗的超聲科醫生在不知患者其他檢查及化驗結果的情況下使用彩色超聲儀(Aplio i800, Canon Medical Systems, Tochigi, Japan)進行常規腹部超聲及肝臟的SWE/SWD檢查。探頭為3.5 MHz,凸振。SWE/SWD操作方法:受試者禁食6 h,平臥位,右臂最大程度外展,置于頭頂,探頭垂直于肝表面,在右葉尋找最佳肋間窗并避開大的血管及膽道,訓練受試者輕輕屏住呼吸,超聲系統顯示雙視圖,冷卻5 s后切換到四視圖模式,包括剪切波速度或剪切波彈性(速度圖)、剪切波到達時間輪廓(傳播圖)、超聲圖像和剪切波頻散斜率圖;3 cm×3 cm大小的取樣框放在肝被膜下1 cm,1 cm大小的圓形測量區域(ROI)放置取樣框內,得到以kPa測量的硬度和以m·s-1·kHz-1測量的頻散斜率。所有操作按照佳能操作手冊完成。以上所有檢查,測量5次,取平均值(圖1)。

注:包括剪切波速度圖、剪切波到達時間輪廓(傳播圖)、超聲圖像、剪切 波頻散斜率圖。
1.3 胃鏡檢查 所有患者空腹接受常規胃鏡(GIF-Q260J,Olympus,日本)檢查,檢查結果由同1名具備20年以上操作經驗的胃鏡醫師完成胃鏡統一閱片,判斷有無食管胃靜脈曲張,并根據LDRf[2]分型標準評估食管胃靜脈曲張的部位、直徑以及風險程度等。根據AASLD[3]標準,直徑≥5 mm的靜脈曲張或紅色癥(+)的靜脈曲張或任何失代償性的小靜脈曲張被定義為HREGV。不符合以上情況的歸為非高風險食管胃靜脈曲張(NHREGV)。

2 結果
2.1 一般資料比較 本研究共收集各種病因肝硬化并接受胃鏡檢查患者235例,其中同期接受SWD/SWE檢查患者171例,排除既往消化道出血、腹水、肝性腦病、肝腎綜合征及膿毒血癥;既往接受內鏡治療、脾切除手術治療、TIPS及肝臟惡性腫瘤患者123例,最后納入符合標準的代償期肝硬化患者58例。其中,NHREGV組36例,HREGV組22例,平均(53.48±10.91)歲,男35例,女23例。乙型肝炎肝硬化39例,丙型肝炎肝硬化7例,酒精性肝硬化5例,其他原因肝硬化7例。HREGV組與NHREGV組相比,SWD、病因、脾臟直徑、門靜脈直徑、TBil差異均有統計學意義(P值均<0.05)。肝臟SWE離散度較大,中位數9.45 kPa,HREGV組與NHREGV組的SWE差異無統計學意義(P=0.223)。兩組其余相關臨床基線特征見表1。

表1 NHREGV組與HREGV組一般資料比較
2.2 肝硬化HREGV無創指標的logistic分析 將文中涉及到的指標進行單因素分析,結果顯示,病因、SWD、脾臟直徑、門靜脈直徑差異具有統計學意義(此處P值放寬至0.1),將單因素分析結果有統計學意義的無創指標進行二元logistic回歸分析,顯示,SWD為代償期肝硬化患者出現HREGV的獨立危險因素(P<0.05),SWD每增加1 m·s-1·kHz-1,發生HREGV的概率增加67%(表2)
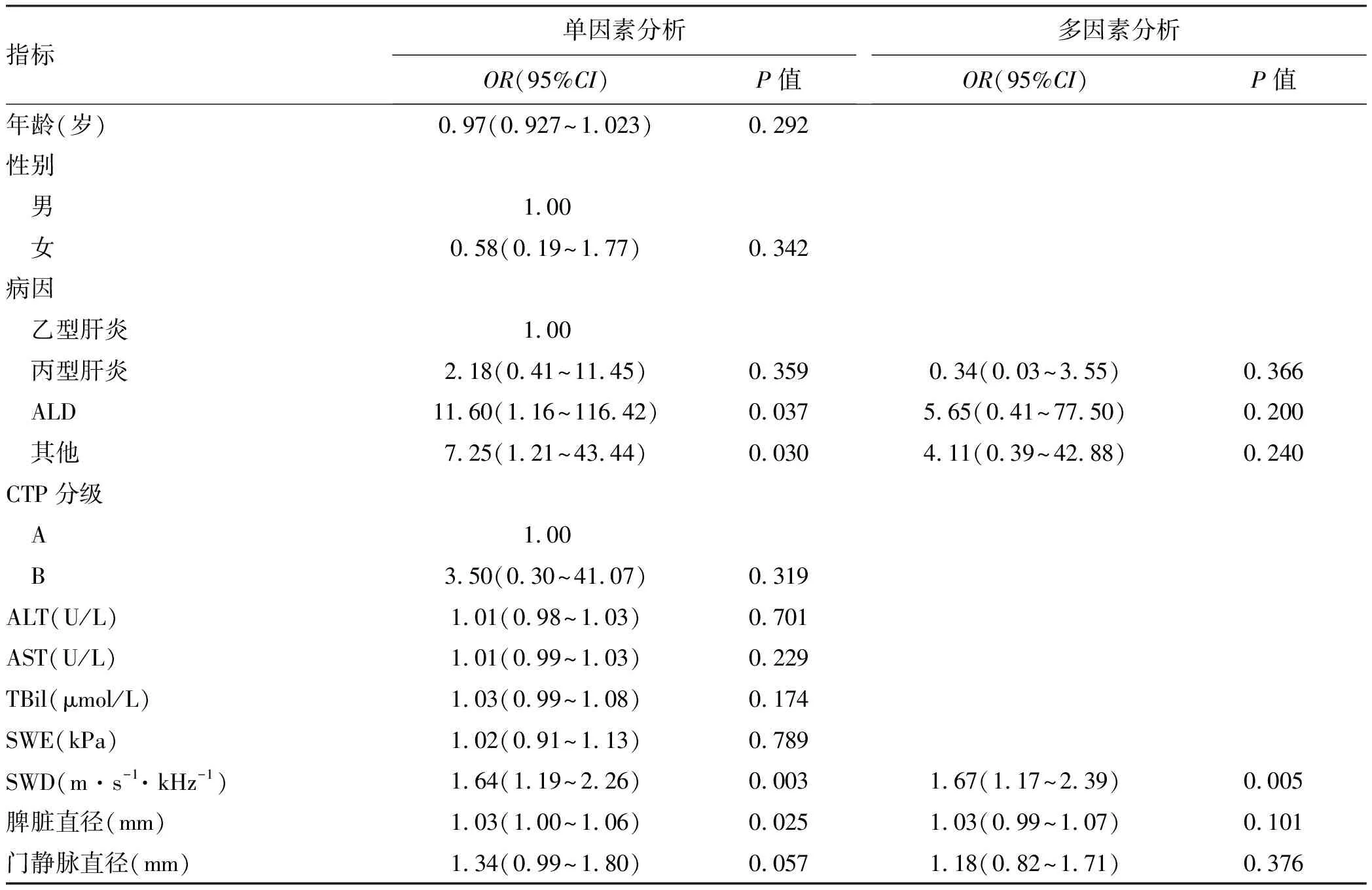
表2 代償期肝硬化患者HREGV無創指標的logistic分析
2.3 肝臟SWE及SWD對HREGV的診斷效能 繪制ROC曲線評價肝臟SWD與SWE在診斷代償期肝硬化患者HREGV的效能,結果顯示在代償期肝硬化患者中,SWD診斷HREGV的曲線下面積(AUC)為0.786,最佳臨界值為15.35 m·s-1·kHz-1,特異度80.56%,敏感度81.82%;SWE診斷HREGV的AUC為0.596,特異度52.78%,敏感度68.18%,最佳臨界值為9.25 kPa(表3,圖2)。

圖2 肝臟SWE/SWD診斷代償期肝硬化患者HREGV的ROC曲線

表3 肝臟SWD/SWE診斷代償期肝硬化患者HREGV的ROC分析
3 討論
約50%的肝硬化患者存在食管胃靜脈曲張,5%~15%肝硬化患者合并食管胃底靜脈曲張破裂出血,一旦發生,常危及患者生命。基礎肝病的嚴重程度、靜脈曲張的大小和紅色征是食管胃底靜脈曲張破裂出血的主要危險因素。內鏡是判斷曲張靜脈大小和出血風險最直觀的檢查手段,被認為是診斷靜脈曲張尤其是高出血風險靜脈曲張的“金標準”[10-11]。但內鏡檢查的侵入性及不舒適性,被患者接受程度低,尤其是無任何癥狀的代償期肝硬化患者,往往導致干預治療延后,甚至出現上消化道出血等急診,因此無創診斷肝硬化患者靜脈曲張越來越受到重視。
無創評估肝硬化患者靜脈曲張的研究主要圍繞血小板、超聲、CT、核磁、仿真肝靜脈壓力梯度技術[12-16]等。血小板減少是肝硬化門靜脈高壓患者最常見的表現,它與門靜脈壓力和EGV的存在有一定關系,但是,單獨使用血小板來診斷或排除EGV不夠準確。聯合血小板計數與其他非侵入性檢查如肝硬度、脾臟大小和直徑計算肝硬度脾/血小板評分、血小板/脾比、可以提高無創指標預測食管靜脈曲張的價值,但在預測是否存在EGV方面的準確性有限,AUC為0.71~0.84[17]。瞬時彈性成像技術(TE),單獨或結合血小板計數、脾臟大小,具有較好的臨床顯性門靜脈高壓診斷效能,可用于無創診斷肝硬化食管胃靜脈曲張,并已被寫入Baveno共識[1]和中國共識[18],但TE容易受到ALT、肥胖、肋間隙窄及腹水等影響。MRI、虛擬肝靜脈壓力梯度等技術程序比較復雜、并且價格較為昂貴[16,19],基層醫院難以完成。
SWE是將彈性成像集成到常規超聲圖像中,具有可視、取樣面積大,不受腹水、肋間隙、肥胖等因素影響的優點,可同時完成肝硬化患者常規肝脾形態結構、血流及占位病變檢查,同時實現肝臟硬度檢查,評估肝纖維化程度,實現對患者病情的“一站式”評估[20],避免TE的重復檢查,臨床適用性較高。SWE通過對肝硬度的測量對是否存在靜脈曲張有很好的診斷效能,但對HREGV診斷價值有限[5]。SWE測定是假設所檢測的組織是一個純彈性體,在完全彈性組織中,無論剪切波頻率如何,剪切波速度都是恒定的,然而,在黏彈性組織中,剪切波速度隨頻散而變化。研究[6,21-24]表明,SWE獲得的頻散斜率與肝臟壞死性炎癥活動有關,小葉炎癥活動程度是剪切波頻散斜率的唯一決定因素。也有文獻[25]報道用SWE診斷中重度肝纖維化的最佳閾值為剪切波頻率依賴性。肝硬化是一個炎癥壞死不斷發展的過程,肝臟疾病如非酒精性脂肪性肝病和急性肝炎已被報道增加肝黏度,因此通過評估肝臟的彈性和黏度,即黏彈性特性,可以獲得對肝硬度更準確的評估。
SWD在診斷肝硬化HREGV中的價值國內外尚未見報道。本研究結果顯示,代償期肝硬化患者肝臟SWD平均(15.17±2.45) m·s-1·kHz-1,其中HREGV組肝臟SWD顯著高于NHREGV組;logistic回歸分析顯示,SWD為代償期肝硬化患者發生HREGV的獨立危險因素,SWD診斷HREGV的AUC為0.786,診斷價值中等。已知代償期肝硬化患者靜脈曲張程度與肝硬化程度相關,本研究的結果支持SWD與肝纖維化相關的觀點[26],提示SWD可以用于預測代償期肝硬化患者靜脈曲張風險程度。本組患者肝臟SWE離散度較大,對診斷HREGV無價值,AUC為0.596,與以往研究結果不一致[26-29]。文獻[20,30]報道不同超聲的檢查方法和所用參數各不相同,結果存在差異。一項Meta分析[31]顯示超聲SWE對肝纖維化嚴重程度的診斷準確性較高,但對門靜脈高壓和食管靜脈曲張嚴重程度的診斷準確性中等,與本文的結果較類似。另外,指南中明確指出對于ALT升高的SWE對纖維化的診斷效能較低。本研究人群中ALT、AST及TBil有部分超過正常值可能導致本組SWE離散度較大。SWD因考慮了炎癥壞死因素,結果相對SWE更加穩定,可能更能真實反映伴有炎癥肝臟的纖維化程度。同時當門靜脈壓力梯度超過10~12 mmHg時,肝臟硬度與門靜脈高壓之間的相關性顯著降低[32],這與在門靜脈高壓進展過程中,血管活性因子、自發分流通道形成、門靜脈血栓形成等肝外因素對門靜脈壓力影響所占比例越來越大,導致靜脈曲張的出現和加重與肝臟本身硬化程度的相關性降低有關,這也可能是SWE在預測HREGV中價值不大的原因。
本研究探討了SWD在預測代償期肝硬化患者HREGV中的臨床價值,為無創評估肝硬化患者靜脈曲張程度提供了一種新的思路,值得擴大樣本進一步研究。 但本研究有以下不足:首先,樣本數較少;其次,涉及肝硬化病因較多,以病毒性肝炎(乙型肝炎、丙型肝炎)為主,酒精性脂肪肝及非酒精性脂肪肝所致肝硬化樣本量較少,不同病因肝硬化發展過程中炎癥表現及脂肪變程度不同,需進一步開展單一病因肝SWD與HREGV的關系研究以得出不同病因預測HREGV的界值;第三,本研究僅在佳能Aplio i800超聲設備中進行,結果僅能適用于本型號超聲,不能推廣到其他超聲設備。
總之,本研究首次證實佳能Aplio i800超聲的SWD可以在一定程度上預測代償期肝硬化患者高風險靜脈曲張的存在,有望為臨床醫師判斷代償期肝硬化患者是否存在HREGV提供一種簡單的初篩工具,但尚不足以替代胃鏡。
倫理學聲明:本研究于2019年12月27日經由天津市第三中心醫院倫理委員會審批,批號為IRB2019-022-02,所有患者都簽訂了知情同意書。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:王佳音負責數據收集,統計分析及論文寫作;周洪雨、趙蕾負責對文章內容進行批判性審閱;徐佰國參與文章統計分析;李庭紅、尹偉利、王芳、梁靜負責數據收集,對文章內容進行批判性審閱;經翔負責本研究設計及實施研究;向慧玲負責本研究設計及論文審核。

