經肝動脈化療栓塞聯合局部消融治療外科術后復發性肝癌的預后分析
冀柏宇, 郝芬林, 海江濤, 張俊生, 吳向陽, 金 棟, 盧震輝
1 寧夏醫科大學 研究生院, 銀川 750004; 2 昆明醫科大學第三附屬醫院 肝膽胰外科, 昆明 650100;3 寧夏醫科大學總醫院 肝膽外科, 銀川 750003
在我國,原發性肝癌是最常見的惡性腫瘤之一。外科手術是肝癌患者的首選治療方式。然而,外科術后腫瘤復發是影響患者預后的重要因素[1]。近年來,微創介入治療因其獨特的優點,被肝癌患者尤其是復發性肝癌患者所接受。經肝動脈化療栓塞(transcatheter arterial chemoembolization, TACE)聯合局部消融被越來越多地應用于治療外科術后復發性肝癌患者[2]。研究[2-3]顯示,TACE聯合局部消融治療外科術后復發性肝癌具有較好的療效。本研究對TACE聯合局部消融治療外科術后復發性肝癌患者的臨床資料進行回顧性分析,現報道如下。
1 資料與方法
1.1 研究對象 回顧性分析2017年1月—2020年12月于寧夏醫科大學總醫院接受TACE聯合局部消融治療外科術后復發性肝癌患者的資料。納入標準:(1)既往因肝癌行外科手術治療,術后影像學檢查提示肝內出現新的病灶,具備典型的肝癌影像學特征;(2)復發性肝癌以TACE聯合局部消融為首選治療;(3)肝內單發病灶直徑≤5 cm,或者多發結節病灶≤3個,且每個結節病灶直徑≤3 cm;(4)肝功能Child-Pugh分級為A級或B級。排除標準:(1)BCLC分期C期或者D期;(2)合并有全身急性疾病或自身免疫系統疾病者;(3)消融治療前肝功能Child-Pugh C級;(4)隨訪信息不全或者失訪者。
1.2 TACE聯合局部消融治療 患者完善相關檢查后行TACE術式。采用Seldinger技術行股動脈穿刺插管,行腹腔干、肝固有動脈或其分支造影。通過造影結果明確腫瘤局部情況后,超選擇插管至腫瘤主要供血動脈,進行化療藥物灌注治療,并用碘化油(用量10~20 mL)進行栓塞,根據腫瘤局部情況行個體化治療。灌注藥物有鹽酸吡柔比星20 mg,洛鉑30 mg。患者在TACE術后2~4周行射頻消融或者微波消融。術前通過影像學檢查(B超、CT、MRI)明確病灶部位及形態,確定穿刺位點,制訂個體化治療計劃。術中在CT引導下行經皮穿刺肝內病灶,逐步進行病灶消融術,消融后立即行CT平掃了解消融范圍是否基本覆蓋病灶。若消融范圍覆蓋不完全,則可立即再次消融。于一次消融中完成所有病灶消融。
1.3 隨訪及療效評價 局部消融治療后開始隨訪。術后前3個月,患者每個月行肝臟增強CT或者MRI。之后間隔3個月1次,1年后間隔半年1次,行上述影像學檢查。隨訪患者的總體生存時間(overall survival time, OS)。OS定義為:患者接受初次聯合治療至其死亡或隨訪截止時間(2020年10月)。隨訪過程中若局部病灶存活或者復發,可根據個體情況給予相應治療(TACE、局部消融等)。療效評價:依據美國肝病學會頒布的改良實體瘤療效評價標準(mRECIST),評價患者的近期療效(首次聯合治療術后3個月)。該標準內容包括:完全緩解(CR),影像學檢查提示肝內所有病灶動脈期不增強,即腫瘤病灶完全壞死;部分緩解(PR),影像學檢查提示肝內病灶部分壞死(病灶直徑縮小≥30%),但仍有部分病灶存活;疾病進展(PD),影像學檢查提示肝內病灶直徑較前增大(病灶直徑增加≥20%),或肝內出現新的病灶;疾病穩定(SD),經影像學檢查評估后,肝內病灶變化情況介于部分緩解與疾病進展之間,即病灶縮小程度不及部分緩解,增加程度不及疾病進展。總體有效率(ORR)=(CR+PR)/總例數×100%;疾病控制率(DCR)=(CR+PR+SD)/總例數×100%。
1.4 統計學方法 采用SPSS 24.0軟件進行分析。運用Kaplan-Meier法進行生存分析,采用log-rank檢驗分析組間差異。采用Cox比例風險回歸模型評估影響外科術后復發性肝癌患者OS的可能危險因素。單因素分析結果有意義的變量被用于多因素分析檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 一般資料 共納入47例患者,其中男33例,女14例。肝功能Child-Pugh A級29例,B級18例。單結節患者33例,多結節患者(腫瘤數目2~3個)14例。
2.2 近期療效和不良反應 TACE聯合局部消融治療外科術后復發性肝癌47例,其中CR 33例,PR 9例,SD 3例,PD 2例,ORR為89.3%,DCR為95.7%。
47例復發性肝癌患者共行TACE 53次,局部消融67次。TACE及消融術后并發癥均為輕度不良反應,其中TACE術后疼痛33例,惡心嘔吐29例,發熱19例;局部消融術后疼痛28例,發熱23例。予以對癥處理后均得以緩解。治療中未發生與手術直接相關的死亡事件。
2.3 生存情況 47例患者中位OS為24個月。6、12、18、24個月總生存率分別為95.70%、76.40%、63.30%、58.00%。截至研究終點(即隨訪截止時間),27例患者死亡,尚有20例患者存活(圖1)。
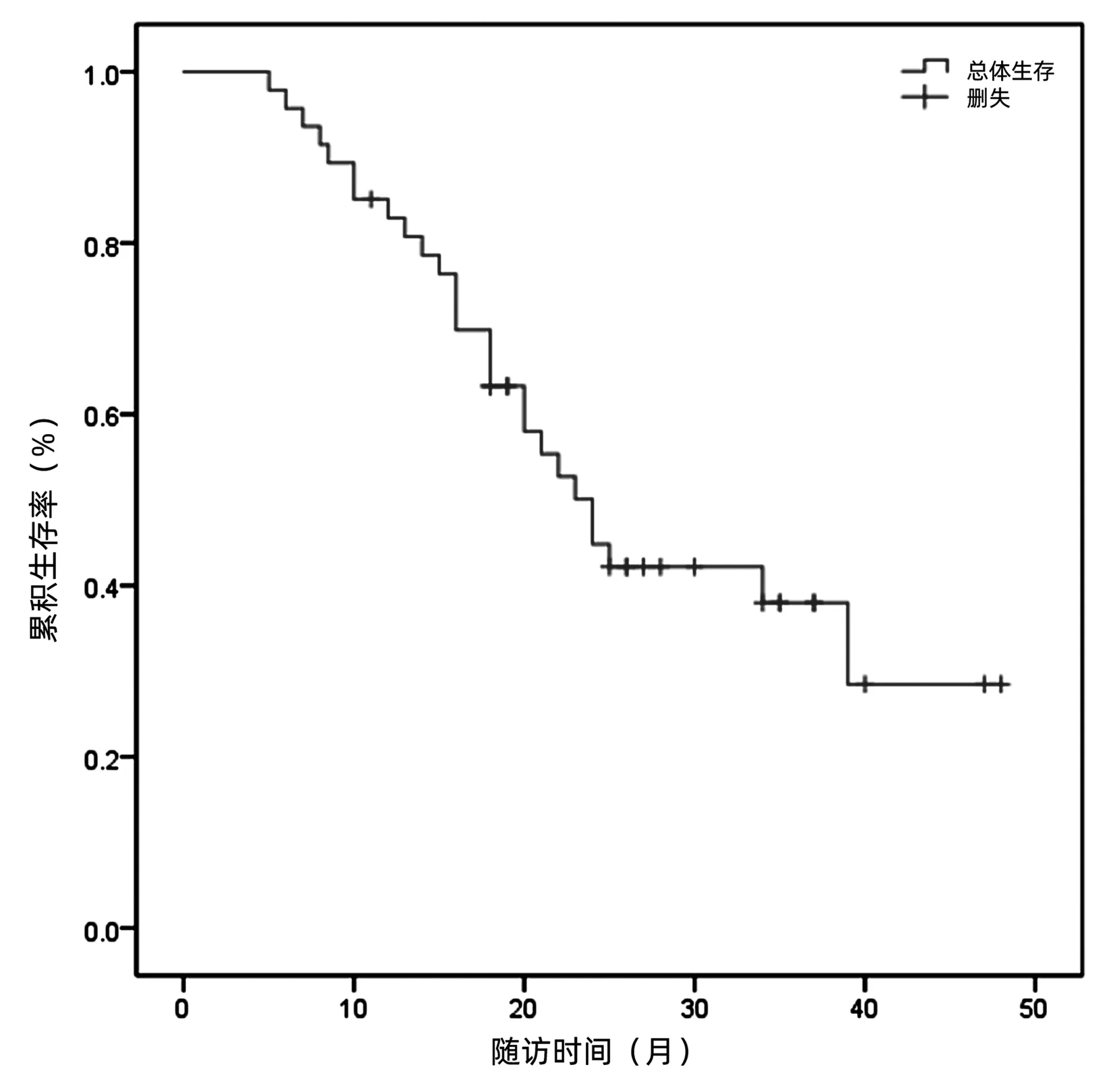
圖1 47例復發性肝癌患者治療后生存曲線
2.4 影響患者OS的單因素和多因素分析 Kaplan-Meier單因素分析顯示外科術后復發性肝癌患者TACE聯合局部消融治療后OS與AFP≥40 ng/mL、腫瘤直徑≥3 cm、腫瘤邊界不規整和腫瘤位置臨近危險區域(大血管、空腔臟器等)相關,差異均有統計學意義(P值均<0.05)。與性別、年齡、PLT、ALT、AST、肝功能分級和腫瘤數目無關(P值均>0.05)(表1)。將單因素分析有意義的因素(AFP、腫瘤直徑、腫瘤邊界和腫瘤位置是否臨近危險區域)導入Cox比例風險回歸模型,結果顯示:腫瘤邊界不規整和腫瘤位置臨近危險區域(大血管、空腔臟器等)是影響外科術后復發性肝癌患者TACE聯合局部消融術后生存的危險因素(P值均<0.05)(表2)。

表1 影響患者OS的單因素分析

表2 影響患者OS的多因素分析
3 討論
對于復發性肝癌,手術切除或者肝移植可能是最為理想的治療方式。然而復發性肝癌患者常受剩余肝臟體積、遠處轉移、靜脈侵犯、基礎條件、個人意愿等情況的影響而難以耐受再次手術切除[4-5]。因而臨床中多采用微創介入的治療方式[6-7]。TACE被視為非手術治療肝癌的首選方式[8]。然而多次行TACE對患者肝功能損害較大,且TACE受腫瘤乏血供、腫瘤直徑等因素的影響[9],單一TACE治療效果欠佳。
局部消融因具備微創、可重復等優勢被廣泛應用于原發性肝癌與復發性肝癌患者的治療中。相較于外科手術,局部消融具備安全性能高、術后并發癥少、住院時間短等優勢[10-11]。但有研究[12]顯示,兩者的治療效果與腫瘤直徑存在一定的關系。就患者術后生存率而言,當腫瘤直徑較小時(≤3 cm),兩者在患者術后生存率方面無明顯差異;當腫瘤直徑較大時(>3 cm),局部消融組患者的生存率低于外科手術組。
近年來為改善肝癌患者微創化治療的療效,TACE聯合局部消融被越來越廣泛應用于臨床[13-14]。本研究結果顯示,復發性肝癌患者治療后3個月ORR為89.3%,DCR為95.7%,且治療后無嚴重手術直接相關并發癥發生,提示對于外科術后復發性肝癌患者,TACE聯合局部消融治療可獲得較好的的近期療效及安全性。臨床研究[12]顯示,對于復發性肝癌患者遠期生存率,TACE聯合消融組與手術組治療相比,其預后相近,兩組在統計學上無明顯差異。Peng等[15]亦稱在患者1、3、5年生存率方面,TACE聯合消融組與再次手術組無統計學差異。在本研究中,47例復發性肝癌患者TACE聯合局部消融治療后,中位OS可達到24個月,且12、24個月總生存率分別為76.40%、58.00%,與張輝等[16]的研究結果相近。提示對于接受TACE聯合局部消融治療的外科術后復發性肝癌患者,該治療方式可獲得較好的生存率。
本研究顯示腫瘤邊界不規整和腫瘤位置臨近危險區域(大血管、空腔臟器等)是影響外科術后復發性肝癌患者TACE聯合局部消融術后生存的危險因素(P值均<0.05),腫瘤邊界不規整,腫瘤位置臨近危險區域(大血管、空腔臟器等)的患者,治療后生存率較低。當腫瘤位置臨近大血管時,因管內血液對管壁的快速沖刷作用,即所謂的“熱沉效應”,導致消融過程熱量損減,使得消融效果降低,可能導致腫瘤消融不完全從而影響預后。當腫瘤位置臨近空腔臟器時,消融過程可能因注意保護臟器而折損消融效果,且術前腫瘤可能已經對臨近臟器產生微浸潤現象[17],從而影響治療效果及預后。
腫瘤邊界不規整常由于癌組織的樹突狀生長或者癌細胞的不規則浸潤引起[18],使得病灶更容易臨近危險區域(大血管、空腔臟器等),且消融過程受到局部汽化的影響,可能導致消融范圍不能完全覆蓋病灶,從而引發腫瘤復發及轉移,對患者的預后造成影響。因此對于復發性肝癌需要個體化治療,在適宜情況下可聯合其他治療方式,以期延長患者的生存期。
付元等[19]探討了TACE聯合射頻消融及索拉非尼在外科術后復發性肝癌患者中的治療效果。結果顯示,相較于對照組(TACE聯合射頻消融組),治療組(TACE聯合射頻消融及口服索拉非尼)可明顯延長患者的中位生存時間。然而在1、2、3年生存率方面,盡管治療組均高于對照組,但其差異無統計學意義。筆者認為,如何選用適合的治療方式以求最大程度延長復發性肝癌患者的生存,是臨床研究需要突破的一個關鍵點。就本研究而言,在合并有危險因素的情形下(腫瘤邊界不完整或腫瘤位置臨近危險區域),局部消融過程可能存在“盲區”或“遺漏區”,對于此類患者是否可以聯合一些其他的治療手段,如靶向治療等,進而降低局部復發率,目前尚未有這方面的研究。
綜上所述,TACE聯合局部消融治療外科術后復發性肝癌安全可靠,可以成為此類患者的一種治療方式。本研究還發現,腫瘤邊界不完整和腫瘤位置臨近危險區域(大血管、空腔臟器等)是影響患者聯合治療術后生存的危險因素。對于合并有此類危險因素的患者,術后應密切隨訪。本研究不足之處在于此研究為單一中心回顧性研究,納入患者數量較少,隨訪時間較短,且分析的危險因素較少,結果可能存在一定偏倚。仍需多中心大樣本的研究來進一步驗證。
利益沖突聲明:本研究不存在研究者、倫理委員會成員、受試者監護人以及與公開研究成果有關的利益沖突。
作者貢獻聲明:冀柏宇負責資料收集,數據分析及文章撰寫;郝芬林、海江濤、張俊生、吳向陽負責課題設計,研究指導,審校并最終定稿;金棟、盧震輝負責指導文章撰寫。

