葡萄籽低聚原花青素對面筋蛋白交聯作用的影響
孟瑩,宋英石,劉銳*,吳濤,隋文杰
(1.天津科技大學省部共建食品營養與安全國家重點實驗室,天津 300457;2.天津科技大學食品科學與工程學院,天津 300457)
目前我國是世界上最大的小麥生產和消費國,根據《2014-2018年聯合國糧食與農業組織報告》,我國小麥年產量穩定在1.2億t以上。隨著國民營養健康水平的提高,小麥面制品品質要求越來越高,提高面筋蛋白交聯強度與面筋強度,探尋天然、安全、有效的小麥粉添加劑,成為小麥粉加工品質改良的重要方向。
天然植物酚類具有綠色、安全、抗氧化、抑菌等優良特點[1],有些已被證實能夠起到面筋蛋白交聯增筋作用。例如,添加阿魏酸和咖啡酸能使面筋蛋白改性,從而增加面筋蛋白延展性[2-3];添加0.3%單寧酸后,面筋蛋白中游離巰基含量增加,游離氨基含量下降,表明單寧酸能夠將二硫鍵還原為游離巰基,促使其他氨基酸殘基間形成新的交聯[4]。此外,沒食子酸、茶多酚、生育酚等也被發現能夠引起蛋白之間交聯作用[5-8]。
葡萄籽低聚原花青素(oligomeric procyanidins,OPC)是迄今為止發現的植物來源最高效的抗氧化劑之一,具有清除體內自由基、免疫調節、預防心腦血管疾病等重要生理功能[9-12]。因其天然、安全、生物兼容性好,已作為食品功能成分和添加劑廣泛用于食品領域。OPC作為一種天然植物酚類,已有研究表明其對面筋蛋白具有交聯作用[13],但OPC調控面筋蛋白交聯作用機制尚不清楚,可借鑒抗壞血酸以及其他天然植物提取物對面筋蛋白交聯作用影響的相關研究。目前,普遍認為抗壞血酸是通過巰基/二硫鍵交換反應促進面筋網絡形成[14-15];也有研究發現氧化酚酸可通過醌羰基與蛋白游離氨基發生反應,促進蛋白質分子交聯[16];在面筋網絡結構形成過程還發現存在二酪氨酸和異二酪氨酸,因而提出酪氨酸交聯機制[17-18]。
綜上,本研究以高筋小麥粉為研究對象,測定不同OPC添加量和不同醒發時間條件下,面筋蛋白粒徑、游離巰基與二硫鍵含量、游離氨基含量、二級結構以及氨基酸變化,旨在從二硫鍵/巰基交換、游離氨基交聯、酪氨酸交聯等方面探索OPC對面筋蛋白交聯作用的影響。研究結果可為天然植物提取物對小麥粉加工過程品質調控提供重要的理論依據。
1 材料與方法
1.1 材料與試劑
高筋小麥粉:內蒙古恒豐食品工業(集團)股份有限公司;葡萄籽低聚原花青素:西安昌岳植物化工有限公司;氯化鈉、鹽酸(均為分析純):天津市化學試劑一廠;三羥甲基氨基甲烷(分析純):賽默飛世爾科技公司;甘氨酸(分析純):北京鼎國昌盛生物技術有限公司;5,5’-二硫代雙-2-硝基苯甲酸[5,5'-Dithiobis-(2-nitrobenzoic acid),DTNB](分析純):美國sigma公司;尿素、十二烷基磺酸鈉、95%乙醇(均為分析純):天津市江天化工技術有限公司;鄰苯二甲醛(化學純):國藥集團化學試劑有限公司;甲醇(分析純)、冰乙酸(色譜純):天津康科德科技有限公司;硼砂、氫氧化鈉(均為分析純):天津市北方天醫化學試劑廠。
1.2 儀器與設備
面筋洗滌儀(JJJM54S):上海嘉定糧油股份有限公司;離心機(TDZ5-WS):長沙湘儀離心機儀器有限公司;全自動粉質分析儀(doughLAB):澳大利亞波通公司;激光粒度分布儀(BT-9300S):丹東市百特儀器有限公司;紫外分光光度計(UV-1800)、高效液相色譜儀(LC-20A):日本島津公司;傅里葉變換紅外光譜儀(IS50):美國 Nicolet公司;掃描電子顯微鏡(XL-3):荷蘭Philips公司。
1.3 方法
1.3.1 面粉粉質的測定
準確稱取300 g高筋小麥粉,分別加入不同比例OPC(0%、0.1%、0.2%、0.3%、0.4%、0.5%),預混 1 min,在面團揉制過程中逐滴加入超純水,采用全自動粉質分析儀測定不同OPC添加量下小麥粉粉質特性曲線,分析得到吸水率、形成時間、穩定時間、弱化度、帶寬等粉質參數。
1.3.2 面筋蛋白樣品的制備
將添加不同OPC含量的高筋小麥粉揉制成面團,控制面團醒發時間為30 min;在OPC添加量為0.3%條件下,設置不同面團醒發時間(0、10、20、30、40 min)。稱取10 g不同OPC添加量和不同醒發時間處理得到的面團,置于面筋洗滌杯中,用2%氯化鈉溶液進行洗滌后使用去離子水洗滌除去多余氯化鈉和淀粉,面團洗滌時間8 min~10 min。將洗滌后的面筋蛋白于3 500 r/min條件下離心5 min,經冷凍干燥后磨粉過120目篩,干燥環境下儲存待測[19]。
1.3.3 面筋蛋白粒徑的測定
準確稱取0.50 g面筋蛋白樣品,與49.50 g蒸餾水充分混合成面筋蛋白懸浮液,采用激光粒度分布儀測定不同OPC添加量和不同醒發時間條件下面筋蛋白的粒徑分布。
1.3.4 游離巰基和二硫鍵含量的測定
準確稱取50 mg面筋蛋白樣品,溶于5 mL三羥甲基氨基甲烷-甘氨酸-8mol/L尿素溶液中,攪拌過夜;然后在1 mL面筋蛋白溶液中迅速加入0.1 mL埃爾曼試劑(4 mg/mL DTNB溶液)和2 mL三羥甲基氨基甲烷-甘氨酸緩沖液(pH8.0),混勻后于25℃下避光恒溫反應30 min。采用紫外分光光度計測定412 nm波長下樣品的吸光值(A412),分析面筋蛋白樣品中游離巰基和二硫鍵含量。三羥甲基氨基甲烷-甘氨酸-8 mol/L尿素溶液和埃爾曼試劑作為空白,游離巰基含量計算公式如下。
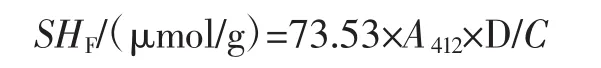
式中:73.53=106/(1.36×104),1.36×104為Ellman試劑摩爾消光系數;D為稀釋系數,5.04;C為蛋白濃度,mg/mL。
于1 mL面筋蛋白樣品溶液中加入4 mL三羥甲基氨基甲烷-甘氨酸-8 mol/L尿素溶液和0.05 mL β-巰基乙醇,室溫下振蕩4 h,加入10 mL三氯乙酸(12%)繼續反應1 h,試樣于2 800 r/min下離心10 min,重復兩次。所得沉淀使用10 mL尿素溶液(8 mol/L)再次溶解清洗后,加入0.04 mL埃爾曼試劑,搖勻后避光靜置30 min,于412 nm波長處測定其吸光值,計算得到總巰基含量和二硫鍵含量。
1.3.5 游離氨基含量的測定
面筋蛋白樣品中游離氨基含量測定采用鄰苯二甲醛(O-phthaldialdehyde,OPA)法。準確稱取0.50g面筋蛋白樣品,充分溶解在50 mL乙酸溶液(500 mmol/L)中,置于5℃水浴中磁力攪拌4 h后超聲15 s;然后在5℃下,4 400 r/min離心5 min,上清液備用。移取0.4 mL面筋蛋白樣品溶液(1 mg/mL),加入8 mL OPA溶液(含β-巰基乙醇),充分混勻后,以OPA溶液(含β-巰基乙醇)為空白,在340 nm波長下測定試樣的吸光值,并根據標準曲線方程計算其游離氨基含量。標準曲線方程采用賴氨酸為標準品,得到吸光值與氨基酸濃度的關系曲線 y=0.010 7x-0.046 4(R2=0.994 7)。
1.3.6 氨基酸變化分析
1.3.6.1 面筋蛋白樣品的水解
準確稱取3 mg面筋蛋白樣品,置于水解管中,加入12 mL鹽酸(6 mol/L)后向水解管中充入氮氣,維持30 s,待空氣完全排出,立即擰緊管塞。試樣于110℃水解22 h后,在65℃下旋蒸至原有體積1/6;加入5 mL去離子水再次旋蒸,重復3次~4次,將水解液中苯酚和鹽酸完全去除,最后溶于2 mL去離子水中,得到面筋蛋白水解液。
1.3.6.2 氨基酸衍生化
首先配制衍生溶液,包括衍生劑溶液:將2,4-二硝基氟苯溶于乙腈溶液中,制得1%的2,4-二硝基氟苯-乙腈溶液;衍生緩沖液:稱取4.2 g碳酸氫鈉,用去離子水定容至1 L;定容緩沖液:稱取3.4 g磷酸二氫鉀,加入14.5 mL氫氧化鈉溶液(0.1 mol/L),然后用去離子水定容至500 mL。然后,移取10 μL蛋白水解液,依次加入100 μL衍生緩沖液,50 μL衍生劑溶液和790 μL定容緩沖液,使用封口膜密封后,立即包裹錫箔紙,振蕩均勻并于65℃下避光1 h,過0.2 μm濾膜,得到衍生化試樣。
1.3.6.3 高效液相色譜(high performance liquid chromatography,HPLC)分析
采用HPLC對面筋蛋白樣品中氨基酸變化進行分析。色譜測定參數為流動相A水相為醋酸銨水溶液(0.05 mol/L,pH6.4),流動相B有機相為乙腈水溶液(乙腈∶水=1∶1,體積比),流動相梯度設置如表1所示。色譜柱為Gemini-C18柱,流速1 mL/min,進樣量 10 μL,柱溫30℃,檢測波長360 nm。
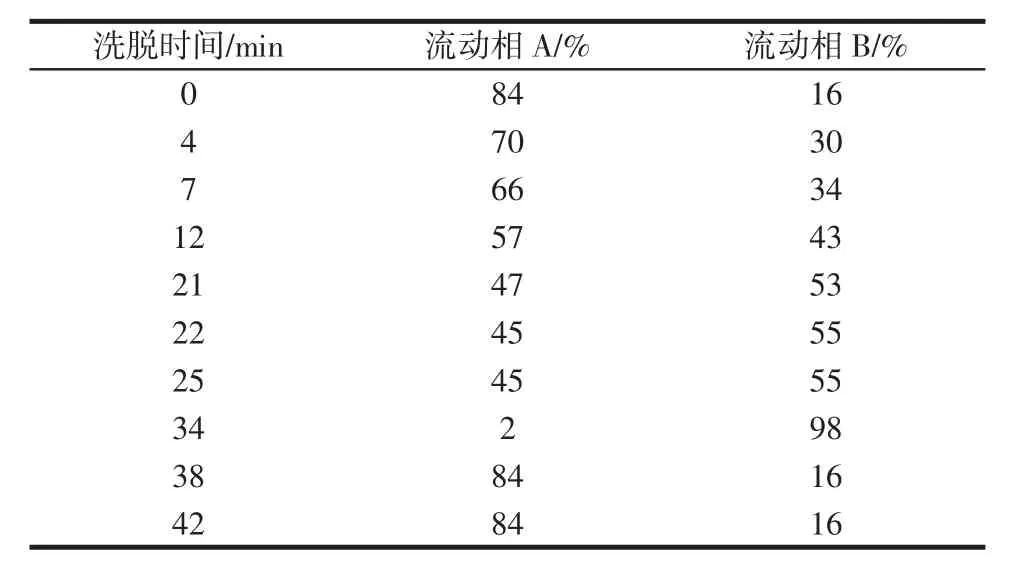
表1 HPLC流動相梯度設置Table 1 HPLC elution gradient
1.3.7 蛋白質二級結構的測定
稱取1 mg~2 mg面筋蛋白樣品,與200 mg溴酸鉀混勻研磨后壓片制樣,蛋白質二級結構采用傅里葉變換紅外光譜(Fourier transform infrared spectroscopy,FTIR)進行分析。測定參數:波長400 cm-1~4 000 cm-1,室溫下掃描32次,分辨率4 cm-1;使用Omnic軟件對紅外光譜數據進行校正、歸一化處理,并通過傅里葉去卷積分析面筋蛋白樣品中二級結構含量的變化[20]。
1.3.8 面筋網絡微觀結構的觀測
面筋蛋白樣品經噴金處理后,采用掃描電子顯微鏡(scanning electron microscope,SEM)觀測其微觀網絡結構,放大倍數為1 000倍。
1.4 統計與分析
數據表示為平均值±標準差,在0.05顯著性水平上進行單因素方差分析(ANOVA)。
2 結果與分析
2.1 OPC添加量對高筋小麥粉粉質特性的影響
面團是典型的黏彈性流體,同時具有黏性和彈性特征[21]。粉質特性曲線是評價面團特性的重要指標之一,能夠給出面粉吸水率、形成時間、穩定時間、弱化度、帶寬等面團流變學特性,反映面粉粉質品質[22]。其中,面團的形成時間和吸水率可以表征面筋蛋白的強弱,且呈正相關關系;穩定時間和弱化度可以反映面團機械攪拌過程中耐受程度和面筋筋度的強弱,穩定時間越長,弱化度越小,面筋強度越大;帶寬參數即曲線的垂直距離,帶寬越寬說明面團的彈性越好[23]。不同OPC添加量(0%~0.5%)對高筋小麥粉(濕面筋含量32.34%)粉質特性的影響如表2所示。
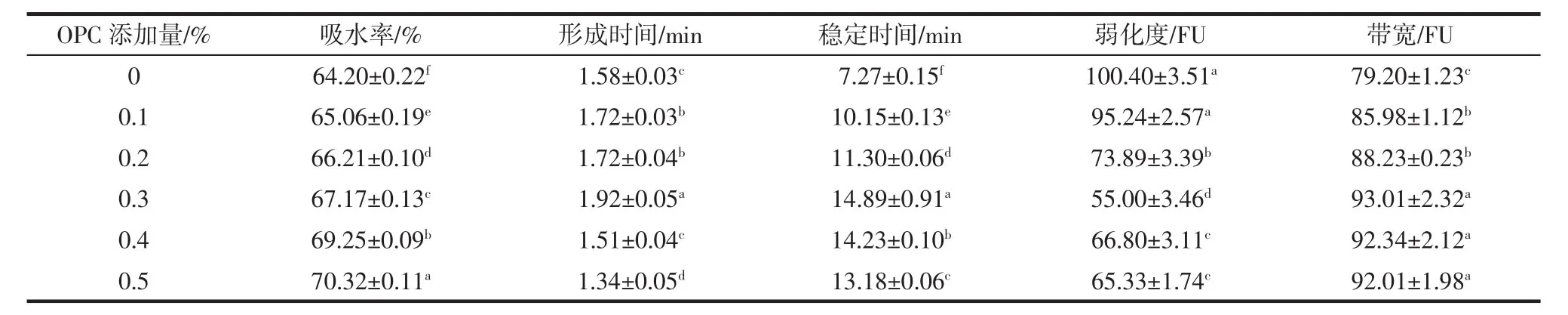
表2 不同OPC添加量對高筋小麥粉粉質特性的影響Table 2 Effects of OPC addition amounts on farinograph properties of high gluten wheat flour
由表2可知,隨OPC添加量的增加,面團吸水率增大,形成時間、穩定時間、帶寬均先增加后減少,而弱化度先減小后增大。雖然面團吸水率在OPC添加量為0.5%時最大,但當OPC添加量為0.3%時,面團形成時間和穩定時間均最長,弱化度最小,帶寬最大。結果表明,添加OPC可以適當提高面團的筋度,改善小麥粉粉質特性,提高面筋蛋白的強度,初步選定OPC添加量為0.3%為最佳。
2.2 OPC添加量對面筋蛋白粒徑的影響
選取醒發時間30 min,考察不同OPC添加量對面筋蛋白粒徑的影響如圖1A所示;選定OPC添加量為0.3%時,不同醒發時間對面筋蛋白粒徑的影響如圖1B所示。
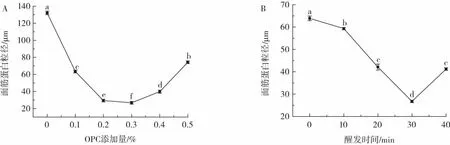
圖1 面筋蛋白樣品的粒徑測定結果Fig.1 Particle sizes of gluten protein samples
由圖1可知,面筋蛋白粒徑隨著OPC添加量的增加和醒發時間的延長均呈現先減小后增大的趨勢;固定醒發時間為30 min時,不同OPC添加量的面筋蛋白粒徑大小介于 26.7 μm~132.1 μm,當 OPC 添加量為0.3%時,粒徑最小;固定OPC添加量為0.3%時,不同醒發時間的面筋蛋白粒徑大小介于26.7 μm~63.9 μm,當醒發時間為30 min時,粒徑最小。這可能是由于OPC促進面筋蛋白中麥谷蛋白相互作用和交聯而導致可溶解的面筋蛋白含量和粒徑減小[13]。當OPC添加量為0.3%,醒發時間為30 min時,面筋蛋白粒徑最小,說明當添加OPC時,醒發時間對OPC促進面筋蛋白交聯作用也存在一定影響。
2.3 OPC添加對面筋蛋白中游離巰基和二硫鍵含量的影響
在面團揉制過程中形成的二硫鍵是維持面筋蛋白結構和功能的重要因素,其調控對面制品品質至關重要[24]。面筋蛋白中麥谷蛋白主要參與分子間二硫鍵的形成,而麥醇蛋白則主要參與分子內二硫鍵的形成[25]。不同OPC添加量和不同醒發時間對面筋蛋白中游離巰基和二硫鍵含量的影響結果如圖2所示。
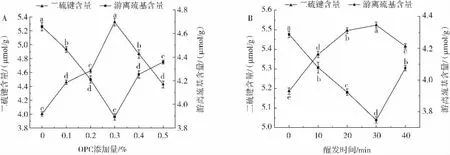
圖2 面筋蛋白樣品中游離巰基和二硫鍵含量測定結果Fig.2 Content of free sulfhydryl groups and disulfide bonds in gluten protein samples
由圖2可知,面筋蛋白樣品中游離巰基含量隨著OPC添加量的增加和醒發時間的延長均呈現先減小后增大的趨勢,而二硫鍵含量則先增大后減小,二者呈現相反的變化趨勢;固定醒發時間為30 min時,面筋蛋白中游離巰基含量在OPC添加量為0.3%時最小;固定OPC添加量為0.3%時,在醒發時間30 min時游離巰基含量最小,二硫鍵含量最大,說明OPC添加可能通過二硫鍵/巰基交換機制影響面筋蛋白交聯作用。選取OPC添加量為0.3%時,在醒發時間為30 min時游離巰基含量最小,二硫鍵含量最大,說明醒發時間也會干預OPC促進面筋蛋白交聯的二硫鍵/巰基交換過程,進而調控面筋網絡的形成。
2.4 游離氨基含量的測定
OPC作為一種多酚類物質,其結構中存在大量的酚羥基,在面團揉制過程中通過氧化醌基很容易與蛋白質上的游離氨基發生反應,進而促進面筋蛋白交聯作用[26-28]。為了研究OPC酚羥基是否與面筋蛋白中游離氨基發生了反應,在不同OPC添加量和不同醒發時間條件下,對面筋蛋白樣品中游離氨基含量進行了測定,結果如圖3所示。
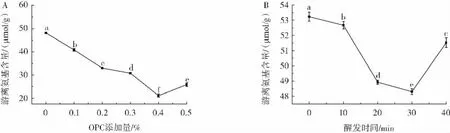
圖3 面筋蛋白樣品中游離氨基含量測定結果Fig.3 Content of free amino groups in gluten protein samples
由圖3可知,面筋蛋白樣品中游離氨基含量隨著OPC添加量的增加和醒發時間的延長均呈現先減小后增大的趨勢;醒發時間為30 min時,在OPC添加量超過0.3%時,游離氨基含量顯著降低,表明OPC酚羥基可能與面筋蛋白中游離氨基基團發生反應,通過游離氨基交聯機制促進面筋筋力的提高。OPC添加量為0.3%時,面筋蛋白粒徑在醒發時間30 min時最小,說明醒發時間也會干預OPC促進面筋蛋白交聯的游離氨基反應過程,進而調控面筋網絡的形成。
2.5 面筋蛋白中氨基酸的變化
已有研究表明,在面筋網絡的形成過程中會產生二酪氨酸和異二酪氨酸,麥谷蛋白亞基之間通過酪氨酸側鏈殘基以二酪氨酸或異二酪氨酸的方式發生分子間交聯形成麥谷蛋白交聯聚集體[18]。因此,二酪氨酸含量減少能夠說明蛋白交聯作用增強。在不同OPC添加量和不同醒發時間條件下,對面筋蛋白氨基酸變化進行了測定,結果如圖4所示。
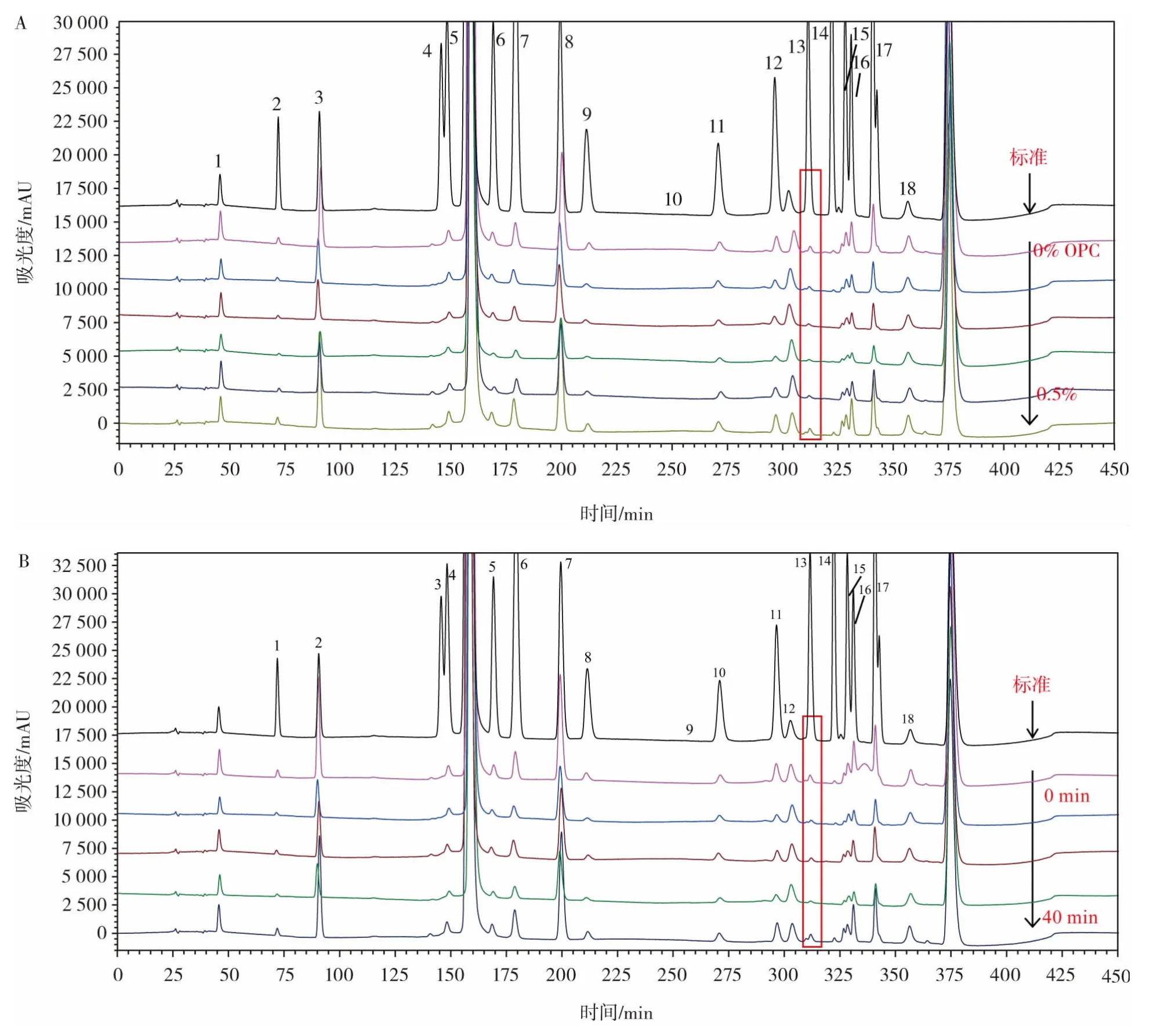
圖4 面筋蛋白中氨基酸變化HPLC測定結果Fig.4 HPLC results of changes in amino acids
由圖4可知,在不同OPC添加量和醒發時間條件下,面筋蛋白中不同氨基酸含量均有所變化,其中酪氨酸變化最明顯。酪氨酸含量隨著OPC添加量的增加和醒發時間的延長均呈現先降低后升高的趨勢;當OPC添加量為0.3%,醒發時間為30 min時,酪氨酸含量最低。雖然面筋蛋白中酪氨酸含量本身較低,相較于巰基/二硫鍵交換機制,酪氨酸交聯機制在面筋網絡形成過程中并不起主導作用;但OPC添加對面筋蛋白中酪氨酸也產生了一定的影響,且醒發時間也會對面筋網絡的形成產生影響。
2.6 面筋蛋白二級結構變化
為了進一步探究不同OPC添加量和醒發時間對面筋蛋白非共價交聯的作用,采用FTIR對面筋蛋白二級結構進行測定,并計算各二級結構含量,結果如圖5所示。
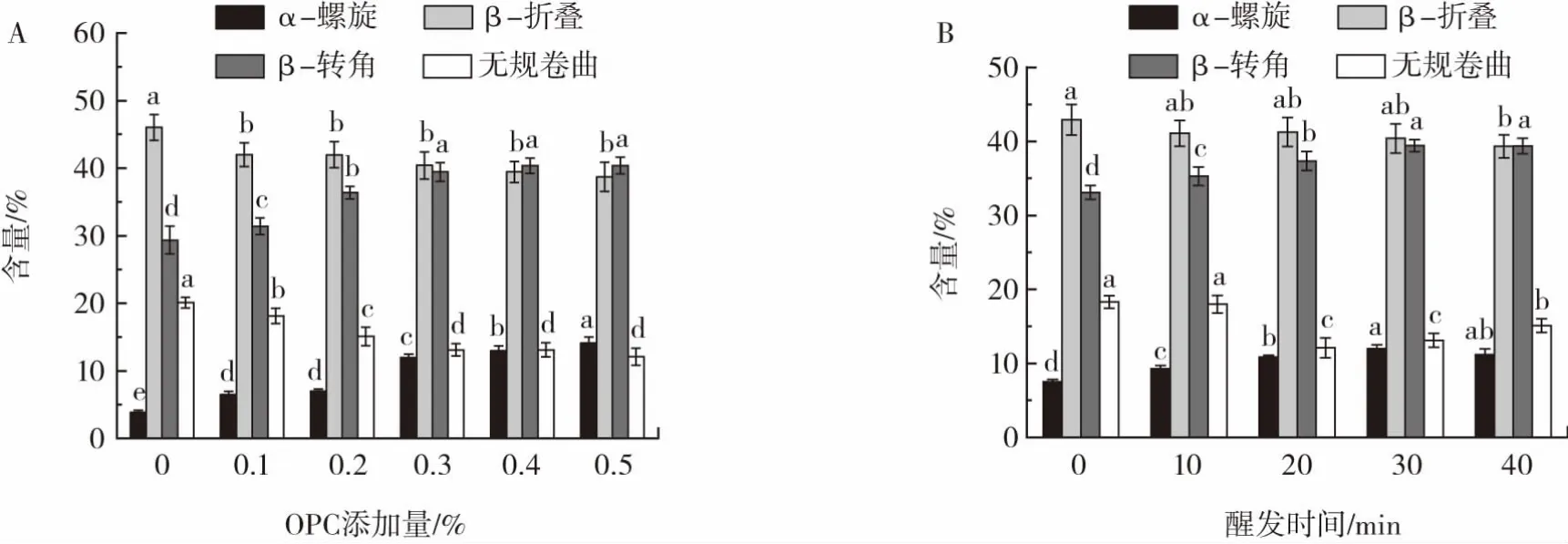
圖5 面筋蛋白二級結構含量測定結果Fig.5 The secondary structural contents of gluten proteins
由圖5可知,α-螺旋含量及β-轉角含量與OPC添加量及醒發時間均成正相關趨勢;β-折疊含量與OPC添加量及醒發時間均成負相關趨勢。這可能是由于氫鍵作用導致α-螺旋、β-轉角結構含量的增加,而氫鍵和疏水鍵作用導致面筋蛋白β-折疊結構含量減少[3]。因此,增加OPC添加量和延長醒發時間可以通過加強氫鍵和疏水相互作用,增強OPC與面筋蛋白的非共價交聯。
2.7 面筋蛋白微觀結構的SEM觀察
為了考察OPC添加對面筋蛋白微觀網絡結構的影響,在不同OPC添加量條件下,采用掃描電子顯微鏡對面筋蛋白樣品的微觀形貌進行了測定,結果如圖6所示。

圖6 OPC添加量對面筋蛋白微觀網絡結構的影響Fig.6 Effects of OPC addition amounts on the microstructure of the gluten samples
由圖6可知,固定醒發時間30 min,面筋蛋白骨架間孔隙隨著OPC添加量的增加呈現先減小后增大的趨勢。未添加OPC的面筋蛋白截面呈現多孔隙、蜂窩狀結構;隨著OPC添加量的增加,面筋蛋白形成更加致密的微觀網絡結構,骨架間孔隙變小,內部連接緊密的區域增多;當OPC添加量為0.3%時,骨架間孔隙最小,具有明顯成片、類似絮狀的微觀結構,面筋網絡結構最為致密;當OPC添加量超過0.3%后,骨架間孔隙變大,面筋網絡結構變得松散,但仍較未添加OPC時孔隙更小。因此,添加OPC對面筋蛋白微觀網絡結構存在一定影響。
3 結論
本文研究了葡萄籽低聚原花青素對面筋蛋白交聯作用的影響。結果表明,添加OPC對面筋交聯過程中二硫鍵-巰基交換反應、游離氨基交聯、酪氨酸交聯反應,以及氫鍵和疏水相互作用均存在一定影響,并且醒發時間也影響OPC對形成面筋網絡的促進作用。通過調控OPC添加量和醒發時間,提高了面團的吸水率、形成時間、穩定時間和帶寬,降低了弱化度;形成了均勻致密的面筋網絡結構。上述試驗結果為OPC及天然植物酚類作為面粉改良劑提供了前期的理論分析和試驗依據。

