Mus81基因沉默對MCF-7人乳腺癌細胞系增殖凋亡及化療敏感性的影響
常穎智 趙俐 張年偉 熊白玉 吳帆
1廣州市第一人民醫院,華南理工大學附屬第二醫院乳腺外科(廣州 510180);2廣州市紅十字會醫院普通外科(廣州 510220)
乳腺癌是女性最常見的惡性腫瘤之一,現隨著一系列靶向藥物的面世,乳腺癌患者的預后得到了明顯提升[1-2]。但由于部分乳腺癌對傳統內分泌及靶向治療均不敏感,因而尋找新的有效的治療靶點對改善乳腺癌預后至關重要[3]。甲磺酸鹽及紫外線敏感性81 號基因(methyl methanesulfonate and UV sensitive gene clone 81,Mus81)是定位于人11 號染色體長臂的DNA 修復基因,與多種惡性腫瘤的發生發展密切相關[4-5]。已有研究[6-7]提示Mus81 是一個潛在的腫瘤治療靶點,沉默Mus81 基因的表達可抑制人結腸癌、肝癌細胞系的增殖并促進凋亡,還可提高結腸癌及肝癌細胞系對化療藥物的敏感性。但關于Mus81 基因在乳腺癌中的作用及調控機制的研究目前還很少,尚有待進一步研究闡明[8-9]。為此,本研究沉默MCF-7 細胞系中Mus81 基因的表達,以觀察其對MCF-7 細胞增殖、凋亡、細胞周期及化療敏感性的影響。
1 材料與方法
1.1 材料人乳腺癌MCF-7 細胞系購自上海吉凱基因化學技術有限公司。M-MLV 試劑盒購自Promega 公司;MTT 試劑購自上海鼎國生物技術有限公司;凋亡試劑盒購自美國Ebioscience 公司;PI 染色試劑盒購自德國Sigma 公司。
1.2 慢病毒介導的siRNA針對Mus81 目的基因序列,設計如下RNA 干擾靶點序列:正義鏈:5′-CCGGGAGTTGGTACTGGATCACATTCTCGAGAAT -GTGATCCAGTACCAACTCTTTTTG-3′;反義鏈:5′-AATTCAAAAAGAGTTGGTACTGGATCACATTCTCGAGAATGTGATCCAGTACCAACTC-3′;陰性對照序列為:正義鏈:5′-CCGGTTCTCCGAACGTGTCACGTTTCAAGAGAACGTGACACGTTCGGAGAATTTTTG-3′;反義鏈:5′-AATTCAAAAATTCTCCGAACGTGTCACGTAAGTTCTCTACGTGACACGTTCGGAGAA-3′。引物退火制備上述目的基因片段后與線性化載體連接并轉化,篩選、抽提獲取高純度質粒。將上述質粒轉染至293T 細胞,收集Mus81 沉默及陰性對照慢病毒感染MCF-7 細胞,分別命名為Mus81沉默組(Mus81-siRNA)及陰性對照組(NC-siRNA)MCF-7 細胞。感染3 d 后觀察慢病毒感染效率并采用RT-qPCR 檢測分析Mus81 基因的干擾效率。
1.3 RT-qPCR 檢測Trizol 試 劑提 取MCF-7 細 胞總RNA,反轉錄獲得cDNA,行PCR 檢測,反應條件為:95 ℃預變性15 s,然后95 ℃變性5 s,60 ℃退火延伸30 s,共進行45 個循環。采用2-ΔΔCT法分析基因表達水平。
1.4 MTT檢測每組設3個復孔,將MCF-7細胞接種于96孔板,第2 天加入10 μL 的MTT(5 mg/mL),4 h 后吸去培養液,加入100 μL 二甲基亞砜。酶標儀檢測490 nm 吸光度(OD)值,繪制細胞生長曲線。
1.5 細胞克隆形成實驗將MCF-7 細胞以800 個細胞/孔接種于6 孔板,每組設3 個復孔,培養至14 d,中途每隔3 d進行換液。磷酸鹽緩沖液洗滌后加入1 mL 4%多聚甲醛固定30~60 min。加入結晶紫染液1 mL染細胞15 min,ddH2O洗滌后克隆計數。
1.6 細胞凋亡檢測每個實驗組設3個復孔,MCF-7細胞以1 300 rmp 離心5 min,PBS 洗滌細胞。1×binding buffer 洗滌細胞沉淀1 次,1 300 rmp 離心3 min。200 μL 1×binding buffer 重懸細胞沉淀,加入10 μL Annexin V-APC 染色,上機檢測。
1.7 細胞周期檢測每個實驗組設3 個復孔,以1 300 rmp 離心5 min,PBS 洗滌細胞沉淀。再次以1 300 rmp 離心5 min 后加入配制好的PI 染色液重懸,上機檢測。
1.8 MTT 法測定化療藥物敏感性以順鉑、阿霉素、表阿霉素及5-氟尿嘧啶等4 種化療藥物按5 個濃度梯度(表1),分別處理Mus81 沉默組MCF-7 細胞和陰性對照組細胞,以未經化療藥物處理的陰性對照組MCF-7 細胞作為空白組,MTT 檢測步驟同1.4,重復實驗3 次。繪制濃度-抑制率曲線并計算各化療藥物對兩組細胞的50%抑制濃度(IC50值),并計算Mus81 沉默對各化療藥物的逆轉指數(reverse index,RI)。

表1 各化療藥物的處理濃度Tab.1 The treatment concentrations of every chemotherapy drug
1.9 Western blot 檢測提取細胞總蛋白,以10%聚丙烯酰胺凝膠電泳分離,然后轉至PVDF 膜。依次加入兔抗人STC2、APAF1、APC、PTEN、MAPK3或MAPK1 抗體及相應二抗中孵育,經顯影曝光攝片。以小鼠抗人β-actin抗體檢測相同樣本作為內參照。
1.10 統計學方法應用SPSS 13.0 軟件進行統計分析,計量資料比較采用Student′st檢驗,生長曲線采用重復測量資料的方差分析。所有分析均為雙側檢驗,P<0.05 為差異有統計學意義。
2 結果
2.1 Mus81 的干擾效率熒光顯微鏡觀察顯示兩組細胞感染效率均高于80%(圖1A)。RT-qPCR 結果顯示Mus81 沉默組的Mus81 表達水平明顯低于陰性對照組[(0.272 ± 0.065)vs.(1.004 ± 0.116),P<0.001,圖1B],Mus81基因的沉默效率達72.8%。
2.2 MTT 生長曲線檢測Mus81 沉默組的MCF-7細胞吸光度值自第2天開始明顯低于陰性對照組,兩組生長曲線之間差異有統計學意義(P<0.01,圖1C),提示Mus81沉默后MCF-7細胞的生長速度明顯減緩。
2.3 平板克隆形成實驗Mus81 沉默組的細胞克隆數為(55 ± 5),明顯低于陰性對照組(273 ± 4),兩組差異有統計學意義(P<0.001,圖1D),提示Mus81 沉默明顯抑制了MCF-7 細胞的增殖。
2.4 細胞凋亡檢測Mus81 沉默組的細胞凋亡率為(10.10±0.30)%,明顯高于陰性對照組的凋亡率(3.87±0.06)%(P<0.001,圖1E),提示Mus81 沉默顯著促進了MCF-7 細胞的凋亡。
2.5 細胞周期檢測Mus81 沉默組MCF-7 乳腺癌細胞中處于G1期的比例低于對照組[(32.00±1.87)vs.(47.76 ± 0.92),P<0.001],而處于G2/M 期的比例高于對照組[(21.75 ± 0.29)vs.(11.10 ± 0.36),P<0.001],兩組細胞中處于S期的比例差異無統計學意義[(41.85±1.29)vs.(40.70±0.70),P>0.05,圖1F],提示Mus81 沉默組MCF-7 細胞出現了明顯的G2/M期阻滯。

圖1 沉默Mus81 基因對乳腺癌MCF-7 細胞生長、增殖、凋亡和細胞周期的影響Fig.1 Effects of Mus81 gene silencing on the growth,proliferation,apoptosis and cell cycle of breast cancer MCF-7 cells
2.6 Mus81 沉默對化療敏感性影響順鉑、阿霉素、表阿霉素和5-氟尿嘧啶對Mus81 沉默組的IC50均明顯低于陰性對照組(圖2),Mus81 基因沉默對各化療藥物的RI 見表2,提示Mus81 沉默可明顯提高MCF-7 細胞對順鉑、阿霉素、表阿霉素和5-氟尿嘧啶的化療敏感性。

圖2 順鉑、阿霉素、表阿霉素和5-氟尿嘧啶對兩組MCF-7 細胞的劑量-抑制率曲線Fig.2 Dose-inhibition rate curve of cisplatin,adriamycin,epirubicin and 5-fluorouracil on two groups of MCF-7 cells
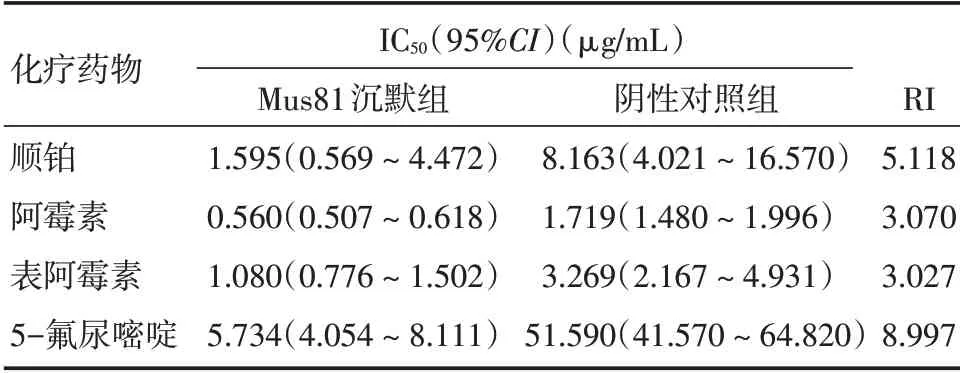
表2 各化療藥物對兩組MCF-7 細胞的IC50及RI 值Tab.2 The values of IC50 and RI for the chemotherapy drugs on two groups of MCF-7 cells
2.7 Mus81 下游蛋白及基因表達水平Mus81 沉默組MCF-7 細胞中APAF1、APC 及PTEN 蛋白的表達水平明顯升高,MAPK3 和MAPK1 蛋白的表達水平明顯下降,STC2 蛋白的表達水平則無顯著變化。qRT-PCR 檢測顯示APAF1、APC 和PTEN 在Mus81 沉默組中的表達較對照組升高,特別是APAF1 基因表達升高超過2.0 倍,APC 基因表達升高超過1.5 倍,而MAPK3 和MAPK1 的表達則明顯降低(圖3)。
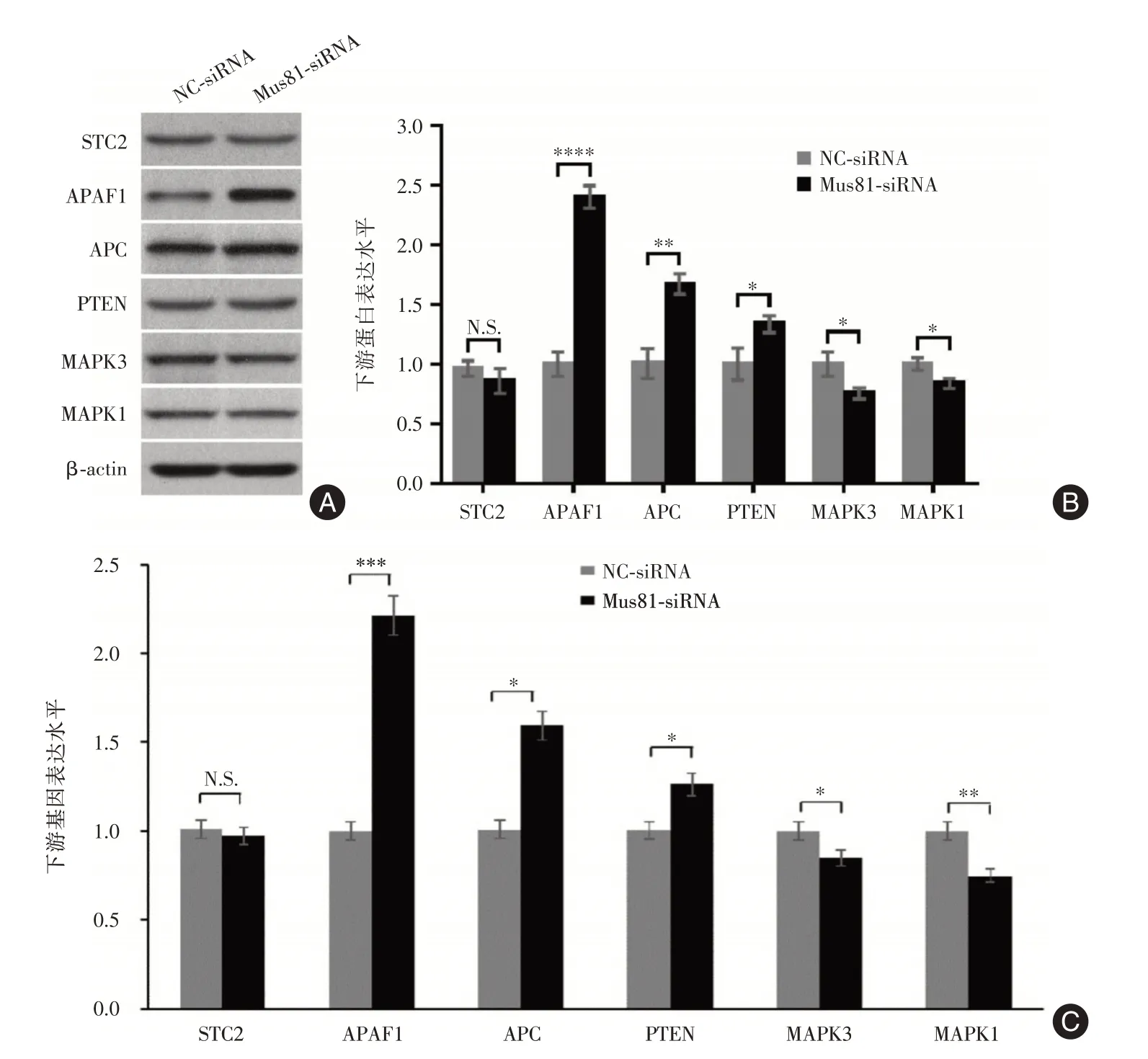
圖3 Mus81 下游蛋白及基因表達水平結果Fig.3 The results of protein and gene expression levels downstream of Mus81
3 討論
既往研究顯示,Mus81 在乳腺癌組織中表達下調,并且其表達水平與乳腺癌TNM 分期相關[9]。本研究的細胞學實驗顯示Mus81 基因沉默后可抑制人乳腺癌細胞系的生長及克隆。這些結果與筆者前期在結腸癌細胞系及肝癌細胞系中獲得的結果相一致,進一步提示Mus81 可促進腫瘤細胞的生長增殖[10]。但是,吳云路[8]等的結果顯示,過表達Mus81 可抑制人乳腺癌SKBR3 細胞系的增殖能力;YIN 等[11]在胃癌中的研究則顯示Mus81 沉默對胃癌細胞系的增殖無明顯的影響,提示Mus81 可能對不同的惡性腫瘤細胞的增殖具有不同的影響。進一步研究發現Mus81 沉默明顯促進了MCF-7 細胞的凋亡。這與Mus81沉默促進人結腸癌細胞和肝癌細胞的凋亡結果相一致,提示Mus81 沉默引起的細胞凋亡可能是導致MCF-7 細胞增殖抑制的原因之一。考慮到細胞周期阻滯是誘發細胞凋亡的常見原因,本研究也發現Mus81沉默可誘導MCF-7細胞出現G2/M 期阻滯,這與HIYAMA 等[12]在HCT116人結腸癌細胞系中觀察到的結果一致,提示Mus81沉默誘導的G2/M 期阻滯可能是導致MCF-7細胞生長增殖減緩并促進凋亡的原因之一。
QIAN 等[13]研究Mus81 對化療藥物敏感性的影響發現,沉默Mus81可增強MCF-7和T47D乳腺癌細胞對5-FU 藥物的敏感性。本研究不僅進一步驗證了Mus81 沉默可顯著提高MCF-7 細胞對5-氟尿嘧啶的敏感性,還發現Mus81 沉默可明顯提高MCF-7 細胞對順鉑、阿霉素、表阿霉素等其他常用化療藥物的敏感性,提示Mus81 沉默可與上述化療藥物聯用以提高總體敏感性或減少化療藥物的用量以降低化療藥物的毒副作用。綜合以上研究提示,Mus81 基因在調控乳腺癌細胞增殖凋亡及化療藥物敏感性上發揮了重要的作用,有望成為一個潛在的乳腺癌治療靶點。
為了初步探究Mus81 沉默抑制MCF-7 細胞增殖凋亡并調控化療敏感性的機制,本研究對前期研究中發現的6 個Mus81 下游基因表達水平進行檢測,結果顯示APAF1、APC 和PTEN 在Mus81 沉默組MCF-7 細胞中的表達升高,而MAPK3 和MAPK1表達降低,其中又以APAF1 和APC 表達水平的變化幅度最大,這與本研究團隊前期在肝癌中獲得的結果基本一致[10]。已有的研究發現APAF1對細胞凋亡起促進作用,APAF1 的過表達可抑制MCF-7細胞的增殖并促進細胞凋亡,還可將MCF-7 細胞阻滯在G1/S 期[14-15]。APC 則是一種多功能抑癌基因,LV 等[16]研究發現miR-135b 可通過下調APC 表達進而促進三陰性乳腺癌的增殖和侵襲。綜合文獻報道及本研究結果,推測Mus81 沉默可能通過影響APAF1、APC 等基因的表達調控MCF-7 細胞的增殖凋亡及化療敏感性,但Mus81 調控下游基因的具體機制仍有待研究。
綜上所述,本研究發現Mus81 基因沉默可明顯抑制MCF-7 細胞系的生長增殖并誘導G2/M 期阻滯及細胞凋亡,還可提高MCF-7 細胞對順鉑、阿霉素、表阿霉素和5-氟尿嘧啶等化療藥物的敏感性,其機制可能與調控APAF1、APC 等下游基因的表達水平有關,提示Mus81 可能是一個潛在的乳腺癌治療靶點。

