miR-520f-3p靶向MCL1抑制結腸癌細胞生長及移植瘤發生
陶正貴 杜靜虎 田葵 王東華 胡鳳琪 陳滿宇
(湖北文理學院附屬醫院 襄陽市中心醫院 1普外科,湖北 襄陽 441000;2腎內科)
在世界范圍內,結腸癌是全世界癌癥死亡的第二大主要原因〔1〕。結腸癌特征是結腸部分細胞的異常凋亡和惡性生長,結腸癌的常用治療方法是手術、化學療法、放射療法和靶向療法〔2〕。由于人們生活水平的提高、飲食的變化、多脂食品和多糖食品等食品的消費增加、生活節奏加快、工作壓力增加和環境污染,結腸癌的發病率逐年增加〔3〕。盡管在結腸癌的治療方面取得了顯著進展,結腸癌的5年生存率已超過60%,但在治療過程中仍然存在很多問題〔4〕。鑒于此,迫切需要更有效和新穎的結腸癌治療藥物和策略。miRNA參與了許多細胞過程的調節,包括代謝穩態、細胞增殖和細胞凋亡〔5〕。miRNA的異常表達已經與多種人類疾病的發病機制緊密相關,幾乎所有類型的癌癥都存在。miRNA在癌癥發展中的作用相當復雜,miRNA既可以通過抑制腫瘤抑制基因充當癌基因,也可通過負調控癌基因mRNA發揮腫瘤抑制作用〔6〕,其中miR-520f-3p是有效的mRNA之一。已有研究表明,miR-520f-3p靶向性別決定區Y框蛋白(SOX)9抑制胃癌細胞增殖〔7〕;也有研究表明miR-520f-3p通過負調控高氨酸拉鏈下調因子(LDOC)1增加膠質瘤的干性〔8〕。但miR-520f-3p在結腸癌中的作用尚不清楚。本文主要研究miR-520f-3p對結腸癌的作用及機制。
1 材料與方法
1.1主要試劑及儀器 miR-NC、pc-NC、miR-520f-3p mimic、miR-520f-3p inhibitor、pc-髓樣細胞白血病蛋白(MCL)1質粒和實驗所用各種引物由北京奧科生物科技有限公司設計并合成,Lipofectamine2000轉染試劑(上海少辛生物科技有限公司,貨號:11668-019),胎牛血清(北京百奧萊博科技有限公司,貨號:QS071),RPMI1640培養基(北京清大天一科技有限公司,貨號:MD800),青霉素和鏈霉素雙抗溶液(北京沃比森科技有限公司,貨號:C0160-611),SYBR-Green聚合酶鏈反應(PCR)試劑盒(嘉興藍諾盛生物科技有限公司,貨號:RT0411-03),RIPA裂解緩沖液(上海雅酶生物科技有限公司,貨號:PC101),雙熒光素酶報告基因檢測試劑盒(北京威格斯生物技術有限公司,貨號:T002),二喹啉甲酸(BCA)試劑盒(西安浩特生物科技有限公司,貨號:WB027),辣根過氧化物酶標記的山羊抗兔二抗、Ki67、增殖細胞核抗原(PCNA)、cleaved caspase-3、B細胞淋巴瘤(Bcl)-2、Bcl-2相關X蛋白(Bax)、MCL1抗體(上海艾博抗生物科技有限公司,貨號:ab36151、ab92742、ab18197、ab2302、ab32503、ab182858、ab32087),裸鼠購自四川夏派森醫藥科技有限公司,許可證:SYXK(川)2017-203。FluorChem HD2凝膠成像系統購自美國Proteinsimple公司,BS-1101全自動多功能酶標儀購自北京華泰和合商貿有限公司,FACSCalibur流式細胞儀購自美國BD公司,Seahorse XF24分析儀購自美國Seahorse公司。
1.2細胞及培養 正常結腸上皮細胞HCoEpiC和結腸癌細胞系(HT-29、SW480、LOVO、HCT15、Colo205、SW620)均購自上海素冉生物科技有限公司。在37℃、5% CO2條件下,所有細胞于含體積分數為10%胎牛血清、100 U/ml的青霉素和鏈霉素雙抗溶液的RPMI1640培養基中培養。
1.3組織樣品 在2018年2月至2020年2月期間,從湖北文理學院附屬醫院行腫瘤瘤切除術的患者中獲取組織。該研究得到醫院研究倫理委員會批準,并根據《赫爾辛基宣言》的道德準則進行,且獲得患者同意并簽訂知情同意書。
1.4實時熒光定量(RT-q)PCR檢測miR-520f-3p mRNA表達 將正常結腸組織和結腸癌組織剪碎并研磨,然后裂解提取總RNA。對于細胞,將正常結腸上皮細胞HCoEpiC和結腸癌細胞系(HT-29、SW480、LOVO、HCT15、Colo205、SW620)接種在12孔板中,當細胞達到近85%融合時,用RIPA裂解提取總RNA。用 cDNA逆轉錄試劑盒逆轉錄,以cDNA為模板按SYBR-Green PCR試劑盒說明書操作進行RT-qPCR。miR-520f-3p的循環條件為:95℃ 15 s和61℃ 35 s的40個循環,用U6標準化。使用2-ΔΔCt方法計算。每個樣品進行3次重復分析。引物序列為:miR-520f-3p正義鏈:5′- ACACTCCAGCTGGGCCTCTAAAGGGAAGCG-3′,反義鏈:5′-CTCAA CTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAG-3′;U6正義鏈:5′- CTCGCTTCGGCAGCACA-3′,反義鏈:5′-AACGCTTCACGAATTTGCGT-3′。
1.5細胞轉染 取對數期結腸癌HT-29細胞,以每孔1×106密度接種于12孔板。當達到85% 融合,根據Lipofectamine2000說明書按照分組將miR-NC、miR-520f-3p mimic、miR-520f-3p inhibitor和pc-NC、pc-MCL1質粒分別或聯合轉染進入HT-29細胞。
1.6克隆形成實驗檢測細胞生長能力 將1.5轉染的結腸癌HT-29細胞接種于6孔板,每孔1×106,直到生長至可見克隆細胞。用甲醇固定可見克隆細胞,0.25% 結晶紫染色30 min,計數克隆細胞數量。
1.7流式檢測細胞凋亡率 取1.5轉染的結腸癌HT-29細胞培養24 h后,離心收集細胞,并按1×106個細胞/ml的濃度重懸。細胞懸液中加入5 μl FITC標記的膜聯蛋白V和碘化啶,避光孵育15 min,然后用流式細胞儀分析細胞凋亡率。
1.8裸鼠移植瘤實驗 所有裸鼠分為4組:Control組、miR-NC組、miR-520f-3p mimic組、miR-520f-3p inhibitor組。在每只裸鼠左腋下皮下注射100 ml磷酸鹽緩沖液(PBS)中5×106各轉染的結腸癌HT-29細胞,繼續在SPF條件下正常飲食飼養〔9〕。第30天頸椎脫位法處死裸鼠,完整取出皮下腫瘤,測定移植瘤體積和重量,TUNEL檢測細胞凋亡率,Western印跡檢測Ki67、PCNA、cleaved caspase-3、Bax和Bcl-2蛋白表達水平。其中移植瘤體積測量方法是用游標卡尺分別測出a:長徑;b:寬徑;c:高,再用公式:V=πabc/6進行計算。
1.9Western印跡檢測Ki67、PCNA、 cleaved caspase-3、Bax、Bcl-2和MCL1蛋白表達水平 收集1.5轉染的結腸癌HT-29細胞和1.8移植瘤組織。用RIPA裂解液裂解細胞和組織并提取總蛋白。然后用BCA試劑盒定量蛋白的濃度。將蛋白樣品用十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)分離后,再用半干轉膜儀轉移到聚偏氟乙烯膜,室溫下于脫脂牛奶中封閉蛋白2 h。接著加入對應的兔來源的單克隆一抗(Ki67 1∶1 000、PCNA 1∶1 500、cleaved caspase-3 1∶1 000、Bax 1∶800、Bcl-2 1∶1 000、MCL1 1∶1 000),于4℃ 封閉過夜。然后,加入對應辣根過氧化物酶標記的山羊抗兔單克隆二抗(1∶2 000)室溫封閉1 h,最后滴電化學反應液曝光。以GAPDH為內參,使用軟件ImagePro Plus6.0分析蛋白條帶灰度,蛋白相對表達水平=目標蛋白積分吸光度值/內參蛋白GAPDH積分吸光度值。
1.10TUNEL染色檢測移植瘤細胞凋亡 取移植瘤組織固定后,常規石蠟切片,玻片預先用多聚賴氨酸處理以防止脫片。切片脫蠟入水后按TUNEL染色試劑盒內使用說明操作,二氨基聯苯胺(DAB)染色,常規脫水、透明、封片,光鏡下檢查。棕褐色細胞代表凋亡細胞,計算細胞凋亡率。
1.11免疫組化檢測Ki67陽性表達水平 石蠟切片經脫蠟水化,過氧化物酶阻斷內源性過氧化物酶活性,加入兔來源Ki67單克隆抗體(1∶250),4℃過夜,滴加生物素標記二抗,DAB顯色,蒸餾水沖洗,蘇木素復染,梯度酒精脫水,二甲苯透明,封片觀察統計。著色為棕黃色的表示細胞陽性。隨機選取5個視野用Image J計數陽性著色細胞,計算陽性細胞百分率(%)。
1.12雙熒光素酶報告檢測靶向關系 收集生長至對數期的結腸癌HT-29細胞,接種于24孔板中,并在37℃、5%CO2條件的培養箱培養24 h。然后,將1 μg PGL3-MCL1-WT(MCL1野生型)或PGL3- MCL1-MUT(MCL1突變型)及miR-NC或miR-520f-3p mimic和PRL-CMV質粒共轉染入結腸癌HT-29細胞,轉染48 h后,結腸癌HT-29細胞裂解15 min,雙熒光素酶檢測系統測量熒光素酶的相對活性,熒光素酶的相對活性(R/F)=螢火蟲熒光素酶活性/腎熒光素酶活性。
1.13統計學方法 采用SPSS22.0軟件進行單因素方差分析、t檢驗。
2 結 果
2.1miR-520f-3p在結腸癌組織和細胞中的表達情況 與正常結腸組織(0.45±0.07)相比,結腸癌組織中miR-520f-3p 的mRNA表達(0.45±0.07)顯著下調(P<0.01);與人正常結腸上皮細胞HCoEpiC(1.00±0.08)相比,結腸癌細胞系(HT-29、SW480、LOVO、HCT15、Colo205、SW620)中miR-520f-3p 的mRNA表達(0.34±0.07、0.42±0.08、0.51±0.09、0.38±0.06、0.47±0.08、0.44±0.09)顯著下調(均P<0.01),選取HT-29細胞做后續實驗。
2.2miR-520f-3p對HT-29細胞增殖和凋亡的影響 與Control相比,miR-NC組HT-29細胞克隆細胞數目、細胞凋亡率均無明顯變化(P>0.05);miR-520f-3p mimic組HT-29細胞克隆細胞數目顯著減少,細胞凋亡率顯著增加(P<0.01,見表1,圖1);miR-520f-3p inhibitor組HT-29細胞克隆細胞數目顯著增加,細胞凋亡率顯著減少(P<0.01,表1,圖2)。進一步運用Western印跡檢測HT-29細胞中增殖和凋亡相關蛋白的表達。與Control組相比,miR-NC組HT-29細胞中Ki67、PCNA、cleaved caspase-3、Bax和Bcl-2蛋白的表達均無明顯變化(P>0.05);miR-520f-3p mimic組HT-29細胞中Ki67和PCNA蛋白表達水平顯著下調,cleaved caspase-3和Bax/Bcl-2蛋白表達水平顯著上調(均P<0.01),miR-520f-3p inhibitor組HT-29細胞中Ki67和PCNA蛋白表達水平顯著上調,cleaved caspase-3和Bax/Bcl-2蛋白表達水平顯著下調(均P<0.01,見表2,圖3)。
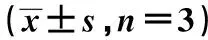
表1 miR-520f-3p對結腸癌HT-29細胞克隆形成和凋亡率的影響

圖1 克隆形成實驗檢測細胞增殖(結晶紫染色,×100)

圖2 流式檢測各組細胞凋亡率
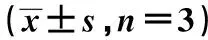
表2 各組HT-29細胞中增殖與凋亡相關蛋白的影響

1~4:Control組、miR-NC組、miR-520f-3p mimic組、miR-520f-3p inhibitor組圖3 Western印跡檢測Ki67、PCNA、cleaved caspase-3、Bax、Bcl-2蛋白表達水平
2.3miR-520f-3p對結腸癌HT-29移植瘤生長的影響 與Control組相比,miR-NC組結腸癌HT-29移植瘤體積和重量、細胞凋亡率、Ki67陽性細胞百分率均無明顯變化(P>0.05);miR-520f-3p mimic組結腸癌HT-29移植瘤重量和體積顯著減少,細胞凋亡率顯著增加,Ki67陽性細胞百分率顯著降低(均P<0.01);miR-520f-3p inhibitor組結腸癌HT-29移植瘤重量和體積及Ki67陽性細胞百分率顯著增加,細胞凋亡率顯著減少(均P<0.01)。見圖4,表3,圖5,圖6。進一步運用Western印跡檢測了腫瘤組織中增殖和凋亡相關蛋白的表達。與Contro組相比,miR-NC組結腸癌HT-29移植瘤組織中Ki67、PCNA、cleaved caspase-3、Bax和Bcl-2蛋白的表達均無明顯變化(P>0.05);miR-520f-3p mimic組結腸癌HT-29移植瘤組織中Ki67和PCNA蛋白表達水平顯著下調,cleaved caspase-3和Bax/Bcl-2蛋白表達水平顯著上調(均P<0.01);miR-520f-3p inhibitor組結腸癌HT-29移植瘤組織中Ki67和PCNA蛋白表達水平顯著上調,cleaved caspase-3和Bax/Bcl-2蛋白表達水平顯著下調(均P<0.01)。見表4,圖7。
2.4miR-520f-3p和MCL1靶向關系 通過 Targetscan軟件預測發現,miR-520f-3p與MCL1具有靶向關系,在3′UTR區存在結合位點;通過雙熒光素酶發現,與miR-NC組(1.00±0.07)相比,miR-520f-3p mimic與PGL3-MCL1-WT共轉染使熒光素酶活性(0.41±0.08)顯著降低(P<0.01)。與Control組(0.58±0.05)相比,miR-NC組(0.56±0.06)和pc-NC組HT-29細胞中MCL1表達(0.57±0.06)無明顯變化(P>0.05),miR-520f-3p mimic組HT-29細胞中MCL1表達(0.01±0.07)顯著下調,pc-MCL-1組HT-29細胞中MCL1表達(0.86±0.08)顯著上調(P<0.01)。見圖8。

圖4 各組移植瘤
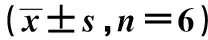
表3 miR-520f-3p對HT-29移植瘤生長的影響

圖5 TUNEL染色檢測各組移植瘤細胞凋亡(×200)

圖6 免疫組化檢測各組Ki67表達水平(×200)

表4 miR-520f-3p對腫瘤組織中增殖與凋亡相關蛋白的影響

圖7 蛋白印跡法檢測Ki67、PCNA、cleaved caspase-3、Bax、Bcl-2蛋白表達水平

A:Targetscan軟件預測miR-520f-3p與MCL1靶向關系;B:Western印跡法檢測MCL1蛋白表達水平;1~5:Control組、miR-NC組、miR-520f-3p mimic組、pc-NC組、pc-MCL1組圖8 miR-520f-3p和MCL1靶向關系
2.5MCL1過表達對miR-520f-3p在HT-29細胞增殖和凋亡的影響 與miR-520f-3p mimic+pc-NC相比〔(44.15±7.14)個、(28.53±5.78)%〕,miR-520f-3p mimic+pc-MCL1組HT-29細胞克隆細胞數目〔(98.27±10.52)個〕顯著增加,細胞凋亡率〔(9.43±3.45)%〕顯著減少(P<0.01)。與miR-520f-3p mimic+pc-NC相比,miR-520f-3p mimic+ pc-MCL1組HT-29細胞中Ki67和PCNA蛋白表達顯著上調,cleaved caspase-3和Bax/Bcl-2蛋白表達顯著下調(P<0.01),見圖9、表5。

A:克隆形成實驗檢測細胞增殖(結晶紫染色,×100);B:流式檢測細胞凋亡率;C:Western印跡法檢測Ki67、PCNA、cleaved caspase-3、Bax、Bcl-2蛋白表達水平;1~2:miR-520f-3p mimic+pc-NC組、miR-520f-3p mimic+pc-MCL1組圖9 MCL1過表達對miR-520f-3p在HT-29細胞增殖和凋亡的影響
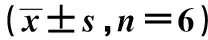
表5 MCL1過表達對miR-520f-3p在腫瘤組織中增殖與凋亡相關蛋白的影響
3 討 論
結腸癌是常見的發生于結腸部位的消化道惡性腫瘤,隨著人們生活水平的提高,結腸癌的發病率也緩慢上升〔10〕。由于miRNA在體液中穩定,無論是在分泌的微泡中還是與載體蛋白結合,miRNA都可以作為早期癌癥診斷的生物標志物。已有研究提出,miR-520f可作為肺癌診斷的生物標志物〔11〕。同一RNA在不同種類的腫瘤細胞中也具有不同的作用,如在人類黑色素瘤細胞中,miR-520f通過調控Itch表達促進細胞增殖,從而發揮致癌作用〔12〕;在肝癌中,miR-520f靶向TM4SF1抑制腫瘤細胞增殖和侵襲,從而發揮抑癌作用〔13〕。結腸癌特征是結腸部分細胞的異常和惡性生長。本研究表明,miR-520f-3p 過表達抑制結腸癌HT-29細胞增殖及移植瘤的生長,并誘導細胞凋亡,下調Ki67和PCNA蛋白表達,上調cleaved caspase-3和Bax/Bcl-2蛋白表達;miR-520f-3p 低表達促進結腸癌HT-29細胞增殖及抑制瘤的生長,并抑制細胞凋亡,上調Ki67和PCNA蛋白表達,下調cleaved caspase-3和Bax/Bcl-2蛋白表達。Ki67和PCNA蛋白是增殖標記蛋白,其表達量與細胞的增殖情況呈正比;cleaved caspase-3、Bax和Bcl-2是凋亡標記蛋白,其cleaved caspase-3表達量及Bax/Bcl-2表達量比值均與細胞的凋亡情況呈正比〔14〕。因此,miR-520f-3p在結腸癌中作為抑癌基因,抑制結腸癌細胞生長及移植瘤發展。這與miR-520f通過靶向ATP酶家族AAA含域蛋白2抑制胃癌細胞的生長結果相類似〔15〕。
miRNAs通過與靶mRNA的3′-UTR結合來調控基因表達。為了更好地了解其機制,本研究通過基因預測軟件預測發現,miR-520f-3p與MCL1具有靶向關系,在3′-UTR區存在結合位點。并通過熒光素酶實驗驗證了miR-520f-3p與MCL1具有直接靶向關系。MCL1位于染色體lq21,是一種屬于Bcl-2家族的抗凋亡基因,通常在許多惡性腫瘤中表達上調,發揮致癌作用〔16〕。已有研究表明,MCL1在結腸癌中高表達,MCL1降解是靶向治療結腸癌所必需的〔17〕。已有研究表明,在膠質瘤中,沉默MCL1基因可通過抑制磷脂酰肌醇-3激酶(PI3K)/蛋白激酶B(Akt)信號通路促進腫瘤細胞的衰老和凋亡〔18〕;在胃癌,中miR-125b通過靶向MCL1抑制腫瘤細胞增殖和侵襲〔19〕;在骨髓瘤中,miR-126通過下調抗凋亡蛋白MCL1誘導細胞凋亡〔20〕;在喉癌細胞中,miR-363的上調導致MCL1表達下降,可使細胞的增殖和侵襲減弱,加速細胞凋亡〔21〕。因此,通過抑制MCL1的表達抑制腫瘤細胞的增殖,并誘導腫瘤細胞的凋亡是癌癥預防的一種手段。本研究這說明miR-520f-3p通過靶向下調MCL1,來抑制結腸癌細胞生長及移植瘤的發展。這與MCL-1異常高表達與Bax和caspase-3的低表達共同抑制肝癌細胞的凋亡,并且三者在原發性肝癌的發生和發展過程中發揮作用〔22〕。
綜上,miR-520f-3p靶向MCL1抑制結腸癌細胞增殖及移植瘤的發展,說明miR-520f-3p 和MCL1可作為潛在的分子治療靶點。但本文僅為作用機制的初步探討,具體的分子通路機制還有待研究。

