IL-6、STAT3在糖尿病視網(wǎng)膜病變大鼠中的表達(dá)及曲克蘆丁水溶液治療對其水平的影響
楊馥宇,劉 輝,蘇 杰,王 玲,王林洪
糖尿病視網(wǎng)膜病變(diabetic retinopathy, DR)發(fā)病率為24%~70%,普遍認(rèn)為其發(fā)生與氧化應(yīng)激、免疫/炎癥、基因多態(tài)性等理論有關(guān),隨著研究不斷深入,部分學(xué)者指出免疫/炎癥理論在DR發(fā)生發(fā)展中起著重要作用[1-2]。白細(xì)胞介素-6(IL-6)為多效性細(xì)胞因子,動物實驗及體外實驗均已證實,IL-6在DR大鼠或患者外周血、視網(wǎng)膜組織中呈異常高表達(dá)[3-4]。而高水平IL-6可持續(xù)刺激磷酸化信號轉(zhuǎn)導(dǎo)與轉(zhuǎn)錄激活因子3(STAT3),激活小膠質(zhì)細(xì)胞,分泌過量IL-6,加劇視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡[5]。由此可見,調(diào)控IL-6、STAT3表達(dá)有望減輕DR患者炎癥反應(yīng),延緩病情進(jìn)展。曲克蘆丁具有抗炎、抗氧化、抑制細(xì)胞凋亡等諸多優(yōu)勢,但從IL-6、STAT3分子層面分析其在DR大鼠中應(yīng)用效果的研究較少。本研究建立DR大鼠模型,觀察IL-6、STAT3蛋白變化及曲克蘆丁水溶液的治療效果。現(xiàn)報告如下。
1 材料與方法
1.1材料 曲克蘆丁水溶液(神威藥業(yè)集團有限公司,國藥準(zhǔn)字H13023722);IL-6、STAT3試劑盒均購自上海酶聯(lián)生物科技有限公司;血糖測定試劑盒購自中生北控生物科技股份有限公司。
1.2實驗動物 健康雄性大鼠60只,購自北京華阜康公司,體質(zhì)量200~220 g,飼養(yǎng)于25 ℃環(huán)境下,空氣流通,12 h光照維持,采用鼠全價顆粒飼料適應(yīng)性喂養(yǎng)5 d。
1.3模型建立 將1.5 g鏈脲佐菌素溶于2% 0.1 mmol/L枸櫞酸緩沖液(pH 4.6),大鼠空腹12 h后,以50 mg/kg劑量進(jìn)行腹腔穿刺,回抽針?biāo)ǎ瑹o氣體、血液后注入藥物,造模3 d監(jiān)測血糖變化,當(dāng)空腹血糖(FPG)>16.5 mmol/L時,判定為DR模型制備成功[6]。
1.4動物分組及治療 取20只大鼠為正常組,每天給予生理鹽水100 mg/kg灌胃。建立DR模型后,隨機分為模型對照組和曲克蘆丁水溶液組,各20只。模型對照組每天給予生理鹽水100 mg/kg灌胃,曲克蘆丁水溶液組每天給予曲克蘆丁水溶液100 mg/kg灌胃。灌胃12周后剔除生理狀態(tài)差、體質(zhì)量差異大及死亡大鼠,后于3組中隨機選取12只大鼠行實驗研究。
1.5標(biāo)本采集 治療12周后,過量麻醉處死大鼠,取大鼠完整眼球,分離眼周圍軟組織,取出并剪開眼球,去除房水及晶狀體,充分暴露視網(wǎng)膜,清洗干凈后放入試管,液氮凍存。
1.6視網(wǎng)膜組織IL-6、STAT3測定 視網(wǎng)膜組織稱重后,采用冰浴研磨法制作10%組織勻漿,二辛可寧酸法檢測10%組織勻漿總蛋白濃度,樣本稀釋液稀釋,調(diào)整各樣本總蛋白濃度,采用酶聯(lián)免疫吸附試驗測定IL-6蛋白含量。采用蛋白免疫印跡法測定STAT3水平。TRIzol法提取視網(wǎng)膜組織總蛋白,提取的每只大鼠視網(wǎng)膜組織等量加入100 μl裂解液,反復(fù)過濾、離心,取30 μg樣本,十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳,轉(zhuǎn)膜,37 ℃環(huán)境封閉2 h,加入稀釋500倍的STAT3抗體,4 ℃孵育過夜,磷酸鹽緩沖溶液沖洗后與二抗結(jié)合,孵育1 h后顯色,蛋白相對表達(dá)水平以目的蛋白條帶灰度與內(nèi)參的比值表示。
1.7大鼠視網(wǎng)膜組織形態(tài)及視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡指數(shù) 摘取大鼠眼球后,常規(guī)固定、脫水、浸蠟包埋,切片厚度4 μm,應(yīng)用光鏡及透射電鏡觀察視網(wǎng)膜各層結(jié)構(gòu)及細(xì)胞形態(tài),記錄視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡數(shù)目,應(yīng)用IPP 6.0圖像分析軟件分析染色結(jié)果,計算視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡指數(shù)。視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡指數(shù)=凋亡細(xì)胞數(shù)量/細(xì)胞總數(shù)量×100%。
1.8血糖測定 于大鼠尾部穿刺取血,應(yīng)用全自動生化分析儀測定FPG、糖化血紅蛋白(HbA1c)水平。

2 結(jié)果
2.1大鼠一般情況 正常組大鼠體形適中,精神狀態(tài)良好,毛發(fā)光澤,反應(yīng)靈敏,晶狀體透明;模型對照組和曲克蘆丁水溶液組大鼠體形消瘦,精神萎靡,腹部肥大,毛發(fā)欠光澤,易脫毛,動作遲緩,晶狀體渾濁,甚至晶狀體皮質(zhì)溶解,角膜邊緣新生血管生長。
2.2大鼠視網(wǎng)膜組織形態(tài) 光鏡下,正常組視網(wǎng)膜組織結(jié)構(gòu)正常,各層細(xì)胞排列規(guī)則,外顆粒層感光細(xì)胞分布均勻,內(nèi)顆粒層細(xì)胞結(jié)構(gòu)清晰,各層纖維結(jié)構(gòu)無異常;模型對照組視網(wǎng)膜水腫,內(nèi)核層、外核層細(xì)胞間水腫,細(xì)胞排列紊亂;曲克蘆丁水溶液組視網(wǎng)膜厚度接近正常,外核層細(xì)胞間稍疏松,排列較整齊。透射電鏡下,正常組大鼠視網(wǎng)膜顯微結(jié)構(gòu)無異常,模型對照組可見細(xì)胞外節(jié)內(nèi)膜盤排列紊亂,含糖原顆粒沉淀,早期色素上皮細(xì)胞微絨毛脫落,內(nèi)質(zhì)網(wǎng)擴張;曲克蘆丁水溶液組可見外節(jié)內(nèi)膜盤排列整齊,色素上皮細(xì)胞微絨毛排列稀疏,細(xì)胞膜內(nèi)褶排列緊密。
2.3大鼠血糖測定結(jié)果 造模3 d后,曲克蘆丁水溶液組、模型對照組FPG、HbA1c高于正常組(P<0.05),但曲克蘆丁水溶液組與模型對照組比較差異無統(tǒng)計學(xué)意義(P>0.05)。治療12周后,曲克蘆丁水溶液組、模型對照組FPG、HbA1c高于正常組,但低于同組造模3 d后(P<0.05);治療12周后,曲克蘆丁水溶液組FPG、HbA1c低于模型對照組(P<0.05)。見表1。
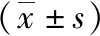
表1 3組大鼠血糖測定結(jié)果比較
2.4大鼠視網(wǎng)膜組織IL-6、STAT3水平及視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡指數(shù) 曲克蘆丁水溶液組、模型對照組視網(wǎng)膜組織IL-6、STAT3水平及視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡指數(shù)高于正常組,且曲克蘆丁水溶液組低于模型對照組(P<0.05)。見表2。
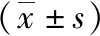
表2 3組大鼠視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡指數(shù)及視網(wǎng)膜組織IL-6、STAT3水平比較
3 討論
調(diào)查顯示,糖尿病病程>10年者眼底病變發(fā)病率為69%~90%,以DR尤為常見[7-8]。因此,本研究建立大鼠DR模型,造模3 d后模型對照組和曲克蘆丁水溶液組FPG水平均>16.5 mmol/L,分別給予生理鹽水、曲克蘆丁水溶液灌胃,治療12周后,曲克蘆丁水溶液組FPG、HbA1c水平均低于模型對照組,考慮與曲克蘆丁水溶液具有抗炎、抗氧化作用有關(guān),可顯著減輕炎癥、氧化應(yīng)激所致胰島素抵抗,起到控制血糖的目的,但具體機制不明。
傳統(tǒng)觀念認(rèn)為,血-視網(wǎng)膜屏障破壞及微血管病變是DR早期典型特征。新近研究指出,典型視網(wǎng)膜微血管改變前,機體已出現(xiàn)視功能減退及視神經(jīng)損傷,表現(xiàn)為色覺、對比敏感度、視網(wǎng)膜電圖等異常[9-10]。研究表明,1型糖尿病大鼠模型建立4周后出現(xiàn)神經(jīng)細(xì)胞丟失與凋亡[11]。神經(jīng)節(jié)對細(xì)胞損傷及神經(jīng)毒性作用高度敏感,可為DR早期病變鑒別診斷提供有利依據(jù),盡早抑制視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡是控制DR病情進(jìn)展關(guān)鍵環(huán)節(jié)。
研究表明,免疫炎癥是DR發(fā)病重要機制,調(diào)控免疫炎癥有望控制疾病進(jìn)展,但關(guān)于免疫炎癥產(chǎn)生的確切分子機制尚不完全清楚[12]。IL-6/JAK2/STAT3信號通路激活可促使B細(xì)胞分化為漿細(xì)胞,刺激IL-6自分泌,形成正前饋循環(huán),擴大炎癥反應(yīng),在糖尿病、DR等疾病中扮演重要角色[13]。IL-6主要作用為促進(jìn)血管活性物質(zhì)分泌、介導(dǎo)炎癥纖維蛋白表達(dá)。當(dāng)前研究證實,高水平IL-6是DR發(fā)生的獨立危險因素[14]。長期高血糖環(huán)境下,胰島細(xì)胞可合成大量IL-6,激活一系列炎癥和免疫應(yīng)答反應(yīng),產(chǎn)生細(xì)胞毒性作用,加重胰島素抵抗,增加DR發(fā)生的風(fēng)險[15-16]。同時IL-6可結(jié)合靶細(xì)胞表面IL-6受體(sIL-6R),形成sIL-6R/IL-6復(fù)合物,活化細(xì)胞膜表面糖蛋白130,刺激JAK2,活化受體酪氨酸激酶,結(jié)合STAT3蛋白,促進(jìn)STAT3磷酸化。磷酸化的STAT3可刺激核因子-κB(NF-κB),使其轉(zhuǎn)移至細(xì)胞核后,釋放過量炎性因子,正反饋作用于NF-κB,促進(jìn)炎癥反應(yīng),加劇視網(wǎng)膜組織損傷[17-18]。另外缺氧條件下,STAT3高表達(dá)會啟動血管內(nèi)皮生長因子轉(zhuǎn)錄,誘發(fā)基底膜增厚、微動脈瘤形成、新生血管形成等一系列病理變化,最終演變?yōu)镈R[19]。因此,調(diào)控IL-6/JAK2/STAT3信號通路有望成為臨床治療DR的靶點之一。
曲克蘆丁是蘆丁衍生物,其治療DR機制為,抑制血小板聚集,阻斷血栓形成;抑制Fenton反應(yīng)及脂質(zhì)過氧化鏈?zhǔn)椒磻?yīng),產(chǎn)生明顯抗脂質(zhì)過氧化作用;減少活性氧生成,抑制炎癥激活,發(fā)揮抗炎作用[20]。本研究顯示,曲克蘆丁水溶液組視網(wǎng)膜組織IL-6、STAT3水平及視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡指數(shù)低于模型對照組。提示曲克蘆丁水溶液可通過調(diào)節(jié)IL-6/JAK2/STAT3信號通路減輕炎癥反應(yīng),阻礙視網(wǎng)膜神經(jīng)節(jié)細(xì)胞凋亡,保護(hù)視網(wǎng)膜毛細(xì)血管,促進(jìn)DR病情轉(zhuǎn)歸。仍需注意的是,曲克蘆丁水溶液組各指標(biāo)均與正常組存在一定差異。提示曲克蘆丁水溶液治療DR大鼠效果仍存在一定局限性,建議后續(xù)通過延長曲克蘆丁水溶液治療時間、增加曲克蘆丁水溶液劑量等方面進(jìn)行更深入研究。
綜上所述,DR大鼠視網(wǎng)膜組織IL-6、STAT3呈高表達(dá),經(jīng)曲克蘆丁水溶液治療后其水平降低,但本研究僅采取實驗性DR大鼠展開研究,建議將來通過體外研究進(jìn)一步探討曲克蘆丁水溶液治療DR的作用靶點及關(guān)鍵機制。

