經肝動脈灌注化療在肝癌圍術期的作用
潘揚勛,陳敏山,徐立
(中山大學腫瘤防治中心 肝臟外科,廣東 廣州 510080)
原發性肝癌是最常見的消化道惡性腫瘤之一,其發病率及腫瘤相關病死率常年位居惡性腫瘤前列[1]。我國作為肝病高發國家,每年肝癌新發病例和死亡病例約占全球的一半[2]。肝細胞癌(hepatocellular carcinoma,HCC)作為原發性肝癌的主要病理類型,約占全部原發性肝癌的90%[3]。目前為止,手術治療仍然是實現早期HCC患者根治、獲得長期生存的首選方式。由于HCC起病隱匿,許多患者在發現時已經被診斷為中至晚期而失去了手術根治的機會。然而,HCC患者即便接受根治性切除術,其術后的5年復發率也高達80%[4]。因此,如何提高手術率并延長有高危復發因素的HCC患者的無瘤生存期,擴大患者的長期生存獲益是臨床上亟須解決的問題。
肝動脈灌注化療(hepatic arterial infusion chemotherapy,HAIC)經過數十年的發展,在技術和化療藥物的組合上已經有了長足的進步,尤其是近年來我國學者開創性地將奧沙利鉑/5-FU/亞葉酸鈣聯合方案用于HAIC,形成了具有中國特色的FOLFOXHAIC方案,并通過系列研究不斷證實其有效性,在全國逐漸推廣,成為了部分中晚期HCC患者的重要治療選擇[4-5]。有研究報道,12.8%~23.8%的中晚期HCC患者在接受HAIC治療后有機會接受根治性手術切除,這要顯著高于常規TACE治療(11.5%)或單純靶向藥物索拉非尼治療后的根治手術率(0.8%)[5-6]。同時,HAIC作為預防HCC術后復發的輔助性治療方式在一些研究中的初步探索取得了令人鼓舞的成果。現從HAIC作為輔助或新輔助性治療方式入手,對HAIC及其聯合治療在HCC圍手術期的作用進行綜述。
1 HAIC的發展歷史
HAIC的發展歷史已經超過30多年,HAIC是血管內介入治療的一種。對于肝臟的血管介入治療的認識和衍變大致可分為3 個階段。(1)最初的觀點認為肝動脈栓塞在肝癌的控制過程中起到了主要作用[7]。(2)而后在栓塞治療的基礎上,一些研究者開始聯合使用以鉑類為基礎的化療方案以強化栓塞的效果,進而發展成為肝動脈栓塞化療(transarterial chemoembolization,TACE)。日本目前較為常用的TACE方案是順鉑聯合表阿霉素,該方案使TACE成為不可切除肝癌的有效治療選擇,患者5年生存率可達25%[8]。(3)隨后,近年來的研究指出TACE治療對于正常肝組織的損傷較為嚴重,不利于后續治療的進行和患者的長期生存。而同期在肝轉移瘤中采用的HAIC治療因為放棄使用栓塞劑,在減少栓塞相關并發癥的同時也可獲得顯著療效。不僅如此,2013年我國研究者通過EACH研究首先證明了FOLFOX系統性化療方案治療肝癌的有效性和安全性[9]。中山大學腫瘤防治中心趙明等[10]率先報道將FOLFOX方案用于HAIC治療晚期HCC,其疾病控制率高達79.6%,明顯優于索拉非尼單藥;而在他們的另一項回顧性研究中,180例晚期HCC患者接受FOLFOX方案的HAIC治療,232例接受索拉非尼治療,兩組生存期分別為14.5和7.0個月,差異有統計學意義(P<0.001)[11]。這些研究提示,FOLFOX-HAIC應用于局部晚期肝癌具有優勢,患者生存獲益,且耐受性良好。國內其他中心后續的研究報道也驗證了這一治療方法的有效性和安全性[12-13]。日本有研究者對HAIC的其他方案進行了嘗試,Kudo等[14]的一項Ⅲ期臨床研究,對比了在晚期肝癌患者中使用索拉非尼系統治療聯合順鉑/氟尿嘧啶的HAIC方案以及索拉非尼單藥治療方案,研究結果顯示在索拉非尼系統治療的基礎上聯合順鉑/氟尿嘧啶的肝動脈灌注化療方案未能使患者長期生存獲益。
2 HAIC的治療原理
HAIC的理論依據基于肝臟及肝癌血供的不同特點:肝臟是具有雙重血供系統的特殊器官,正常肝臟來自肝動脈血供約占1/4、門靜脈血供約占3/4,而肝癌中90%的血供由肝動脈提供,門靜脈血供少于10%[15]。與全身化療比較,HAIC可顯著提高肝癌組織中的藥物濃度,同時減少化療藥物在外周血中的分布,從而降低全身毒副作用[16]。近年來借助微導管超選技術,血管介入治療可以直接對肝癌供血動脈精確給藥,進一步減少對周圍正常肝組織的損害,為將來的其他治療保留了更多的正常殘余肝組織[17]。而FOLFOX-HAIC方案采用持續灌注給藥(給藥時間維持24~48 h),較傳統的介入治療增加了藥物在肝臟腫瘤局部的作用時間,有利于藥物更好地發揮療效。
3 HAIC的應用
近年來,隨著化療藥物和血管介入治療技術的進步,HAIC對于不可切除HCC的治療反應率相比于傳統的系統治療有了顯著提升[5-6]。國內外共識也已經將其列為重要的不可切除HCC的轉化治療手段推薦使用[18-20]。我們對FOLFOX-HAIC在HCC轉化治療、術前新輔助性治療和術后輔助性治療中發揮的作用進行如下分析。
3.1 HAIC在不可切除HCC的轉化治療中的應用
根據中國肝癌分期(CNLC),介入治療是不可切除HCC患者的推薦治療方法之一[20]。盡管TACE仍然是目前公認的HCC血管介入治療的主要治療手段,也是傳統的HCC轉化治療方案[21],但對于長徑超過10 cm的不可切除HCC,TACE的療效并不令人滿意,手術轉化率僅為10%,患者中位總體生存時間也僅為6.5~9.1個月[22-24]。TACE作為大肝癌患者的轉化治療,其成功率較低的原因可能在于巨大腫瘤的供血血管及其交通支較多,較難對腫瘤實施完全徹底的栓塞。并且,由于TACE治療后腫瘤大多表現為壞死和碘油沉積,動脈期強化區域減少或消失,但腫瘤整體體積縮小通常并不顯著(圖1A),對后續手術切除的切緣及切除范圍改善相對有限[25-26]。例如,Zhao等[26]在TACE聯合索拉非尼治療晚期肝細胞癌的研究中,采用mRECIST標準評價的客觀反應率(ORR)可達69.0%,而采用RECIST 1.1標準評價的ORR僅27.0%。另外在栓塞之后HCC患者發生栓塞相關的不良事件風險較高,如栓塞綜合征、異位栓塞、組織粘連等,會影響后續的手術[21,27]。
與TACE相比,HAIC給藥更符合藥代動力學要求,并提高局部藥物濃度,有效避免栓塞綜合征及異位栓塞等不良事件發生,具有更好的安全性及有效性[6]。有研究指出,以順鉑為基礎的HAIC化療方案治療晚期HCC較TACE具有更顯著的療效[28-29]。Sumie等[29]的研究顯示,HAIC治療晚期HCC的ORR高于TACE,分別為56.3%和23.8%。Kim等[28]的研究顯示,HAIC和TACE治療晚期肝癌的ORR分別為16.7%和0,患者總體生存時間分別為193 d和119 d,HAIC的手術轉化率優于TACE。He等[30]的一項FOLFOX-HAIC對比TACE治療HCC的前瞻性研究結果顯示,對于腫瘤長徑大于10 cm不可切除的HCC患者,HAIC組的ORR及疾病控制率均顯著優于TACE組(54.1%vs9.8%,83.8%vs52.5%,均P<0.05),HAIC組有更多的患者經過轉化治療降期后有機會接受手術切除(10/35vs3/41,P=0.033);HAIC組的不良事件發生率也明顯低于TACE組(3~4級不良事件為13/35vs27/41,P=0.007;嚴重不良事件為6/35vs15/41,P=0.044)。中山大學腫瘤防治中心石明教授團隊[6]近期發表了一項基于FOLFOX方案的HAIC對比TACE治療腫瘤長徑≥7 cm、無大血管侵犯或肝外擴散的HCC患者的Ⅲ期臨床試驗(NCT02973685),研究共入組315 例患者,隨機分配至HAIC組(159 例)或TACE組(156 例),結果顯示:HAIC組患者總體生存時間明顯長于TACE組(23.1個月vs16.1個月,P<0.001),HAIC組對治療的客觀反應率也更高(RECIST 45.9%vs17.9%,P<0.001;mRECIST 48.4%vs32.7%,P=0.004),嚴重的治療相關不良事件發生率更低(19%vs30%,P=0.030),經轉化治療后手術切除率更高(23.8%vs11.5%,P=0.002)。HAIC治療有效的患者更多表現為腫瘤絕對體積的縮小(圖1B),更符合外科手術對保留更多正常肝臟以及改善切緣的要求。因此,HAIC對于在HCC的轉化治療中縮小腫瘤體積、爭取手術切除上具有更加廣闊的應用前景。
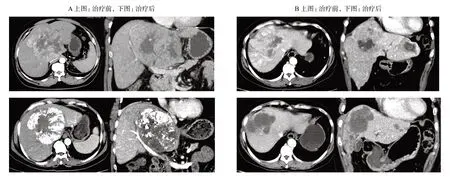
圖1 肝細胞癌患者經TACE(A)或HAIC(B)治療后的腫瘤變化
3.2 HAIC作為新輔助治療在HCC中的應用
2021 年ASCO公布了一項將FOLFOX-HAIC用于超米蘭標準的BCLC A/B期HCC的新輔助治療的中期研究結果[31]。該研究報道,新輔助FOLFOXHAIC治療后患者1、2和3年的總體生存率(OS)分別為92.9%、78.6%和63.5%,明顯高于直接手術組(分別為79.5%、62.0%和46.3%,P=0.016);不僅如此,新輔助治療組患者6、12 和18 個月的無進展生存率(PFS)也要明顯優于直接手術組(77.6%、50.4%和47.4%vs52.7%、42.8%和34.8%,P=0.017)。這表明FOLFOX-HAIC除了可以有效縮小腫瘤體積、提高轉化切除率外,還可作為有效的新輔助治療手段,減少超米蘭標準的早中期肝癌術后微血管侵犯(MVI)檢出率,改善患者PFS及OS。
3.3 HAIC作為肝癌術后輔助性治療的價值
Chau等[32]通過術后動脈置泵的方式,采用以順鉑為基礎的化療方案對切除術后的HCC患者進行輔助性治療,研究結果顯示,對于TNM分期Ⅰ期或者Ⅱ期的HCC患者,術后輔助性灌注化療可以有效降低患者術后復發率,5年無疾病生存率較對照組要高近40%[32]。這也啟發了隨后的研究者對輔助性HAIC治療作進一步探索。中山大學腫瘤防治中心郭榮平等[33]近期開展了輔助性HAIC的Ⅲ期隨機對照研究,在HCC根治性切除術后,針對術后病理提示MVI的HCC患者采用FOLFOX-HAIC方案,進行1~2個療程的輔助性治療(AT組),對照組則單純隨訪(FU組)。在隨訪過程中AT組和FU組分別有18例(31.0%)和25例(43.1%)患者術后復發;AT組和FU組的6、12和18個月無疾病生存率(DFS)分別為84.7%、61.8%和58.7%vs62.9%、48.1%和38.6%(P=0.023)。這提示,對于存在MVI的HCC患者,術后輔助性HAIC可有效降低術后復發率,患者的長期預后更好[33]。
3.4 血管介入治療在圍手術期的作用
因其微創性和經腫瘤供血動脈給藥的精確性,血管介入治療是HCC患者圍手術期較為適合的治療手段。一方面,血管介入治療不影響腹腔內的解剖結構,不影響隨后的手術實施;另一方面,血管介入治療集中于肝臟局部給藥,對患者的全身反應和術后恢復的影響較小。為了探究血管介入治療在術前新輔助治療和術后輔助性治療中的價值,筆者團隊回顧性分析了一批潛在可切除的合并門靜脈分支癌栓的HCC患者接受FOLFOX方案為基礎的術前新輔助性HAIC治療(HAIC組)或者術后輔助性門脈灌注化療(PVC組)的預后情況,結果顯示,HAIC組患者的OS要明顯長于PVC組(中位OS未達到vs19.47個月,P=0.043);接受新輔助HAIC后再行肝切除術的患者無復發生存率比先行肝切除后接受PVC的患者有顯著性提高(16.90個月vs3.17個月,P=0.022)[34]。不僅如此,新輔助性HAIC治療在術前間接篩選出了對介入治療敏感且短期內未出現遠處轉移的HCC患者,使得這類患者手術切除的生存獲益更為明顯。因此,對于合并門靜脈分支癌栓的潛在可切除的HCC患者,選擇適當的新輔助性治療可有效提高患者的手術預后。
3.5 HAIC聯合系統治療
隨著系統性治療藥物的不斷推陳出新,逐步形成了局部聯合系統性藥物治療中晚期HCC以提高腫瘤反應率的治療理念。Zheng等[35]對TACE難治性中晚期肝癌患者采取TACE聯合索拉非尼及免疫檢查點抑制劑的治療方案,在疾病控制率(81.82%vs55.17%,P=0.046)、無進展生存時間(16.26個月vs7.30 個月,P<0.001)及總生存時間(23.3 個月vs13.8 個月,P=0.012)方面均要優于TACE僅聯合索拉非尼的治療方案,這初步證明了聯合治療在中晚期HCC患者中應用的可行性。筆者團隊正在開展一項針對局部晚期、血管侵犯局限于半肝并侵犯門靜脈分支的肝癌患者的前瞻性、非隨機Ⅱ期研究(NCT03869034)[36],患者非隨機分至免疫檢查點抑制劑聯合FOLFOX-HAIC組或單純HAIC組,初步分析的26例可評價患者中有17例接受手術切除,手術轉化率達65.4%,其中2例病理證實完全緩解。治療相關不良反應均為1~2級,未出現治療相關嚴重不良事件。該研究結果初步表明免疫檢查點抑制劑聯合FOLFOX-HAIC治療是安全有效的,對于局部晚期、潛在可切除的肝癌患者可實現較高的手術轉化率及較為理想的無進展生存時間。因此,在中晚期肝癌轉化治療上,基于HAIC的聯合治療可以與其他治療方式協同作用,達到“1+1>2”的抗腫瘤效果。
4 結語
隨著藥物的不斷更新和血管微創介入技術的發展,HAIC對于中晚期HCC的局部控制率已經有了大幅提高,其作用已不僅僅局限于中晚期HCC患者的姑息性治療,在一些有高危因素(如腫瘤巨大,多發或合并血管侵犯等)的HCC患者圍手術期的應用也能夠帶來生存獲益。不僅如此,FOLFOX-HAIC聯合其他系統治療也有令人鼓舞的協同效果。因此,期待進一步探索以FOLFOX-HAIC為基礎的圍手術期治療方法,為HCC的治療帶來新的突破。

