刀狀黑黃檀基因組特征與種群遺傳變異分析
劉 宇,鄭勇奇,李長紅,林富榮,黃 平*
(1.林木遺傳育種國家重點(diǎn)實(shí)驗(yàn)室,中國林業(yè)科學(xué)研究院林業(yè)研究所,國家林業(yè)和草原局森林培育重點(diǎn)實(shí)驗(yàn)室,北京 100091;2.溫州市資源植物創(chuàng)新利用重點(diǎn)實(shí)驗(yàn)室,浙江省農(nóng)業(yè)科學(xué)院浙江省亞熱帶作物研究所,浙江 溫州 325005)
刀狀黑黃檀(Dalbergia cultrata Graham ex Benth)隸屬于豆科(Fabaceae)黃檀屬(Dalbergia),高大落葉喬木,其主要分布區(qū)位于中國云南省南部以及相毗鄰的中南半島的熱帶與亞熱帶地區(qū)[1]。刀狀黑黃檀是珍貴的紅木樹種,由于其心材呈黑褐色,新切面具有酸香氣味,新切面紫、黑或栗褐,常帶紫或黑褐窄條紋,在中國《紅木》(GB/T 18 107-2017)國家標(biāo)準(zhǔn)中被歸類于黑酸枝木系,是制作高檔家具、樂器以及工藝品的優(yōu)質(zhì)材料;同時,心材和根可入藥,具有較好的藥用價值[2];刀狀黑黃檀根系發(fā)達(dá),對土壤要求不高,且具有良好的抗病、抗蟲等特性,是困難立地生態(tài)修復(fù)的優(yōu)良樹種[3]。以往研究主要關(guān)注了刀狀黑黃檀的野生資源分布以及氣候變化對其影響、育苗方法、木材內(nèi)含物化學(xué)成分等方面[3-6]。刀狀黑黃檀心材形成周期長導(dǎo)致了突出的供需矛盾,也造成了野生資源的過度開發(fā),而經(jīng)濟(jì)社會高速發(fā)展過程中的土地利用轉(zhuǎn)變以及氣候變化的風(fēng)險可能進(jìn)一步擠壓其原生棲息地范圍,致使野生資源數(shù)量進(jìn)一步減少,野生資源正在遭受遺傳侵蝕的風(fēng)險[4]。盡管刀狀黑黃檀早已被列入IUCN(International Union for Conservation of Nature)紅色名錄(近危級,Near threatened,NT)以及《中國高等植物受威脅物種名錄》(易危級,Vulnerable,VU A2c)[7],但是關(guān)于該物種種群遺傳保護(hù)研究尚未見報道,也缺少相關(guān)背景基因組信息以及物種特異性的遺傳標(biāo)記。
分子標(biāo)記是有效量化和科學(xué)評價種群遺傳變異程度的分析工具,被廣泛應(yīng)用于遺傳圖譜構(gòu)建、數(shù)量性狀定位、遺傳多樣性與遺傳結(jié)構(gòu)評價等方面[8]。SSR分子標(biāo)記是群體遺傳學(xué)研究中最常用的DNA分子標(biāo)記之一,隨著NGS測序技術(shù)的發(fā)展與成本降低,基于測序數(shù)據(jù),通過生物信息學(xué)分析方法可快速、高效的發(fā)掘出大量的潛在SSR標(biāo)記位點(diǎn),進(jìn)一步結(jié)合分子實(shí)驗(yàn)篩選驗(yàn)證則可對多態(tài)性基因組SSR標(biāo)記進(jìn)行鑒定,在林草遺傳分析中已有諸多應(yīng)用,如元寶楓(Acer truncatum Bunge)、象草(Pennisetum purpureum Schum.)和開心果(Pistacia vera L.)等[9-11]。
為了掌握刀狀黑黃檀的遺傳信息,開發(fā)一套可用于遺傳分析的適宜分子標(biāo)記,本研究基于NGS測序技術(shù)對刀狀黑黃檀基因組的基本特征進(jìn)行了初步評估,通過實(shí)驗(yàn)篩選開發(fā)了一套重復(fù)性高、多態(tài)性好的SSR標(biāo)記,并在其野生種群中進(jìn)行了初步驗(yàn)證與評價分析。研究結(jié)果不僅可為刀狀黑黃檀群體遺傳學(xué)研究提供可靠分析工具,而且為進(jìn)一步深入開展種質(zhì)資源收集保存、分析評價提供科學(xué)依據(jù)。
1 材料與方法
1.1 試驗(yàn)材料
基因組測序試驗(yàn)材料:2018年3月在云南省普洱市六順鄉(xiāng)(LSX)采集刀狀黑黃檀成熟種子,采種母樹憑證標(biāo)本存放于中國林業(yè)科學(xué)研究院林業(yè)研究所。于當(dāng)年在中國林科院科研溫室播種育苗,育苗基質(zhì)為草炭土與蛭石(3:1),常規(guī)水肥管理,選擇長勢良好且健康的植株,采集新鮮葉片,液氮保存,用于基因組DNA提取。
SSR分子標(biāo)記篩選試驗(yàn)材料:選擇云南省普洱市六順鄉(xiāng)(LSX)、江城(JC),西雙版納傣族自治州景洪(JH)等3個地點(diǎn)進(jìn)行采樣,采樣地理環(huán)境信息見表1。每個采樣點(diǎn)隨機(jī)選擇30個個體,共計(jì)90個樣品,不同個體間距離大于50 m。采集新鮮葉片,經(jīng)硅膠完全干燥后,放置于?20 ℃冰箱保存,用于DNA提取。
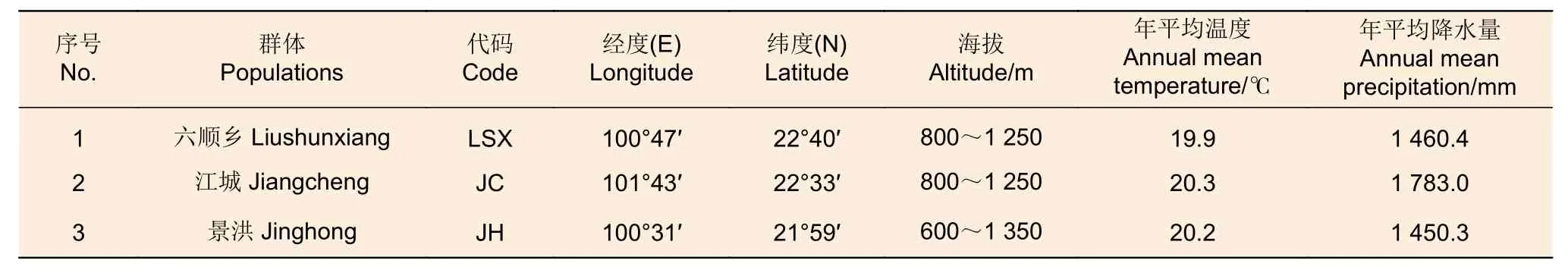
表1 刀狀黑黃檀采樣點(diǎn)信息Table 1 Sampling information of D.cultrata
1.2 DNA提取和測序
采用CTAB法[12]從葉片樣品中提取基因組DNA,分別用1.0%瓊脂糖凝膠電泳和ScanDrop 100分光光度計(jì)(Molecular Device,California,United States)檢測DNA濃度及質(zhì)量。利用illumina HiSeqTM2500測序平臺(illumina,San Francisco,United States),基于標(biāo)準(zhǔn)規(guī)程構(gòu)建一個插入片段大小為300 bp的文庫。基于K-mer分析,估計(jì)基因組大小、雜合度以及重復(fù)序列比率[13]。
參考Luo等的方法[14],利用SOAPdenovo v 2.04軟件進(jìn)行基因組初步組裝。構(gòu)建Contig序列(K-mer=17)并進(jìn)一步組裝為Scaffold,使用GapCloser v 1.12-r6修補(bǔ)Scaffold內(nèi)部缺口。以每10 kb作為1個窗口,進(jìn)行非重疊滑窗統(tǒng)計(jì),計(jì)算每個窗口的平均深度與GC含量,獲得GC-depth點(diǎn)圖,進(jìn)而估計(jì)基因組GC含量。
1.3 SSR位點(diǎn)檢測與引物設(shè)計(jì)
采用MISA(http://pgrc.ipk-gatersleben.de/misa/misa.html)對初步組裝Scaffold進(jìn)行潛在SSR位點(diǎn)檢索,挖掘候選SSR標(biāo)記。參數(shù)設(shè)置為:二至六核苷酸基序重復(fù)單元最小重復(fù)次數(shù)值分別設(shè)置為6、5、4、4、4。利用Primer Premier v 5.0軟件設(shè)計(jì)引物,引物參數(shù)分別為:引物長度18~22 bp,產(chǎn)物大小100~300 bp,退火溫度55~62 ℃,最優(yōu)值為60 ℃。隨機(jī)挑選300對引物,由睿博興科生物公司(北京)合成。
1.4 SSR引物篩選與驗(yàn)證
從六順鄉(xiāng)(LSX)、江城(JC)和景洪(JH)3個種群90個樣品中隨機(jī)挑選出4個樣品對300對引物進(jìn)行瓊脂糖凝膠電泳初篩,選擇擴(kuò)增條帶清晰,穩(wěn)定性良好的引物進(jìn)行復(fù)篩。復(fù)篩時在90個樣品中隨機(jī)挑選8個樣品進(jìn)行8.00%非變性聚丙烯酰胺凝膠電泳檢測,擴(kuò)增產(chǎn)物條帶明亮、清晰,無背景噪音,即復(fù)篩合格引物。然后,利用熒光毛細(xì)管電泳檢測候選SSR位點(diǎn)多態(tài)性,最后利用多態(tài)性SSR位點(diǎn)分析3個種群(90個個體)遺傳變異程度,初步評估SSR位點(diǎn)適用性以及種群遺傳變異程度。
PCR反應(yīng)體系為:基因組DNA 50 ng,2×Taq MasterMix(Dye)(康為世紀(jì),北京)12.5 μL,正向引物(10 μmol·L?1)0.5 μL,反向引物(10 μmol·L?1)0.5 μL,用 ddH2O 補(bǔ)至 25 μL。PCR程序?yàn)椋?6 ℃ 預(yù)變性 3 min,然后96 ℃ 變性30 s,60 ℃退火30 s,72 ℃延伸45 s,共30個循環(huán),最后72 ℃延伸7 min。
利用GeneMaker v 2.2.0對SSR位點(diǎn)進(jìn)行基因分型,并進(jìn)行二次人工復(fù)核。
1.5 遺傳多樣性分析評價
采用GenAlEx v 6.502[15]計(jì)算下列群體遺傳參數(shù),包括觀測等位基因數(shù)(Na),有效等位基因數(shù)(Ne),觀測雜合度(Ho),期望雜合度(He),Shannon's信息指數(shù)(I),種群間遺傳分化系數(shù)(FST),哈溫平衡偏離顯著性(HWE(p))等。采用GeneALEx v 6.502[15]進(jìn)行分子方差分析(AMOVA)以檢測遺傳變異來源。采用CERVUS v 3.0.4[16]計(jì)算位點(diǎn)多態(tài)性信息含量(PIC)。
2 結(jié)果與分析
2.1 基因組特征分析
基于illumina HiSeqTM2500平臺測序共生成94.52 Gb高質(zhì)量數(shù)據(jù),覆蓋度約為基因組的137倍。測序質(zhì)量值Q20和Q30分別為96.24%和90.23%,表明測序質(zhì)量良好,可用于后續(xù)分析。使用SOAPdenovo軟件進(jìn)行組裝和拼接,選擇K-mer為17,初步組裝基因組,共獲得463 258個Scaffold,Scaffold N50長度約為2 381 bp(表2)。將所有高質(zhì)量數(shù)據(jù)用于K-mer分析,K-mer分布曲線結(jié)果顯示:K-mer期望深度(主峰)對應(yīng)的測序深度為126×,GenomeScope估計(jì)基因組約為706.92 Mb,基因組雜合度為1.26%,重復(fù)序列比率為55.74%,平均GC含量為34.11%。
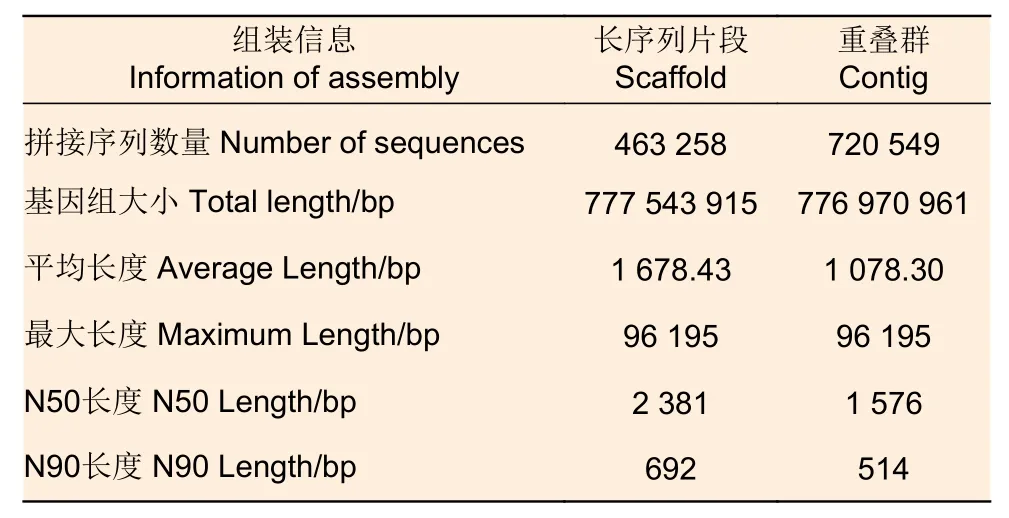
表2 刀狀黑黃檀基因組組裝信息Table 2 Information of the assembled genome sequences of D.cultrata
2.2 SSR標(biāo)記類型
利用MISA進(jìn)行SSR候選位點(diǎn)檢索,從463 258個Scaffold中總共鑒定出142 891個SSR標(biāo)記(表3),其中,二核苷酸(Di-)位點(diǎn)數(shù)量最多,占總數(shù)的61.21%,主要重復(fù)類型為AT/AT,占54.75%;三核苷酸(Tri-)次之(24.88%),主要類型為AAT/ATT,占54.23%;四核苷酸(Tetra-)占比為7.45%,主要類型為AAAT/ATTT,占比為68.11%;五核苷酸(Penta-)占比為1.11%,主要類型為AAAAT/ATTTT。
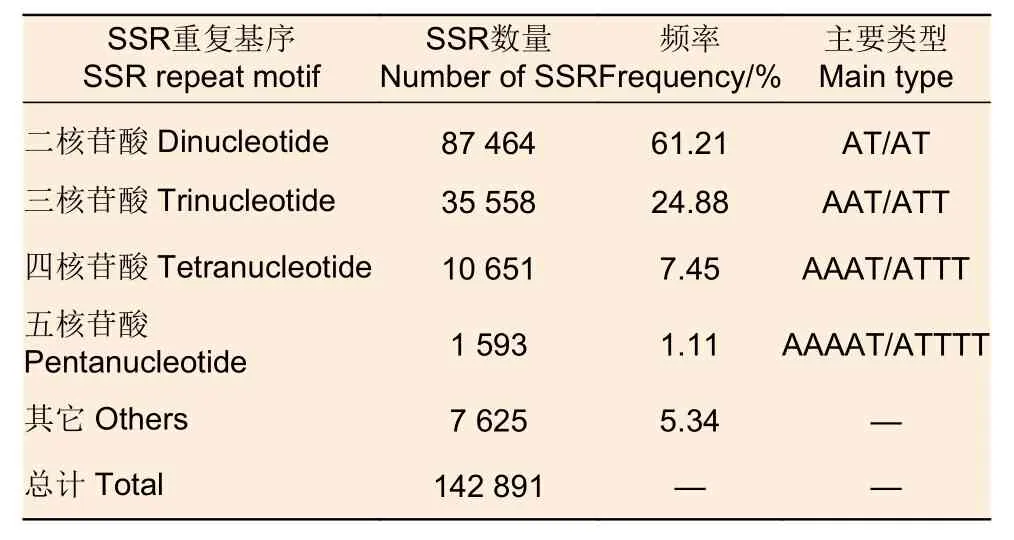
表3 刀狀黑黃檀的基因組 SSR 分布特征Table 3 Characteristic and distribution of SSR in D.cultrata genome
2.3 SSR篩選與有效性驗(yàn)證
瓊脂糖凝膠電泳初篩結(jié)果顯示:128對引物具有清晰穩(wěn)定的擴(kuò)增條帶,占檢測引物比例為42.67%;經(jīng)過8.00%非變性聚丙烯酰胺凝膠復(fù)篩檢測,最終共篩選了27對擴(kuò)增穩(wěn)定,條帶清晰明亮,多態(tài)性良好的引物,約占檢測引物總數(shù)的9.00%,引物詳細(xì)信息見表4。
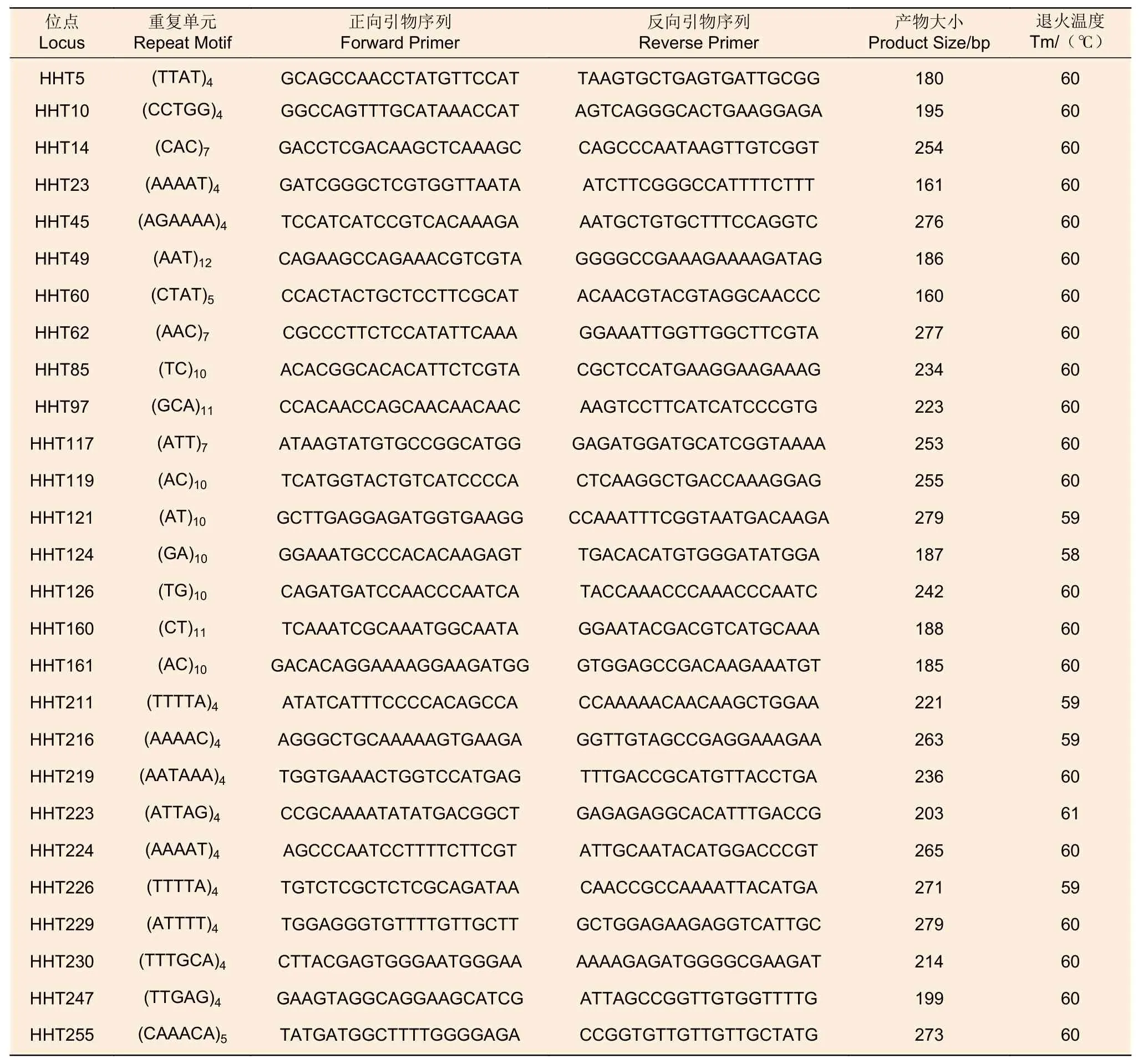
表4 刀狀黑黃檀27個SSR位點(diǎn)的側(cè)翼引物信息Table 4 Characteristics of flanking primers of 27 SSR markers developed for D.cultrata
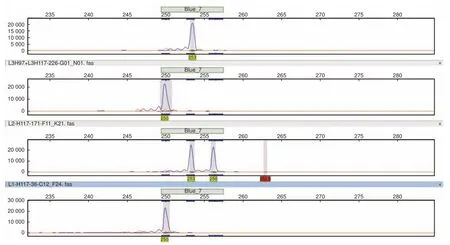
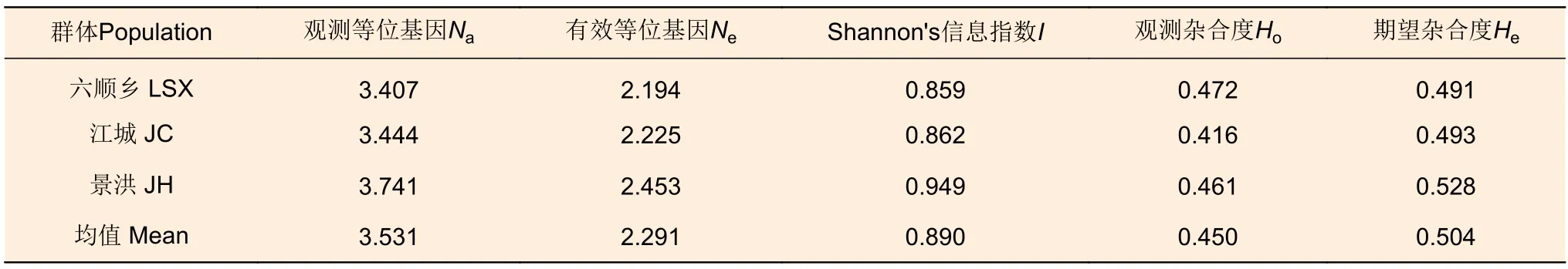
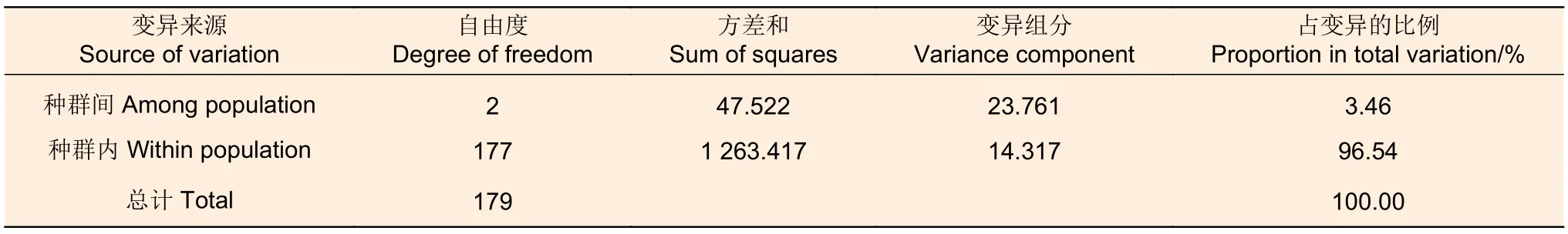
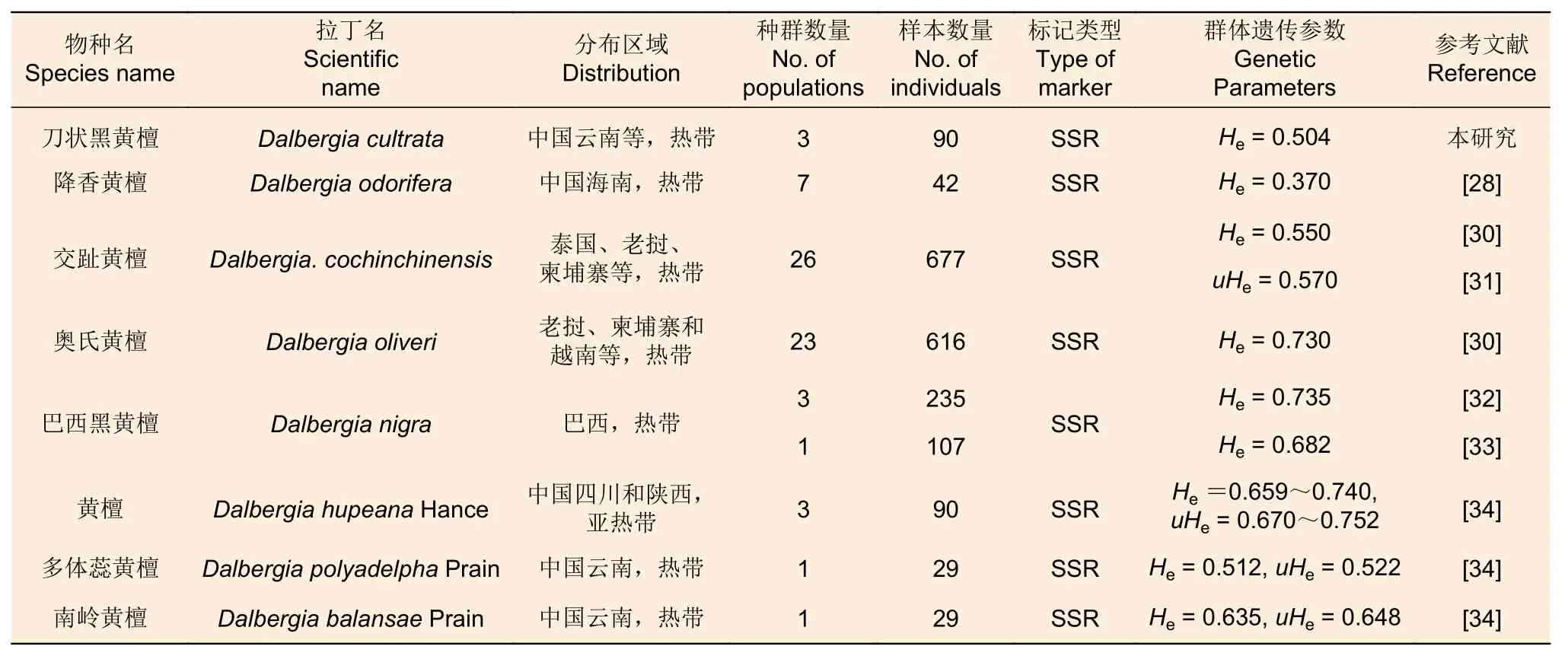
利用篩選后具有多態(tài)性的SSR位點(diǎn)對3個種群的90個刀狀黑黃檀個體進(jìn)行SSR基因分型(圖1)。檢測結(jié)果顯示:在27個SSR位點(diǎn)上共檢測到117個等位基因,觀測等位基因數(shù)(Na)最少為2個,最多為10個,均值為4.333;有效等位基因數(shù)(Ne)最少為1.193,最多為5.757,均值為2.397。位點(diǎn)水平的觀測雜合度(Ho)最小值為0.111(HHT226),最大值為0.833(HHT119),均值為0.451;期望雜合度(He)最小值為0.162(HHT226),最大值為0.826(HHT121),均值為0.523。多態(tài)性信息含量(PIC)最小值為0.149(HHT226),最大值為0.803(HHT121),均值為0.463,其中,11個位點(diǎn)具有高多態(tài)性(PIC>0.5),13個位點(diǎn)具有中等多態(tài)性(0.25 表5 27個SSR位點(diǎn)多態(tài)性信息Table 5 Characterization of locus-level polymorphic information at 27 SSR loci 圖1 部分 SSR 位點(diǎn)毛細(xì)管電泳檢測結(jié)果Fig.1 Fluorescence capillary electrophoresis test results of part of SSR loci 在3個野生種群中檢驗(yàn)了27個SSR位點(diǎn)在群體遺傳分析中有效性與適用性,結(jié)果(表6)顯示:在六順鄉(xiāng)(LSX)、江城(JC)以及景洪(JH)種群中,觀測等位基因(Na)數(shù)量分別為3.407、3.444、3.741;有效等位基因(Ne)數(shù)量分別為2.194、2.225、2.453。在3個種群中,具有中高度多態(tài)性的SSR位點(diǎn)分別占比85.19%(LSX)、88.89%(JC)、85.19%(JH)。種群水平的期望雜合度(He)分別為0.491(LSX)、0.493(JC)、0.528(JH),均值為0.504;觀測雜合度(Ho)分別為0.472(LSX)、0.416(JC)、0.461(JH),均值為0.450,結(jié)果表明3個刀狀黑黃檀野生種群具有中等的遺傳多樣性。 表6 3個刀狀黑黃檀野生種群遺傳多樣性Table 6 Genetic diversity of 3 wild populations of D.cultrata in China FST值可用于評價種群間遺傳分化程度,3個種群之間的遺傳分化系數(shù)(FST)為0.002~0.115,平均值為0.034(表5)。AMOVA分析結(jié)果顯示:刀狀黑黃檀種群內(nèi)遺傳變異和種群間遺傳變異分別為96.54%和3.46%,這表明刀狀黑黃檀遺傳變異主要來源于種群內(nèi)(表7)。 表7 刀狀黑黃檀種群間和種群內(nèi) AMOVA 分析Table 7 AMOVA analysis among and within D.cultrata populations 自Galbraith等[17]利用流式細(xì)胞術(shù)測定植物細(xì)胞核DNA含量以來,流式細(xì)胞術(shù)成為了測定植物基因組大小的標(biāo)準(zhǔn)方法。隨著高通量測序技術(shù)的發(fā)展,基于K-mer分析的生物信息學(xué)估計(jì)基因組特征方法的出現(xiàn),對于探索未知基因組物種提供了極大幫助,已經(jīng)廣泛應(yīng)用于植物基因組大小評估和特征分析[18],并且K-mer分析相較于流式細(xì)胞術(shù)分析法的預(yù)測結(jié)果可信度更高、信息更豐富。以往普遍認(rèn)為黃檀屬植物的基因組可能比較大,在DNAC值數(shù)據(jù)庫中黃檀屬植物基因組(1C)大小范圍為1 430~1 928 Mb,平均值為1 729 Mb[19]。然而,在本研究中,基于K-mer分析結(jié)果估計(jì)刀狀黑黃檀的基因組大小約為706.92 Mb,基因組雜合度為1.26%,重復(fù)序列比率為55.74%。這一結(jié)果表明,其基因組屬于高雜合、高重復(fù)的復(fù)雜基因組,基因組大小略高于降香黃檀(Dalbergia odorifera T.Chen)的653.45 Mb[20],這可能是由于物種差異以及較高的基因組雜合度等因素共同導(dǎo)致的[21]。刀狀黑黃檀的基因組高雜合性可能與該物種復(fù)雜的分化過程有關(guān),Vatanparast等[22]基于分子證據(jù)認(rèn)為,黃檀屬起源于南美洲,但其只用了ITS片段,結(jié)果缺乏有力支撐;崔菲等[23]利用核基因和葉綠體片段構(gòu)建了系統(tǒng)發(fā)育樹,但基部類群也并未明確,暫未確定黃檀屬的明確起源地區(qū)與分化趨勢。然而,從基因組水平來解讀物種系統(tǒng)演化的過程將是未來植物分類與系統(tǒng)進(jìn)化研究發(fā)展的趨勢。因此,對于刀狀黑黃檀基因組特征初步分析和評價有利于制定合適的基因組精細(xì)組裝策略,選用最新的三代Pacbio測序平臺HiFi模式測序可能對于解決高雜合度在基因組組裝時所產(chǎn)生的不利影響具有較大幫助,結(jié)合Hi-C技術(shù)和三代測序平臺的全長轉(zhuǎn)錄組分析,將有助于基因組染色體水平的組裝并獲得更加精確的基因組注釋信息。 SSR分子標(biāo)記是保護(hù)遺傳學(xué)中最常用的DNA標(biāo)記之一,與RFLP、AFLP和RAPD相比,SSR標(biāo)記具有信息豐富、易于判定、穩(wěn)定和共顯性的特點(diǎn)[24]。以往研究也發(fā)現(xiàn),在遺傳分析方面,基因組SSR相比于EST-SSR以及SNP具有更高的多態(tài)性[25]。刀狀黑黃檀基因組包含了大量的SSR分子標(biāo)記位點(diǎn),平均5 442 bp存在1個,且重復(fù)類型豐富,變異基序多樣,以雙、三核苷酸重復(fù)基序的占比較高。以往研究認(rèn)為,重復(fù)單元長度變化與選擇壓力有關(guān),重復(fù)單元長度越長,所受的選擇壓力越大,拷貝數(shù)就越少,因此,基因組中長度較短的微衛(wèi)星變異速率較快,而較長的重復(fù)單元變異速率較慢,所以,基因組中低級重復(fù)單元較多則表示該物種進(jìn)化水平較高,而高級重復(fù)單元比例高的物種其進(jìn)化時間短或變異頻率較低[26-27]。 本研究基于NGS測序和初步組裝數(shù)據(jù)發(fā)掘了刀狀黑黃檀基因組SSR候選位點(diǎn),并結(jié)合實(shí)驗(yàn)室篩選,驗(yàn)證了27個多態(tài)性較好,擴(kuò)增穩(wěn)定的SSR位點(diǎn)。位點(diǎn)水平的觀測等位基因數(shù)量(Na)變異范圍為2~10個,均值為4.333,這也表明篩選驗(yàn)證的位點(diǎn)具有較好的等位基因變異,其中,超過80%以上的SSR位點(diǎn)具有中高度的多態(tài)性信息含量。研究發(fā)現(xiàn),27個SSR位點(diǎn)中僅有8個位點(diǎn)符合哈溫平衡,類似的狀況在生態(tài)位較為接近的降香黃檀種群中也有所體現(xiàn),同樣具有一定比率的SSR位點(diǎn)不符合哈溫平衡[28]。符合哈溫平衡需要滿足隨機(jī)交配且足夠大的種群數(shù)量,而在資源調(diào)查中發(fā)現(xiàn),刀狀黑黃檀的野生種群均為零星分布,且遭遇了嚴(yán)重的生境片段化,幾乎沒有連續(xù)分布的刀狀黑黃檀純林[4],因此,種群有效個體數(shù)量偏低,非隨機(jī)交配等因素可能是造成SSR標(biāo)記位點(diǎn)偏離哈溫平衡的主要原因。 以3個野生種群為對象,對刀狀黑黃檀遺傳多樣性進(jìn)行了初步分析與評價,結(jié)果顯示3個種群的期望雜合度(He)均值為0.504,明顯低于異交植物的平均值0.65[29],通過與其他黃檀屬內(nèi)植物遺傳多樣性比較發(fā)現(xiàn)(表8),3個刀狀黑黃檀野生種群的期望雜合度明顯高于海南分布的降香黃檀(He=0.370)[28],但低于泰國、老撾等地分布的交趾黃檀(Dalbergia cochinchinensis Pierre)(He=0.550 & uHe=0.570)以及柬埔寨和越南等地分布的奧氏黃檀(Dalbergia oliveri Gamble ex Prain)(He=0.730)[30-31]和南美洲巴西熱帶地區(qū)分布的巴西黑黃檀(Dalbergia nigra (Vell.) Benth.)(He=0.735 & He=0.682)[32-33]。比較結(jié)果表明:中國野生分布的刀狀黑黃檀種群遺傳多樣性處于較低的水平,這也暗示中國分布的刀狀黑黃檀野生資源遭受了明顯的遺傳侵蝕,這可能是由于過去的過度砍伐與土地利用轉(zhuǎn)變等因素造成的。在IUCN紅色名錄中,交趾黃檀(VU,A1cd)和降香黃檀(VU,A1d)瀕危等級都高于刀狀黑黃檀(NT級別),在中國受威脅高等植物名錄中,刀狀黑黃檀被列為VU級,從野生種群遺傳多樣性水平角度而言,本研究結(jié)果也支持將刀狀黑黃檀的瀕危等級提高到與交趾黃檀和降香黃檀相同的級別。盡管刀狀黑黃檀已經(jīng)被列入國家二級保護(hù)植物,但在野外調(diào)查研究中發(fā)現(xiàn),土地利用轉(zhuǎn)變導(dǎo)致的生境片段化也可能影響其野生種群的穩(wěn)定性及限制種群間的基因交流與種群內(nèi)的繁殖更新[3]。因此,今后的工作應(yīng)將全面深入開展遺傳多樣性評估、繁殖生物學(xué)及景觀遺傳學(xué)等方面的研究作為重點(diǎn)方向,用于制定科學(xué)合理的資源保護(hù)與種群恢復(fù)策略。 表8 黃檀屬不同物種遺傳多樣性比較Table 8 Comparative analysis of genetic diversity in Dalbergia genus 本研究利用NGS技術(shù)對刀狀黑黃檀基因組特征進(jìn)行了分析,結(jié)果表明,其基因組大小約為706.92 Mb,雜合度為1.26%,屬于高雜合的復(fù)雜基因組,提出了基于PacBio三代測序和Hi-C輔助組裝的精細(xì)測序組裝策略。通過實(shí)驗(yàn)發(fā)掘并驗(yàn)證了27個擴(kuò)增條帶清晰、多態(tài)性良好的SSR位點(diǎn),并初步評估了3個野生刀狀黑黃檀種群的遺傳多樣性,結(jié)果表明其具有中等水平的遺傳多樣性和較低的遺傳分化程度。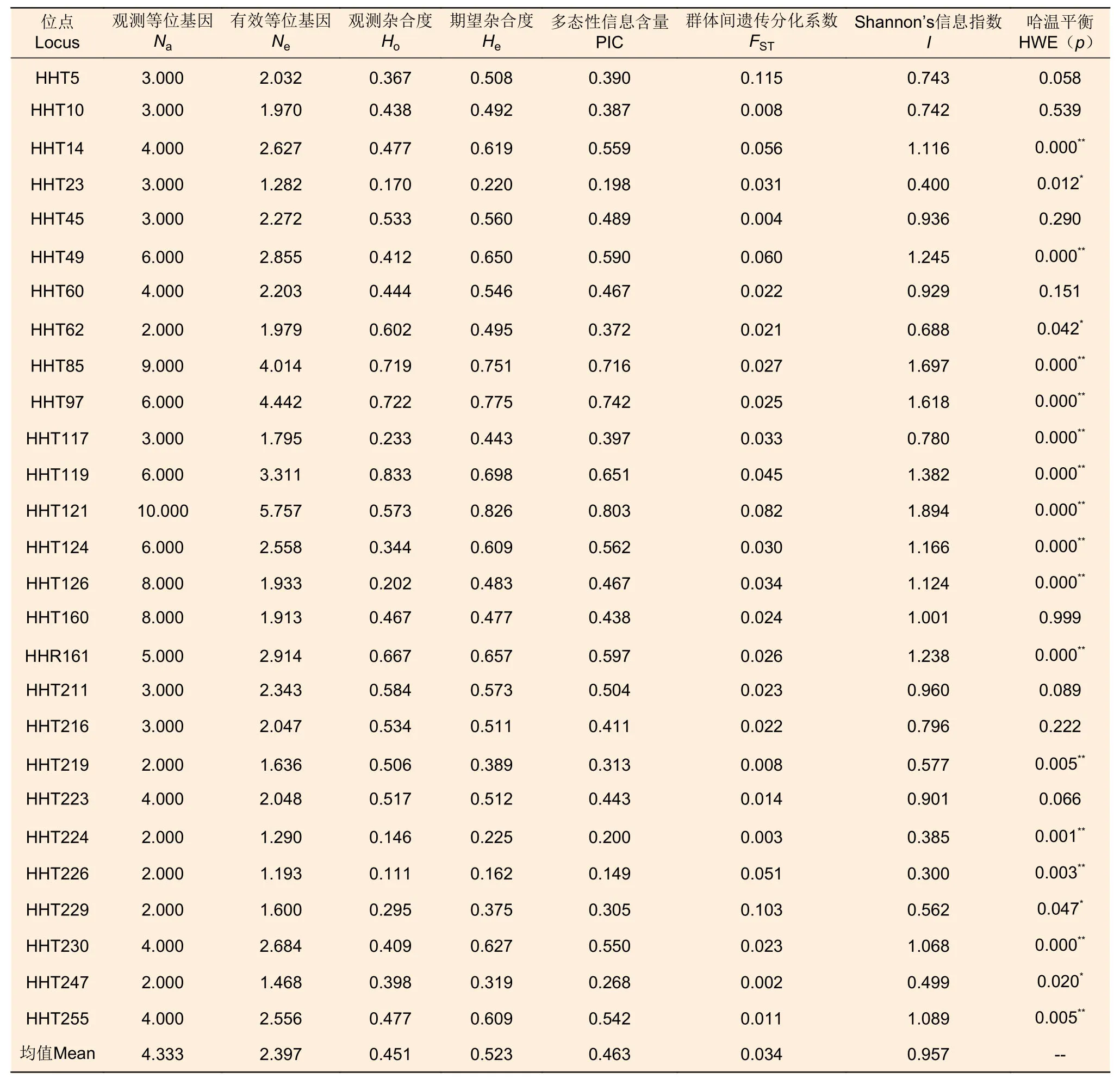
2.4 遺傳多樣性分析評價
3 討論
3.1 基因組特征與精細(xì)組裝策略
3.2 基因組SSR標(biāo)記特征
3.3 多態(tài)性SSR驗(yàn)證與多樣性評價
3.4 黃檀屬重要樹種遺傳多樣性比較
4 結(jié)論

