模擬高原環境對小鼠腸道微生物菌群的影響*
仝永娟 束 華 馬 剛 楊 斌 劉鵬飛 李 莎 丁國羽
(首都醫科大學附屬北京世紀壇醫院實驗動物中心,北京 100038)
腸道微生物菌群對維持生物體的健康起著重要作用[1]。2013年,Zackular等[2]研究發現,腸道微生物菌群不但與傳統認知的營養不良、腸炎、腸應激等腸道疾病相關,與肥胖、糖尿病、心腦血管疾病、自身免疫性疾病等也具有一定的相關性。因此,腸道微生物菌群的變化與多種疾病發生及治療的關系,也成為近些年來研究的熱點,如腸道微生物菌群與阿茲海默病的相關性[3]及腸道微生物移植對治療胃腸道炎癥等疾病的作用[4]。更為重要的是,腸道微生物構建了腸腦間的雙向通訊體系[5-8]。一方面,腸道微生物可以通過“微生物-腸-腦”軸影響宿主行為[5];另一方面,宿主行為上的變化也能影響腸道微生物菌群的組成[6-8]。目前,盡管較多的研究集中于在多種因素的宿主行為影響下(如飲食、藥物等)腸道微生物菌群的變化。然而,有關宿主本身所在環境的變化引起腸道微生物菌群改變的研究仍然缺乏。有研究推測,環境對腸道微生物菌群的影響甚至超過了遺傳基因對腸道微生物菌群的影響[9-10]。因此,開展環境變化對腸道微生物菌群影響的研究非常必要。
我國是世界上高原環境最大的國家,高海拔環境下氧分壓降低可造成機體各組織器官缺氧而產生高原反應,從而引發各類疾病[11-15]。然而,低壓低氧條件(模擬高原環境)下腸道微生物菌群改變的相關研究還不夠充分。因此,本研究擬通過16 s rDNA高通量測序,對模擬高原環境下SPF小鼠腸道微生物菌群的變化進行分析,明確與低壓低氧條件相關的關鍵細菌,以期為研究和今后治療高原疾病提供一定的理論支持和數據支撐。
1 材料和方法
1.1 實驗動物
選用體質量均勻的6周齡SPF級雄性C57BL/6N 小鼠12 只,實驗小鼠購自北京維通利華實驗動物技術有限公司【SCXK(京)2016-0006】,飼養于首都醫科大學附屬北京世紀壇醫院屏障實驗室【SYXK (京) 2017-0025】,溫度 20~26 ℃ ,相對濕度40%~70%,光照同期12 h/12 h。實驗過程中按實驗動物使用的3R原則給予人道關懷,按照首都醫科大學附屬北京世紀壇醫院科研倫理委員會的相關規定進行實驗,倫理委員會審批號:sjtkyll-lx-2021(23)。
1.2 試劑與儀器
PCR:Phusion High-Fidelity PCR Master Mix with GC Buffer和高效高保真酶(New England Biolabs);建庫試劑盒:TruSeq DNA PCR-Free Sample Preparation Kit(TruSeq);膠回收試劑盒:GeneJET(Thermo Scientific);測序儀:hiseq 2500(Illumina)。
1.3 實驗分組
實驗小鼠隨機分為兩組:常壓常氧組為對照組,低壓低氧組為實驗組,每組6只。其中,常壓常氧組飼養于高原環境模擬艙外,即為北京平原地區海拔 20~60 m處,低壓低氧組飼養于高原環境模擬艙內,為模擬海拔5 000 m的低壓低氧高原環境。
1.4 高原環境模擬艙參數
實驗使用的DF800多功能高原環境模擬艙由濰坊華信氧業公司生產,設備容積為0.6 m3,高原環境模擬艙設置為(5 000±10)m。
1.5 實驗方法
1.5.1小鼠腸道微生物的采集:實驗周期28 d結束后,采集小鼠糞便樣品,取樣后放入凍存管內后迅速冷凍儲存于-80 ℃冰箱。
1.5.2小鼠腸道微生物的擴增:采用SDS(Sodium dodecyl sulfate)方法對小鼠腸道糞便微生物進行DNA提取,提取后使用無菌水稀釋至1 ng/μL作為模板,擴增引物為515F:GTGCCAGCMGCC GCGGTAA;806R:GGACTACHVGGGTWTCTAAT,2%瓊脂糖凝膠電泳得到目的條帶,選擇400~450 bp之間的序列,割膠回收,使用Thermo Scientific的GeneJET 膠回收試劑盒進行產物純化,使用TruSeq DNA PCR-Free Library Preparation Kit 建庫試劑盒構建文庫。
1.5.316 s rDNA高通量測序:用小鼠腸道微生物構建的文庫進行測序分析,采用Illumina HiSeq測序平臺雙末端HiSeq PE250深度測序,再進行相關分析。為了研究樣品的物種組成多樣性,對所有樣品的Effective Tag進行聚類,以97%的一致性(identity)將序列聚類成為OTU(operational taxonomic units),然后對OTU的代表序列進行物種注釋。
2 結果
2.1 小鼠腸道微生物的擴增
基因序列擴增結果如圖1所示,得到清晰的目的條帶,其中條帶1~6為常壓常氧組,條帶7~12為低壓低氧組,所得產物清晰明亮,用于下一步測序。
圖1 16s rDNA 基因序列擴增結果Fig.1 PCR result of 16s rDNA
2.2 16 s rDNA測序分析
2.2.1樣本及宏基因組測序:對12個樣本的OTU聚類和注釋結果進行分析,結果如表1所示。由表1可知,各組樣本用于OTU聚類等后續分析的平均有效數據分別為75 257條和75 568條,而用于構建OTU并且獲得注釋信息的平均有效序列數為72 055和73 066。
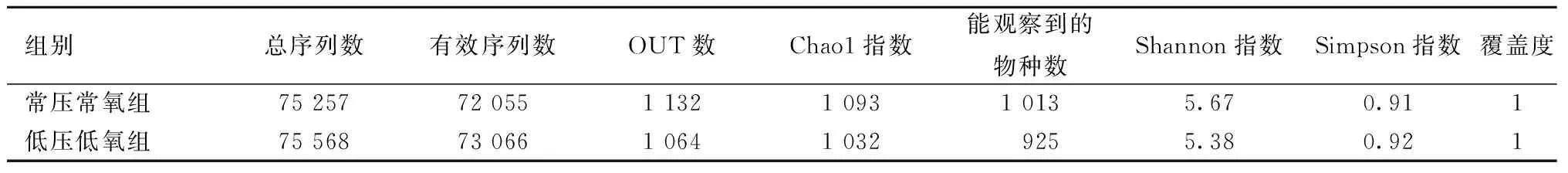
表1 樣本信息和Alpha多樣性統計Table 1 The sample information and statistical results of Alpha diversity
為了進一步明確測序數據量是否能充分反映低壓低氧環境下小鼠腸道微生物菌群的真實情況,隨機抽取了不同梯度的測序數據量,構建了物種稀釋曲線,結果如圖2顯示。由圖2可知,按組分析的稀釋曲線均隨著測序數量的增加趨向平坦,表明測序數據量合理。在此條件下,根據不同OTU數在不同標本中的豐度繪制的等級豐度曲線表明:隨著OTU數相對豐度的增加趨于平滑,物種分布趨于均勻。
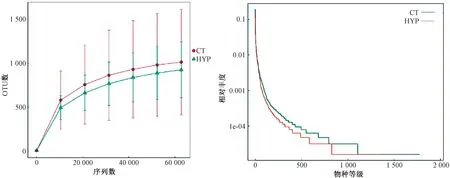
圖2 高通量測序的物種多樣性曲線Fig.2 The rarefaction curve and rank abundance of the high-through sequencing result
2.2.2樣品菌落多樣性差異性分析:為了分析不同組別各樣品的菌落差異性和相似性,對樣品進行基于Weighted unifrac距離的PCoA分析。樣品距離越接近,物種組成結構越相似(圖3)。如圖3所示,常壓常氧組和低壓低氧組各自傾向于聚集在一起,兩組之間則遠遠分開,使用組間群落結構差異顯著性檢驗Anosim分析結果顯示P=0.022<0.05,表示差異顯著,印證了PCoA分析的組間對比差異顯著。
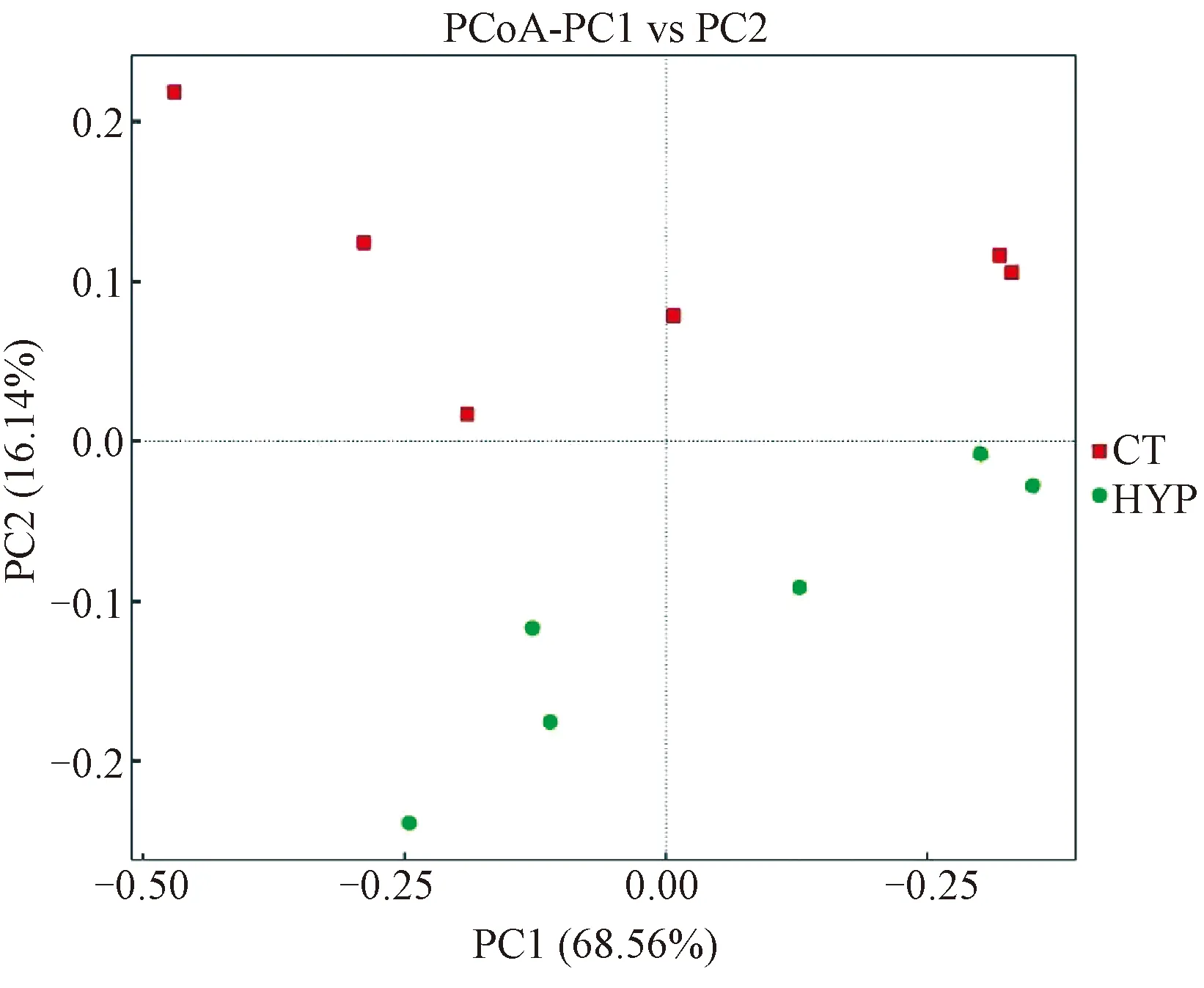
圖3 基于Weighted Unifrac距離的PCoA分析Fig.3 The PCoA analysis based on weighted unifrac distance
2.2.3常壓常氧組和低壓低氧組物種相對豐度分析:為了比較常壓常氧組和低壓低氧組物種差異,首先根據物種注釋結果,選取每個樣品或分組在門級水平物種相對豐度前10名的物種。這些物種的頻率分布柱形圖如圖4所示。由圖4可知,常壓常氧組和低壓低氧組在門級水平上豐度靠前的幾種微生物分別隸屬于擬桿菌門(Bacteroidetes)、厚壁菌門(Firmicutes)、疣微菌門(Verrucomicrobia)、變形菌門(Proteobacteria)等,但所占比例有所差別。其中,Verrucomicrobia在組間所占比例差別最明顯。為了直接反映不同組別各樣品之間物種豐度的差異,將豐度排名前35的屬進行聚類分析,繪制熱圖,找出低壓低氧組和常壓常氧組的主要差異屬,結果如圖5所示。由圖5可知,低壓低氧組的含量較高的屬為瘤胃球菌屬(Ruminococcus)、腸球菌屬(Enterococcus)、阿克蔓菌屬(Akkermansia)、普雷沃氏菌UCG-001屬(PrevotellaceaeUCG-001)、擬桿菌屬(Bacteroides)、另枝菌屬(Alistipes)、狄氏副擬桿菌(Parabacteroides)等。常壓常氧組含量較高的屬則主要為乳桿菌屬(Lactobacillus)、別樣菌屬(Allobaculum)、瘤胃梭菌屬(Ruminiclostridium)、羅斯氏菌屬(Roseburia)等。
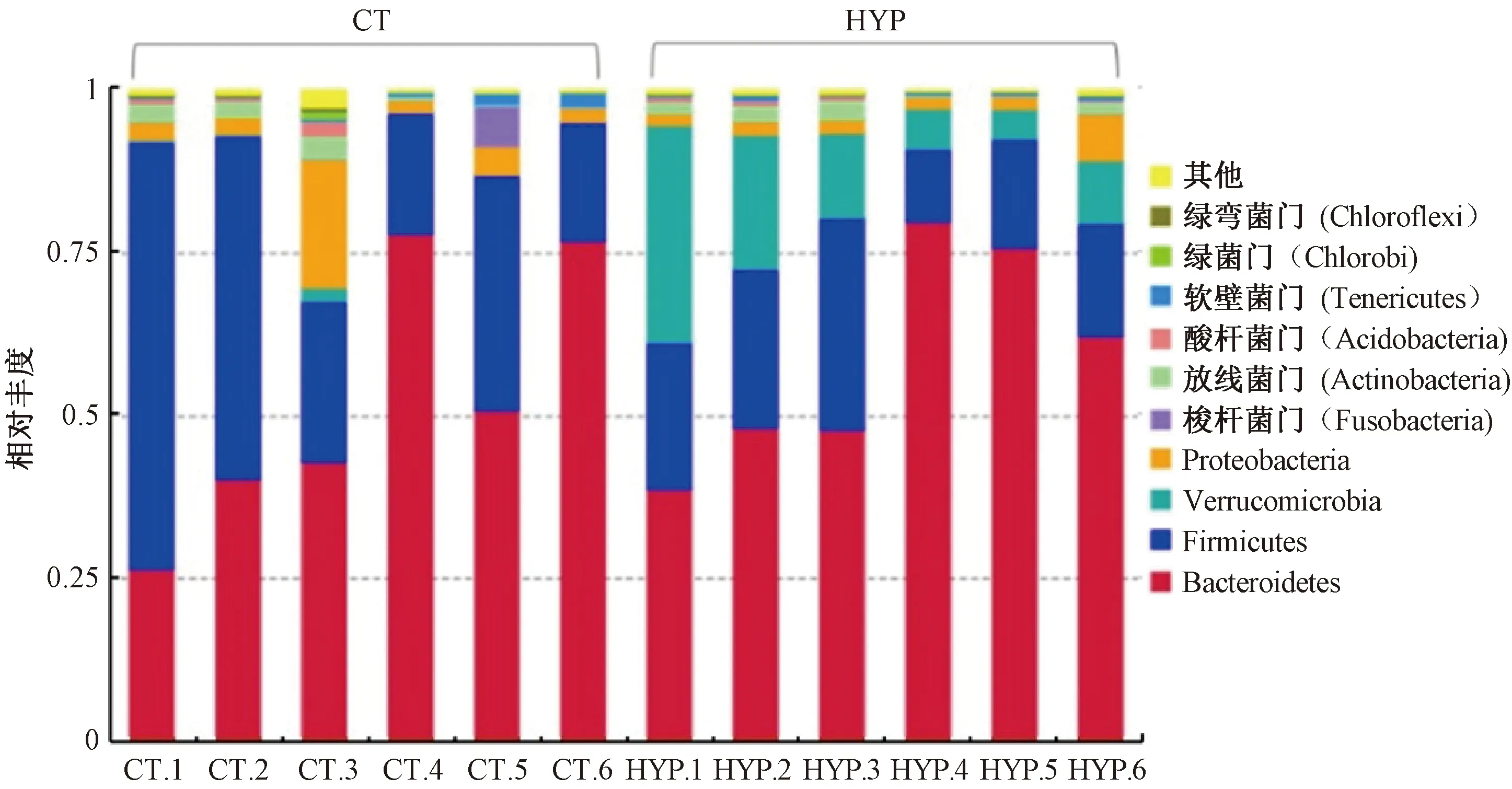
圖4 常壓常氧與低壓低氧條件下腸道微生物在門級水平相對豐度Fig.4 The intestinal microbial flora abundance analysis on phylum level
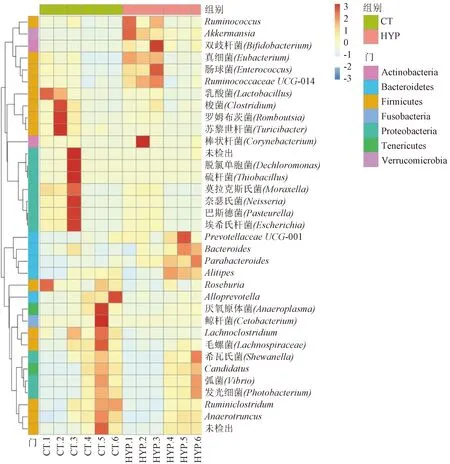
圖5 常壓常氧與低壓低氧條件下腸道微生物的物種豐度聚類熱圖Fig.5 The heatmap of intestinal microflora
2.2.4低壓低氧組特有物種分析:進行LEfSe分析以尋找組間差異顯著的物種,結果如圖6所示。由圖6可知,柱狀圖顯示低壓低氧組在屬水平上顯著增多的菌是Akkermansia,柱狀圖和進化分支圖均顯示在低壓低氧組中起到重要作用的菌是:疣微菌目(Verrucomicrobiales)的疣微菌科(Verrucomicrobiaceae)。
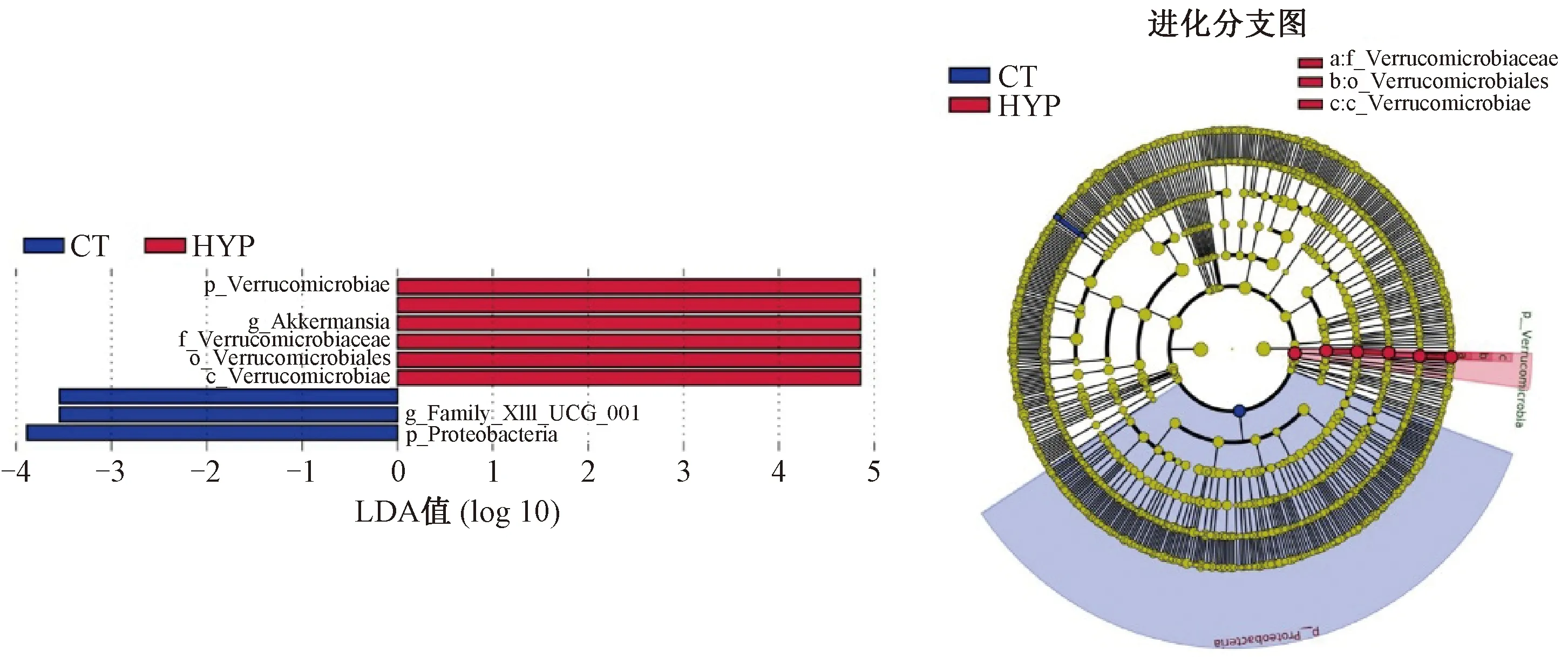
圖6 LDA值分布柱狀圖和進化分支圖Fig.6 The histogram and cladogram of LDA
物種系統樹結果如圖7所示,低壓低氧組百分比含量較高的為Bacteroidetes和Verrucomicrobia;常壓常氧組百分比含量較高的為Firmicutes和Proteobacteria等。其中低壓低氧組特有的菌為隸屬于Verrucomicrobia的Akkermansia,占總含量的20.60%。
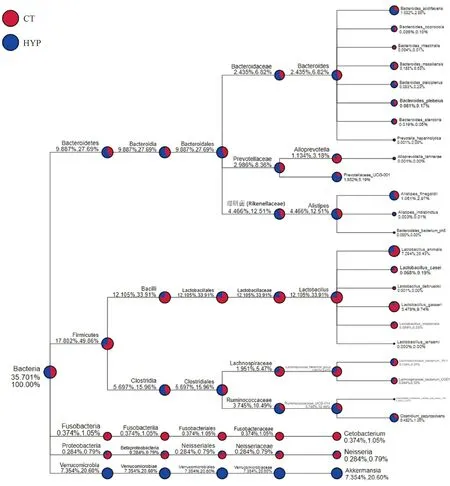
圖7 常壓常氧與低壓低氧條件下腸道微生物的樹狀圖Fig.7 The phylogenetic tree of normal and hypobaric hypoxic environment in intestinal microflora
3 討論
隨著研究的不斷深入,微生物與人類的關系也逐漸被人們所重視。微生物定植于生物體的組織和器官,如:皮膚、胃腸道、呼吸系統、泌尿系統等,不僅在日常生活中潛移默化的影響人類,更是與疾病和健康有著不可分割的關系。有研究將人類的腸道微生物菌群視為一個器官,指出一個成人的腸道微生物菌群由1013~1014種微生物組成,并且在新陳代謝、免疫系統發育和抵御外來病原體的入侵等方面有很重要的作用[1]。
高原地區因環境氣候條件與平原地區不同而影響腸道微生物菌群的變化。Wu等[16]通過對處于不同海拔地區的恒河猴腸道微生物菌群進行測序分析和比較,發現高海拔地區恒河猴腸道微生物主要以Firmicutes(63.4%)和Verrucomicrobiaceae為主,而低海拔地區以Bacteroidetes(47.4%)和普雷沃氏菌Prevotellaceae為主,這種不同被認為與環境溫度以及氧氣壓力的不同有很大的關系。本研究通過對模擬低壓低氧的高原環境和普通環境下的小鼠腸道微生物菌群測序的LEfSe分析,結果發現高海拔地區的Verrucomicrobiaceae顯著增多,這與上述報道結果一致。有報道在不同海拔地區藏羚羊、藏野驢、普通綿羊等物種腸道微生物菌群的研究中發現高海拔地區物種腸道微生物的優勢菌群為Ruminiclostridium(22.78%)、Oscillospira(20.00%)和Clostridium(10.00%),高海拔地區物種腸道微生物的Firmicutes所占比例比Bacteroidetes更大[17]。本研究中,屬級水平上,低壓低氧組Ruminococcus的含量較高,而常壓常氧組Lactobacillus、Allobaculum、Ruminiclostridium、Roseburia等含量較高;門級水平上,低壓低氧組百分比含量較高的為Bacteroidetes和Verrucomicrobia,而常壓常氧組百分比含量較高的為Firmicutes、Proteobacteria等。本研究與Ma等[17]報道存在差異,可能與除海拔外的其他因素,如研究對象及其飲食生活習性等不同有關。
進入高原環境一段時間后,腸道微生物菌群也開始逐漸適應高原環境,Karl等[18]對高海拔地區人群以及高原反應人群腸道微生物采集分析發現,Prevotellaceae豐度的改變與高原反應的相關性很大,提示該菌的變化有利于人類對高原環境的適應。本研究發現低壓低氧組的腸道微生物菌群中PrevotellaceaeUCG-001含量高于常壓常氧組,說明小鼠進入低壓低氧艙28 d后,逐漸開始適應環境。有研究顯示,Ruminococcus通過腸道微生物與腦的聯系而影響腦N-乙酰門冬氨酸(NAA)含量[19],從而影響大腦神經的發育,而本研究結果顯示,模擬高原環境組小鼠腸道微生物中的Ruminococcus含量與常壓常氧組相比有所升高,提示低壓低氧環境可能會增加此類疾病的患病風險。而有報道稱狄氏副擬桿菌(Parabacteroidesdistasonis)與肥胖負相關[20],也有研究通過對肥胖和超重人群補充阿克曼菌(A.muciniphila)后發現提高了胰島素敏感性,減少了胰島素血癥和血漿總膽固醇,降低了體質量、脂肪量和臀圍[21]。本研究發現,低壓低氧會使Parabacteroides含量增高,這與作者早期的研究結果一致,低壓低氧使小鼠體質量增長減慢[12],這可能與低壓低氧環境下腸道微生物菌群中Parabacteroides含量增高有關。有研究發現添加阿克曼菌(A.muciniphila)能夠保護由葡聚糖硫酸鈉(DSS)誘導的小鼠結腸炎,使腸炎小鼠血清和組織的炎癥細胞因子和趨化因子降低[22],其不但對機體的免疫應答有一定的調節作用,還具有維持機體代謝平衡的作用,能夠改善肥胖,減少糖尿病患者的炎癥反應。本研究通過LEfSe分析顯示,在屬級水平上, 低壓低氧組Akkermansia顯著增多,高原環境下氧分壓較小,從而使進入肺部的氧氣減少,造成機體各組織器官的缺氧,進而使機體的炎性因子含量增高[23],而這可能是導致腸道微生物菌群中Akkermansia顯著增多的原因,而該菌與肥胖的關系可能是小鼠在低壓低氧環境中體質量增長減慢的原因。
本研究在控制其他變量對腸道微生物菌群影響的情況下,對模擬高原環境和普通環境下,小鼠腸道微生物菌群的組成及差異進行了檢測和分析,對研究高原環境下腸道微生物菌群的變化有一定的指導意義,為臨床上研究和治療高原疾病提供了新的思路和一定的理論支持。基于以上研究,將進一步探索不同海拔高原環境對人體腸道微生物菌群變化的影響規律,以更科學的支持臨床研究和高原疾病診治。

