腎癌中細胞自噬的作用及自噬調節劑在腎癌治療中的研究進展
施聲淦,蔣培都
腎癌是泌尿系統常見的惡性腫瘤,在所有惡性腫瘤中約占3%[1]。腎癌可以分為以下三個主要類型,即腎透明細胞癌(clear cell renal cell carcinoma, ccRCC)、乳頭狀腎細胞癌(papillary renal cell carcinoma, pRCC)、嫌色細胞腎細胞癌(chromophobe renal cell carcinoma, chRCC)[2]。ccRCC作為腎癌的主要亞型,具有巢狀緊密生長并伴有復雜的樹狀血管及惡性程度高等特點,該文主要圍繞ccRCC進行闡述。近年來,全球腎癌的發病率呈現逐年增高的趨勢。2018年全球新增腎癌確診病例40萬人[1]。2015年我國腎癌的發病率約為6.9/100萬,病死率約為2.3/100萬,男女比為2∶1[3]。由于放、化療對腎癌的治療效果不佳,目前最有效的治療方法為手術治療[4]。然而,腎癌患者的術后5年生存率因確診時腫瘤分期分級的不同而差異較大,為20%~95%,復發率則高達30%[5]。因此,進一步深入研究腎癌的發病機制,尋找潛在的敏感靶點是治療腎癌的根本方法。本文著重討論自噬在腎癌進展中的作用,期望為腎癌患者提供安全且有效的新型治療策略。
1 細胞自噬
1.1 細胞自噬的概念及體內發生過程細胞自噬(autophagy)是細胞將自身的一些衰老細胞器、錯誤折疊蛋白等包裹于自噬體中,通過與溶酶體形成自噬溶酶體來降解這些“貨物”,從而維持細胞穩態的一種保守過程[6]。自噬通常分為3種:微自噬(microautophagy)、巨自噬(macroautophagy)和分子伴侶介導的自噬(chaperone-mediated autophagy, CMA)[7]。自噬的發生伴有多種自噬相關基因(autophagy-related genes, ATG)的參與,分為啟動階段、自噬體形成階段、自噬體與溶酶體融合階段和物質降解與再利用階段(圖1)。自噬起始階段,在unc-51樣激酶1復合物(unc-51 like kinase 1 complex, ULK1C)的幫助下,磷脂酰肌醇-3-磷酸(phosphatidylinositol-3-phosphate, PI3P)將雙FYVE結構蛋白1(double FYVE-containing protein 1, DFCP1)與磷酰亞胺(WD repeat protein interacting with phosphoinositides, WIPI)相互作用的WD重復蛋白招募到自噬前體上,之后ATG12-ATG5-ATG16L1復合物和自噬標志物微管相關蛋白1輕鏈3(microtubule-associated protein light chain 3, LC3)協助隔離膜伸展并形成成熟的自噬體。隨后,在同型融合和蛋白分選復合體(homotypic fusion and vacuole protein sorting, HOPS)、突觸融合蛋白17(syntaxin 17, STX17)、囊泡相關膜蛋白7/8(vesicle-associated membrane protein 7/8, VAMP7/8)和突觸體相關蛋白29(synaptosomal-associated protein 29, SNAP29)等分子的參與下,自噬體與溶酶體融合形成自噬溶酶體。自噬溶酶體將包裹在其內的“貨物”降解為一些小分子營養物質(氨基酸和核苷酸等)。

圖1 自噬途徑涉及隔離膜的形成、延伸、自噬體的成熟以及自噬溶酶體的形成
1.2 細胞自噬的生理功能 自噬廣泛存在于真核細胞中,是細胞的一種自我保護機制[8]。細胞自噬的生理功能(圖2)主要有以下幾點。(1)維持內環境穩態:包括蛋白質質量控制、脂肪穩態、鐵穩態、器官穩態、抗衰老以及維持基因組穩定性等多個方面。(2)免疫與炎癥:自噬有助于幫助宿主細胞激活免疫系統來控制感染病情的加重同時抑制相關炎癥的發生[9]。此外,一些ATG也可以作為炎癥反應的信號分子誘導炎癥反應的發生。(3)自噬性死亡:當細胞周圍的生存條件無法滿足生存時,自噬可以主動誘導細胞程序性死亡,即自噬性死亡,來減少非必要的能量消耗[10]。(4)對腫瘤的雙重作用:某些腫瘤細胞(腎癌[11]、肝癌[12]等)可以通過自噬途徑來抵御營養物質的缺乏以及細胞內低氧狀況,從而維持其生長;而自噬也可以通過降解功能失調蛋白質、受損細胞器以及協同其他途徑來增強宿主細胞自身的防護力,從而抑制早期腫瘤的生長。

圖2 自噬的生理功能
2 細胞自噬對腎癌的雙重作用
細胞自噬在腎臟的發育和生理功能方面起重要作用,然而自噬在腎癌的發生發展的某個特定階段中的確切作用仍然不清楚[13]。下文就目前關于自噬在腎癌中的雙重作用進行總結(圖3)。
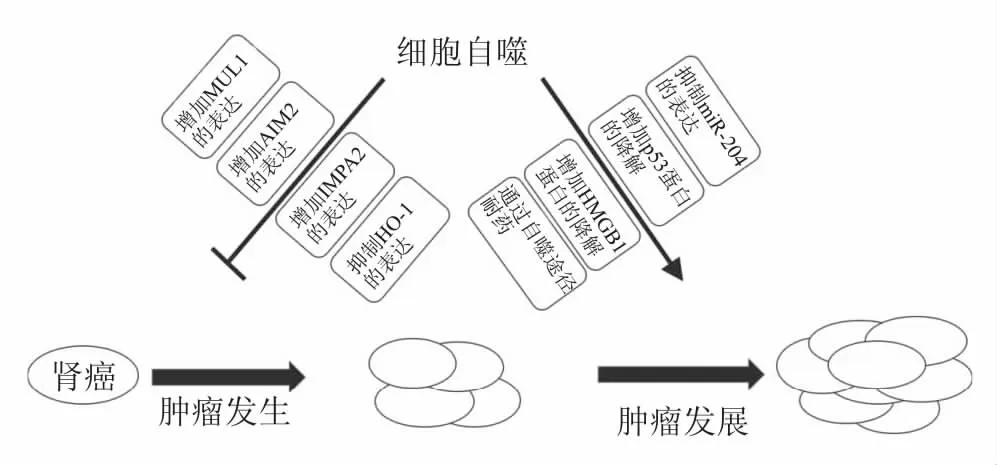
圖3 自噬在腎癌中的雙重作用:MUL1.線粒體相關E3泛素連接酶;AIM2.黑色素瘤缺乏因子2;IMPA2.肌醇單磷酸2;HO-1.血紅素加氧酶-1;HMGB1.高遷移率族蛋白B1
2.1 細胞自噬對腎癌的促進作用 文獻報道自噬通過維持腫瘤細胞微環境的穩態而對某些腫瘤細胞起保護作用[14]。Fang等[15]發現腎癌細胞可以通過產生ASPL-TFE3融合基因來激活自噬,從而促進腎癌細胞對脂質和蛋白質的利用。Mikhaylova等[16]發現,腎癌細胞通過增強自噬水平抑制了miR-204表達,從而促進了腎癌細胞的生長與存活。此外,TP53作為一種抑癌基因,其表達產物p53蛋白具有抑制腫瘤發生的作用。Kang等[17]發現腎癌細胞通過增強自噬水平增加了p53蛋白的降解,從而促進了腎癌細胞的發生和發展。Wu等[18]發現腎癌細胞通過高遷移率族蛋白B1(high mobility group box 1, HMGB1)和晚期糖基化終末產物受體(receptor for advanced glycation end products, RAGE)相互作用來誘導細胞自噬,降低腎癌細胞凋亡,最終促進腎癌細胞的增殖。
2.2 細胞自噬對腎癌的抑制作用也有研究表明,增加自噬基因以及相關因子的表達可以緩解腎癌病情的惡化。Wang等[19]發現在體內外實驗中,通過ATG7和LC3過表達激活的自噬可以抑制腎癌細胞786-O、769-P、OS-RC-2等的生長與存活。Yuan等[20]發現,線粒體相關E3泛素連接酶(mitochondrial E3 ubiquitin ligase 1, MUL1)可以通過抑制ccRCC細胞中蛋白質聚集體的積聚來激活自噬,從而增強了對ccRCC細胞增殖的抑制。黑色素瘤缺乏因子2(absent in melanoma 2, AIM2)是一種參與免疫反應的感受器,具有抑制癌癥的作用。Chai等[21]發現,腎癌患者體內AIM2的表達顯著降低,其可以通過增加自噬相關基因(Beclin 1、MAP1LC3A和ATG5)的表達來增強自噬活性,從而抑制腎癌細胞的增殖。Banerjee等[22]發現血紅素加氧酶-1(heme oxygenase-1, HO-1)可以降低自噬相關蛋白Beclin 1和LC3-Ⅱ的水平,從而促進腎癌病情的惡化。文獻報道腎癌細胞中的自噬水平較正常腎細胞低,進一步研究發現自噬通過降解乏氧誘導因子-2α(hypoxia inducible factor -2α, HIF-2α)來抑制腎癌的生長和發展[23-24]。肌醇單磷酸2(inositol monophosphatase 2, IMPA2)下調通過激活哺乳動物雷帕霉素靶蛋白(mechanistic target of rapamycin, mTOR)信號通路,抑制自噬流的形成,最終促進ccRCC的生長與轉移[25]。上述研究表明自噬抑制也可能會促進腎癌進展。
3 細胞自噬與腎癌的治療
自噬在維持腎臟穩態中起多種作用,其保護腎臟的作用機制可能是通過特異性降解NLRP3炎癥小體、清除細胞內突變蛋白等。因此可以通過靶向自噬來制定治療腎癌的策略。
3.1 自噬誘導劑治療腎癌研究表明自噬誘導劑可以用來治療腎癌(表1)。索拉菲尼是經美國FDA批準上市的治療晚期腎癌的一線藥物。Serrano-Oviedo等[26]發現,索拉菲尼通過非依賴于ERK1/2途徑抑制AKT信號通路,增加了腎癌細胞的自噬性死亡。研究表明,水飛薊賓通過抑制單磷酸腺苷酸活化蛋白激酶(adenosine 5’-monophosphate activated protein kinase, AMPK)/mTOR信號通路,增加腎癌細胞中的自噬水平,從而抑制腎癌細胞的生長[27]。白藜蘆醇可以上調腎癌細胞中ATG5和ATG7等自噬相關基因的表達水平激活自噬,并通過p53介導的AMPK/mTOR信號通路抑制腎癌細胞的生長和遷移,最終促進其凋亡[28]。青藤堿通過抑制PI3K/AKT/mTOR通路,增加LC3-Ⅱ、Beclin 1蛋白的表達,促進腎癌細胞自噬性死亡,從而抑制腎癌的進展[29]。
3.2 自噬抑制劑治療腎癌在營養缺乏、氧化應激及缺氧等惡劣條件下,癌癥細胞中的自噬被認為是一種保護機制,來確保癌癥細胞的生長與增殖[14]。因此,抑制自噬也被認為是一種治療腎癌的有效手段(表1)。Li等[30]發現,使用氯喹抑制腎癌細胞的自噬流后,可以顯著增強舒尼替尼的抗癌效果。此外,Mao等[31]發現,通過聯合應用氯喹衍生物羥氯喹和過氧化物酶體增殖物激活受體α(peroxisome proliferator-activated receptor α, PPARα)抑制劑GW6471可以顯著增加ccRCC細胞的凋亡水平,從而抑制ccRCC細胞的生長。THZ1是廣泛應用于腫瘤治療的一種細胞周期依賴性激酶7(cyclin-dependent kinase 7, CDK7)抑制劑。研究發現,THZ1聯合替西羅莫司通過抑制腎癌細胞中的自噬,顯著抑制腎癌細胞的增殖,并促進其凋亡[32]。SAR405是一種以高親和力靶向液泡分選蛋白34(vacuolar protein sorting 34, VPS34)的ATP結合口袋,從而抑制自噬的小分子藥物。有研究顯示SAR405與依維莫司聯用可以顯著抑制腎癌細胞的生長[33]。由于腎癌的細胞模型及動物模型并不能完全模擬人類腎癌的病程(包括癥狀、病理變化等),導致在腎癌的不同階段、不同的腎癌模型中的自噬水平存在差異,而出現自噬誘導劑和自噬抑制劑都可用于治療腎癌的現象。
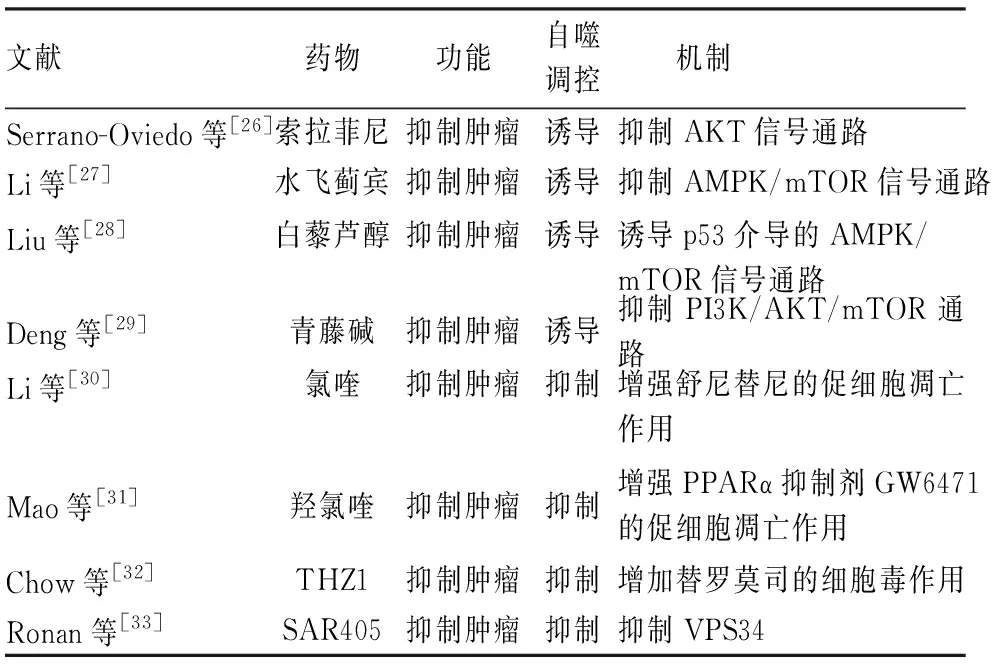
表1 治療腎癌的自噬藥物
4 總結與展望
細胞自噬是細胞內維持能量代謝和內環境穩態的一個重要途徑。一方面,自噬通過改變腎癌細胞內環境的穩態,影響其生長與遷移。另一方面,腎癌細胞可以通過自噬途徑獲取能量和營養物質,從而增強對某些抗癌藥物的耐受性,最終促進了腎癌細胞的存活。因此,自噬抑制劑/誘導劑對腎癌具有巨大的治療潛力。然而,受限于實驗技術以及缺乏特異性的自噬生物學標志物,特定階段腎癌細胞中的自噬狀態尚不清楚,因此將自噬誘導劑/抑制劑應用到治療腎癌的臨床實踐中,至少需要解決以下幾個問題:(1)基礎研究層面:①發掘具有代表性和高特異性的自噬生物學標志物,實現體外實時監測腎癌進展過程中的自噬活性。②用細胞或動物模型來準確模擬人類腎癌的癥狀和病理變化。③明確自噬功能失調在腎癌發生發展中某個特定階段所起的確切作用。(2)臨床應用層面:①在無創或微創條件下準確檢測出處于不同階段腎癌患者中的自噬水平,從而針對性地使用相應的自噬調節藥物來進行個體化來治療。②避免腎癌患者使用自噬誘導劑/抑制劑后導致的體內自噬活性過強或過弱導致的副作用。
為解決上述存在的問題,可以從以下三個方面入手。(1)發掘具有高特異性的自噬生物學標志物及特異性的腎癌動物模型:理想條件下的高特異性自噬生物學標志物可能是患者血液和尿液中的自噬相關基因和蛋白[34],其能夠準確地反映出處于不同階段腎癌的自噬狀態,進而通過自噬生物學標志物的改變反映疾病的進程,這樣可以減少對患者身體的傷害和經濟負擔,為腎癌的治療提供重要參考。特異性腎癌動物模型可以較好地模擬腎癌病程進展,從而為藥物治療及腎癌發病機制的研究奠定基礎。例如Harlander等[35]首次報道,Vhl、Trp53和Rb1三基因聯合突變可以導致小鼠ccRCC。Bailey等[36]報道在小鼠模型中Myc基因活化可導致高穿透性pRCC,而Myc基因活化后,與Vhl基因和Cdkn2a(Ink4a/Arf)基因聯合缺失時,可以產生近似人類ccRCC。(2)確保自噬調節劑的特異性:通過自噬生物學標志物的變化反映疾病的進程,然后針對性地使用自噬抑制劑/誘導劑治療疾病。由于藥物在體內會經過復雜的代謝過程,其發揮藥效的作用機制必須明確才可以有效地避免藥物毒副作用的產生,從而提高藥物的安全性和有效性。因此,自噬調節劑的特異性至關重要。(3)實時監測:由于自噬具有雙重作用,通過特異性的自噬生物標志物和(或)一些特殊的影像學技術[37],反映不同階段腫瘤細胞的自噬狀態后,需要對服用自噬調節劑患者體內的自噬狀態和血藥濃度進行實時監測,避免出現調節過度或不足而加重疾病的現象。相信未來隨著技術的不斷進步及上述問題的解決,自噬在不同階段腎癌中發揮的作用會被慢慢揭開,從而為腎癌藥物治療開辟新的領域。

