鐵銅雙金屬類芬頓體系處理氯酚廢水的研究
張玥,梅家龍,任偉,孫思瑤,張有賢
(蘭州大學 資源環境學院,甘肅 蘭州 730000)
氯酚類廢水具有高毒性、難降解、生物累積性的特點[1-2]。氯酚的降解方法包括物理處理、生物處理和化學處理[3]。高級氧化技術通過自由基加成、電子轉移和自由基組合等方式攻擊有機污染物,最終導致有機物的化學降解甚至礦化[4-6]。
本文制備了鐵銅雙金屬催化劑,考察了一系列影響因素對類芬頓體系處理2,4-二氯苯酚(2,4-DCP)、2,4,6-三氯苯酚(2,4,6-TCP)廢水的影響,通過自由基猝滅實驗,鑒定了參與反應的自由基并探討了反應機制。
1 實驗部分
1.1 試劑與儀器
還原鐵粉、過氧化氫、無水乙醇、硫酸銅、叔丁醇、對苯醌均為分析純;2,4-DCP、2,4,6-TCP、甲醇均為色譜純;去離子水。
1260LC高效液相色譜儀;PL-S60T超聲波清洗機;SCIENTZ-10N冷凍干燥機;GL2004B電子分析天平;PHS-25 pH計;TH-103B恒溫培養搖床;DZF-6022真空干燥箱;JSM-5600LV掃描電子顯微鏡(SEM);D2 PHASER X射線衍射分析儀(XRD)。
1.2 催化劑的制備
以零價鐵粉為基礎材料,通過金屬的置換反應制備鐵銅雙金屬復合催化劑材料,相關參數見表1。
將15 g鐵粉加入至250 mL濃度90 g/L的硫酸銅溶液中,劇烈攪拌10 min。分離出Fe/Cu雙金屬顆粒,用去離子水沖洗3次,用乙醇沖洗1次;用冷凍干燥機在-55 ℃下干燥24 h,得到鐵銅雙金屬復合催化劑,理論銅質量負載量為1.26 g Cu/g Fe[7-8]。

表1 鐵銅雙金屬催化劑的參數
1.3 催化劑表征
使用JSM-5600LV掃描電子顯微鏡(SEM)觀測催化劑的表面形貌;使用D2 PHASER X射線衍射分析儀(XRD)對催化劑的結構進行解析,并對XRD測試所得數據采用MDI Jade 6.0軟件進行分析。
1.4 氯酚廢水的類芬頓處理
以2,4-DCP、2,4,6-TCP為污染物,配制濃度為10 mg/L的模擬廢水。250 mL廢水中加入1.0 g/L催化劑,H2O2濃度為5 mmol/L,在搖床(200 r/min,25 ℃)中進行實驗,反應60 min取樣,并用濾頭過濾。
1.5 分析方法
2,4-DCP、2,4,6-TCP均采用高效液相色譜儀檢測,色譜柱為C18柱,流動相使用70%甲醇和30%水,流速為1 mL/min,柱溫為30 ℃,檢測波長分別為280,290 nm,檢測器使用紫外檢測器,進樣體積為20 μL。
2 結果與討論
2.1 催化劑的表征
2.1.1 SEM分析 圖1為鐵銅雙金屬催化劑的掃描電鏡圖像。
由圖1可知,催化劑由圓球狀顆粒物質組成,材料周圍存在大量的小球,且存在一定程度上的化學態結合,形成了不規則的復合體。但顆粒之間也存在一定的團聚現象,可能會導致材料催化性能的減弱。


圖1 鐵銅雙金屬催化劑的SEM圖像Fig.1 SEM images of Fe-Cu bimetallic catalysta.Fe/Cu×5 000;b.Fe/Cu×2 000
2.1.2 XRD分析 圖2為鐵銅雙金屬催化劑的XRD衍射圖譜。
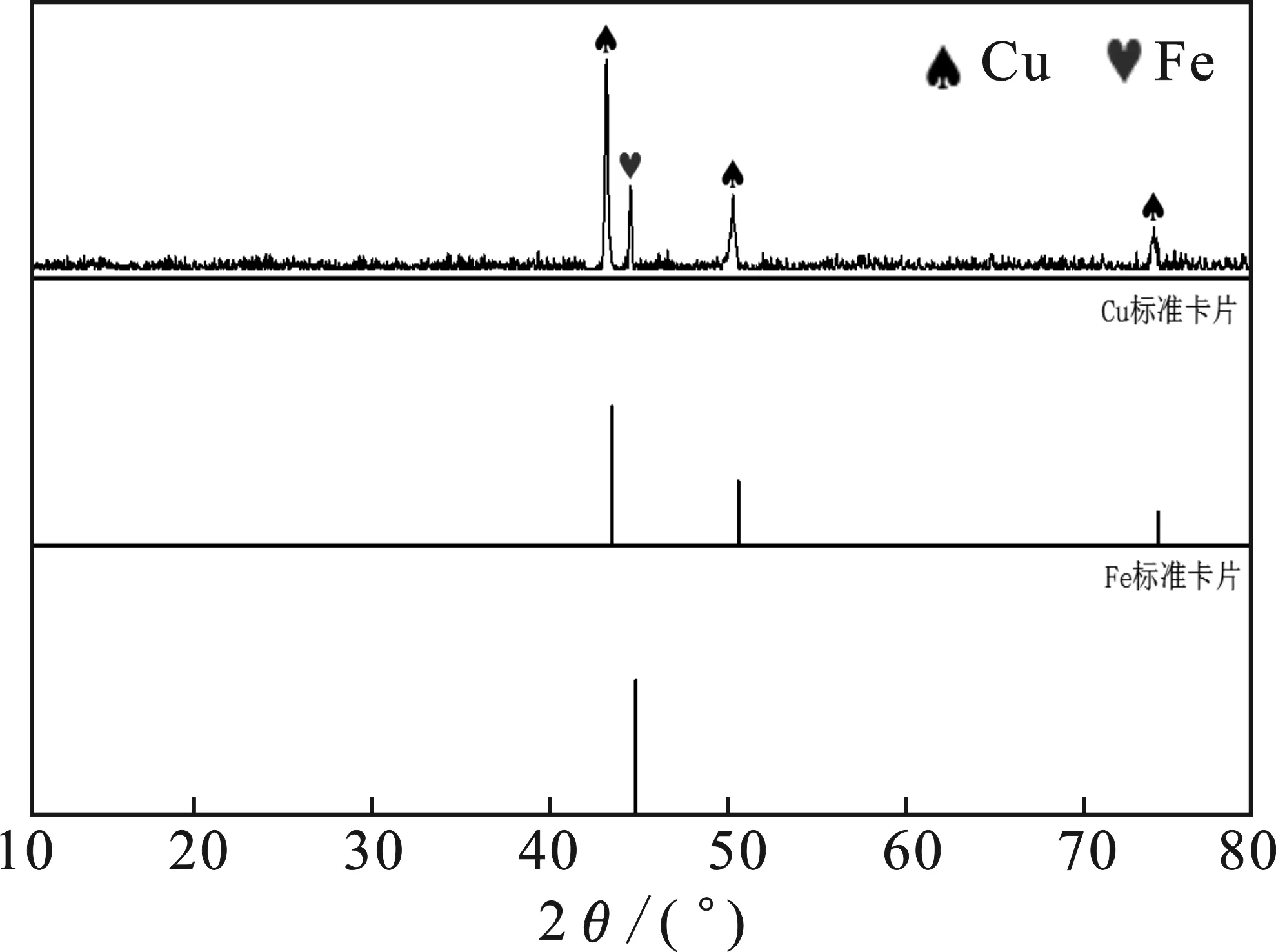
圖2 鐵銅雙金屬催化劑的XRD圖Fig.2 XRD pattern of Fe-Cu bimetallic catalyst
由圖2可知,制備的鐵銅雙金屬催化劑的化學成分主要為Fe和Cu,沒有檢測到任何金屬氧化物,表明銅通過置換反應成功地沉積在鐵表面。即使在未密封和非氮氣保護條件下,通過置換反應制備鐵銅雙金屬催化劑的過程中也幾乎沒有副產物。該制備方法在常溫常壓就能進行,且制備工藝相對簡單,因此具有重要的實用意義。
2.2 類芬頓處理的影響因素探究
2.2.1 鐵銅摻雜比例的影響 雙金屬體系中污染物的減少主要發生在過渡金屬添加劑的表面[9-10],Fe/Cu雙金屬材料催化活性的關鍵影響因素是Fe/Cu雙金屬材料表面的Cu質量[11]。因此,采用不同理論Cu質量負載量的Fe/Cu雙金屬催化劑進行了實驗。在模擬廢水污染物初始濃度為10 mg/L,催化劑投加量為1.0 g/L,H2O2濃度為5 mmol/L,不調節初始pH的條件下,探究鐵銅摻雜比例對污染物去除性能的影響,結果見圖3。
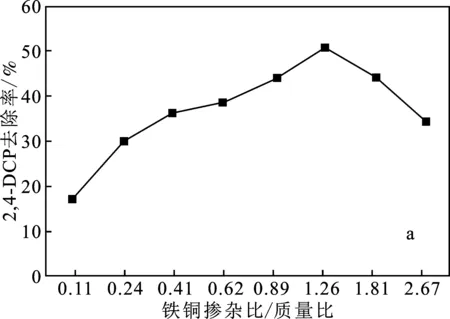
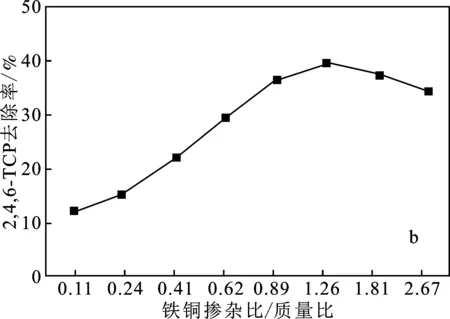
圖3 鐵銅摻雜比例對污染物去除率的影響Fig.3 Effect of Fe-Cu doping ratio on pollutant removal ratea.2,4-DCP;b.2,4,6-TCP
由圖3可知,反應60 min后,2,4-DCP、2,4,6-TCP均在鐵銅摻雜比為10∶12.6時得到最高去除率,分別為50.92%,39.84%。鐵銅雙金屬催化劑的反應性增強是由于雙催化位點的存在和雙金屬催化位點之間的協同效應,但當理論銅質量負荷超過一定值時,置換出來的銅不能完全沉積在鐵顆粒表面,過量的銅會從鐵顆粒表面脫落[7]。因此選擇鐵銅摻雜比為Fe/Cu=10∶12.6的催化劑作為最優催化劑進行后續實驗。
2.2.2 H2O2濃度的影響 在模擬廢水污染物初始濃度為10 mg/L,催化劑投加量為1.0 g/L,不調節初始pH的條件下,考察H2O2濃度對污染物去除性能的影響,結果見圖4。
由圖4可知,反應60 min后,反應體系中未加入H2O2時,2,4-DCP、2,4,6-TCP的去除率分別為19.56%,20.56%,說明鐵銅雙金屬催化劑對污染物存在一定的吸附作用,但污染物去除率較低。隨著反應體系中H2O2濃度的增加,污染物的去除率升高,H2O2濃度達到5 mmol/L污染物去除率的提升幅度較小。H2O2濃度的升高,固液界面發生催化反應的速率越快,產生的·OH越多,從而提高了非均相催化劑降解污染物的反應速率[12]。選取H2O2濃度為5 mmol/L為宜。
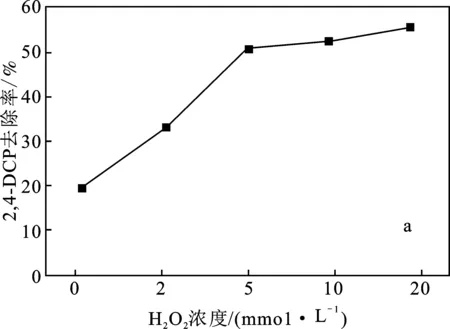

圖4 H2O2濃度對污染物去除率的影響Fig.4 Influence of H2O2 concentration on pollutant removal ratea.2,4-DCP;b.2,4,6-TCP
2.2.3 催化劑投加量的影響 在模擬廢水污染物初始濃度為10 mg/L,H2O2濃度為5 mmol/L,不調節初始pH的條件下,考察Fe/Cu雙金屬催化劑投加量對污染物去除性能的影響,結果見圖5。
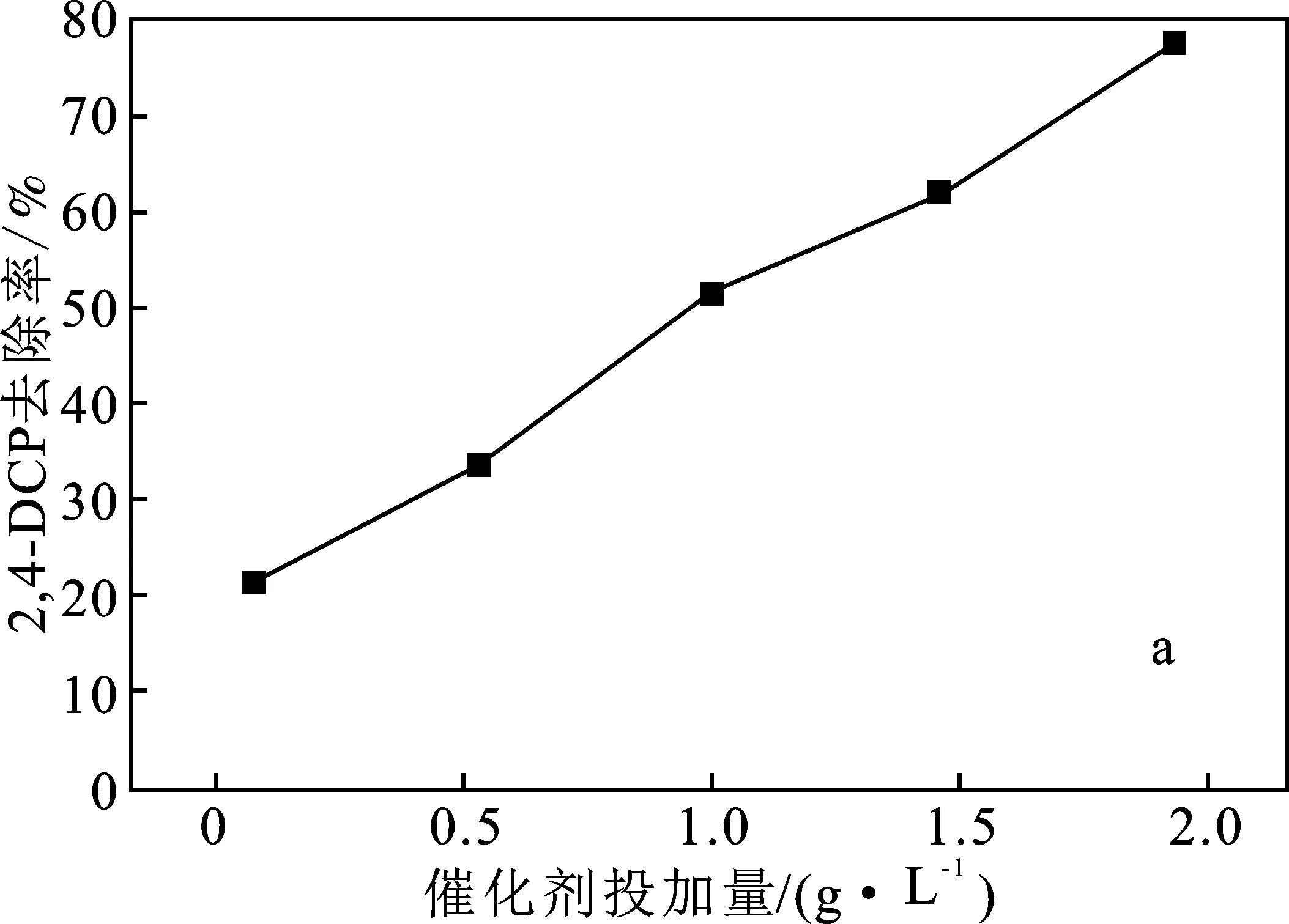
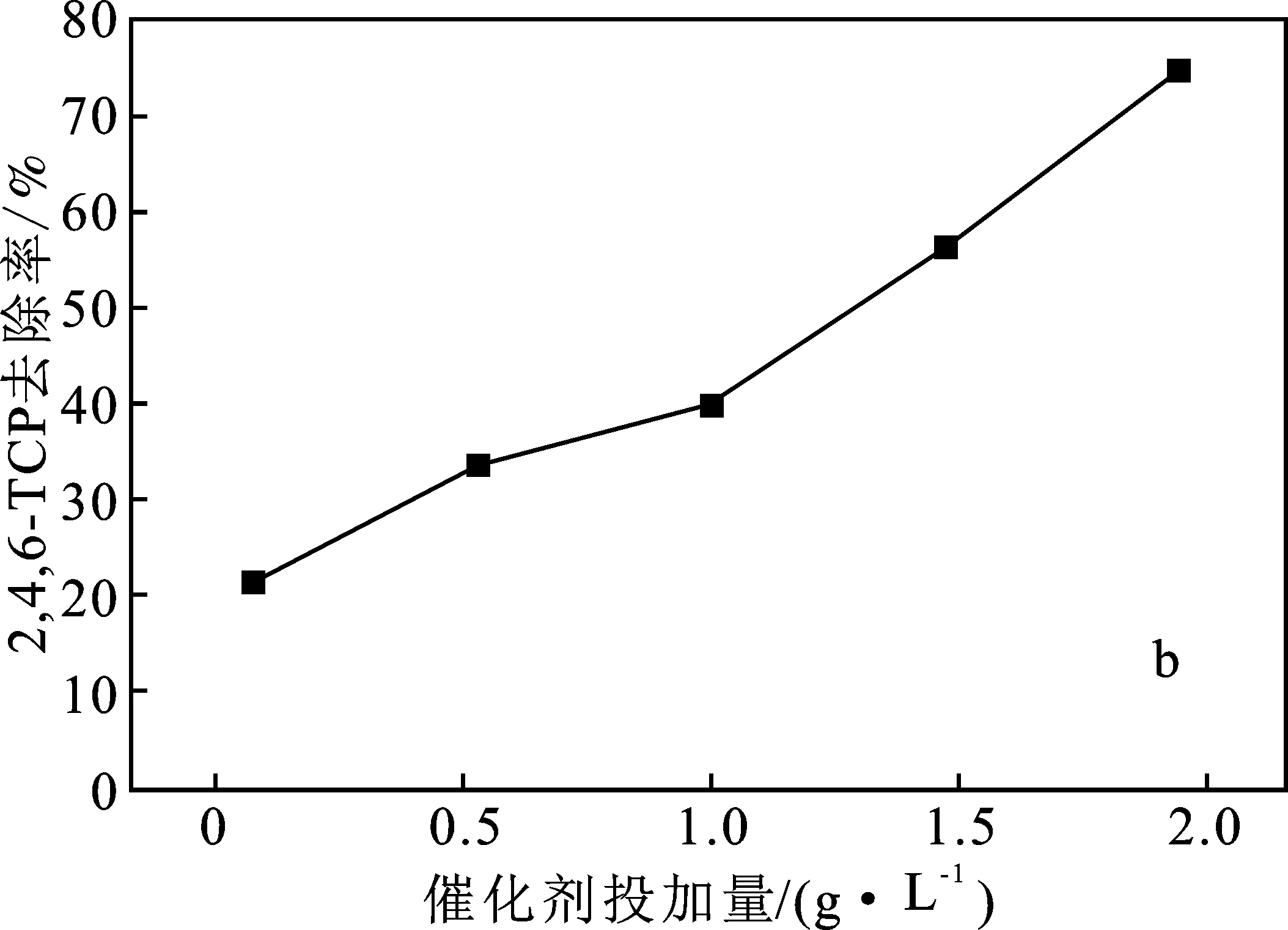
圖5 催化劑投加量對污染物去除率的影響Fig.5 Effect of catalyst dosage on pollutant removal ratea.2,4-DCP;b.2,4,6-TCP
由圖5可知,隨著催化劑投加量的增加,2,4-DCP、2,4,6-TCP的去除率顯著升高。催化劑投加量的增加可以為H2O2的活化提供更多的活性位點,從而可顯著促進活性自由基的產生。在合適范圍增加催化劑投加量,能有效促進過氧化氫分解,產生更多的·OH[13],提高污染物的去除率,但是催化劑投加量過多會影響其實用性和經濟價值。因此,選取催化劑投加量1.0 g/L為宜。
2.2.4 反應初始pH的影響 在模擬廢水污染物初始濃度為10 mg/L,催化劑投加量為1.0 g/L,H2O2濃度為5 mmol/L的條件下,考察反應初始pH對污染物去除性能的影響,結果見圖6。
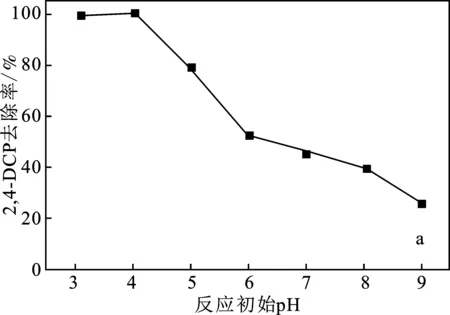
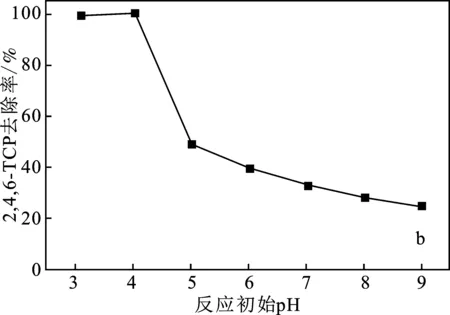
圖6 反應初始pH對污染物去除率的影響Fig.6 Effect of initial pH on pollutant removal rate(a)2,4-DCP;(b)2,4,6-TCP
由圖6可知,反應初始pH為3~4時,反應60 min 后,2,4-DCP、2,4,6-TCP的去除率最高均為100%。隨著反應初始pH的增加,2,4-DCP、2,4,6-TCP的去除率明顯下降。pH對類芬頓體系有很大影響,pH較低時,生成的·OH增加,提升了H2O2在反應體系中的利用率,故選取pH=4為宜。
2.2.5 反應時間的影響 在模擬廢水污染物初始濃度為10 mg/L,催化劑投加量為1.0 g/L,H2O2濃度為5 mmol/L,pH=4的條件下,探究反應時間對污染物去除率的影響,結果見圖7。
由圖7可知,反應十分迅速,5 min去除率可達95%以上,反應10 min時,污染物可完全去除。
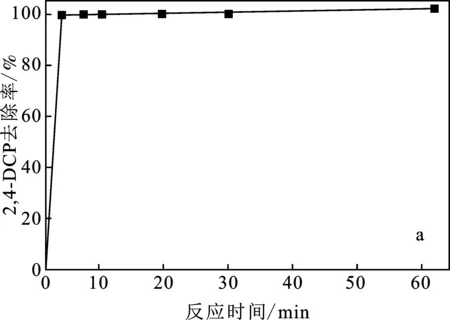
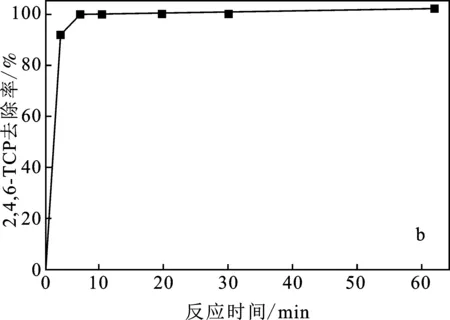
圖7 反應時間對污染物去除率的影響Fig.7 Effect of reaction time on pollutant removal rate(a)2,4-DCP;(b)2,4,6-TCP
2.2.6 催化劑的循環使用 催化劑可回收利用且具有較高的穩定性,是多相類芬頓體系一個顯著的優點[14]。在模擬廢水污染物初始濃度為10 mg/L,催化劑投加量為1.0 g/L,H2O2濃度為5 mmol/L,pH=4的條件下進行實驗,反應結束后,分離出固體催化劑,用真空干燥箱進行干燥,催化劑干燥后不經任何處理直接進入下一輪降解反應。重復利用5次,觀察其催化劑對污染物去除率的影響。表2為催化劑循環使用實驗中,反應10 min后污染物的去除率。
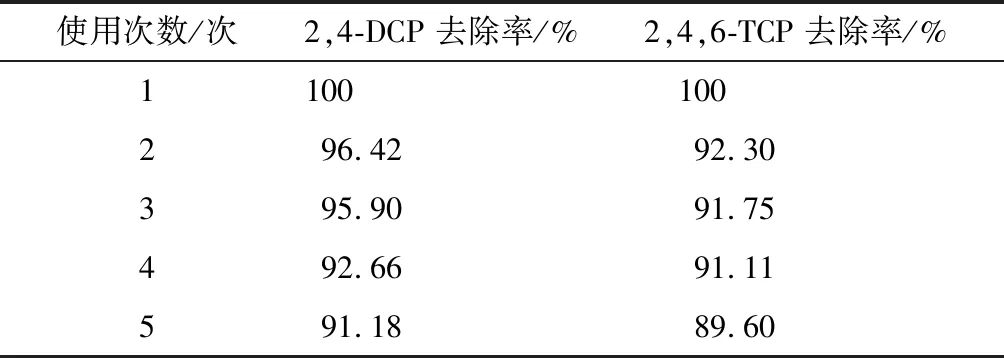
表2 催化劑使用次數對污染物去除率的影響
由表2可知,在催化劑重復使用的過程中,污染物去除率有所降低,可能是因為:①在對催化劑回收干燥的過程中,催化劑表面受到不同程度的氧化,隨著反應過程的進行,在酸性條件下,催化劑表面的氧化膜被去除;②在重復實驗過程中,存在金屬離子溶出的現象,使得催化劑的性能有所降低。但最終呈現出良好的去除率,說明所制備出的催化劑具有良好的穩定性和可重復使用性。
2.3 自由基猝滅實驗

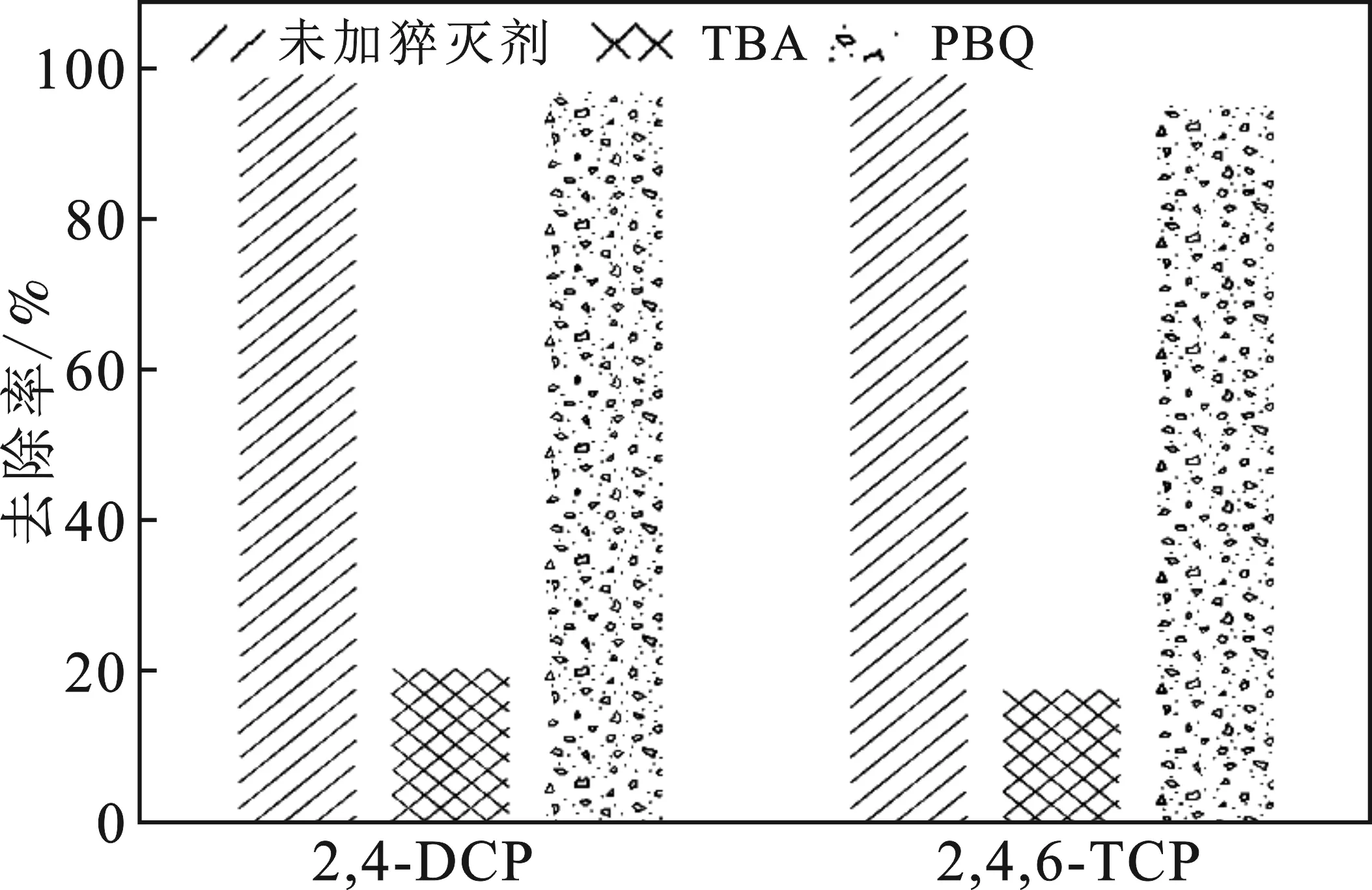
圖8 自由基猝滅實驗結果Fig.8 Experimental results of free radical quenching

3 結論
(1)鐵銅雙金屬催化劑催化H2O2處理氯酚廢水的最佳條件為:在污染物濃度為10 mg/L時,H2O2濃度為5 mmol/L,催化劑投加量為1.0 g/L,溶液初始pH為4。在此條件下,反應10 min,水中的2,4-DCP、2,4,6-TCP能夠完全去除。
(2)由自由基猝滅實驗結果可知,在鐵銅雙金屬催化劑催化H2O2處理氯酚廢水的過程中,有機污染物與H2O2所產生的·OH進行反應降解,·OH為反應產生的主要自由基。

