Notch3調控Hes2逆轉三陰性乳腺癌上皮-間質轉化的機制研究
田園,牟雅君,楊文秀,豆曉偉
三陰性乳腺癌(triple negative breast cancer,TNBC)是最具侵襲性的乳腺癌亞型[1]。由于TNBC缺乏特異性治療靶點,目前尚無分子靶向藥物用于治 療 TNBC。上皮-間質轉化(epithelialmesenchymal transition,EMT)是癌癥轉移的關鍵步驟,TNBC 具有較強的EMT 特征[2-3]。有研究報道,Notch3 缺失是TNBC 的一個重要特征,Notch3 可通過激活乳腺癌上皮細胞中Hippo/Yes 相關蛋白(YAP)通路來抑制EMT[4]。另有研究表明,過表達Notch3可抑制TNBC細胞增殖[5];高表達Notch3可以增加TNBC 細胞MDA-MB-231 對順鉑的敏感性,且高表達Notch3 的乳腺癌患者總生存期高于Notch3低表達患者[6]。因此,Notch3可視為TNBC的抑制因子,但其作用機制尚未明確。作為Notch信號通路的下游靶基因,Hes 家族基因在癌癥發生過程中起著重要作用[7-8]。Hes 家族包括Hes1~7 共7 個蛋白。據報道,Hes1在TNBC 中過度表達并促進了侵襲[9];降低Notch1 的激活和下游靶蛋白Hes1 的表達可抑制TNBC 干細胞增殖[10]。本課題組前期研究顯示,上調TNBC 細胞MDA-MB-231 中Notch3 后,Hes1 表達并未增高,而Hes2 表達明顯升高。因此,筆者擬通過本研究驗證Notch3能否逆轉TNBC的EMT及抑制腫瘤轉移,以及此過程是否與上調Hes2 表達有關。
1 材料與方法
1.1 材料
1.1.1 細胞 TNBC 細胞系MDA-MB-231(貨號SCDP-197)購自中國科學院上海細胞庫。
1.1.2 主要試劑與儀器 DMEM培養基(貨號11965092)、胎牛血清(貨號10099141C)、Lipofectamine 3000轉染試劑(貨號L3000-015)、Trizol試劑(貨號15596018)、BCA蛋白質定量試劑盒(貨號361977)均購自美國Invitrogen 公司;Notch3 過表達質粒(pcDNA3.1-Notch3-GFP)及其陰性對照質粒(pcDNA3.1-NC-GFP)、Hes2 敲低的小分子干擾質粒(si-Hes2-GFP)及其陰性對照質粒(si-NC-GFP)均由深圳華大基因有限公司合成;逆轉錄試劑盒(貨號RL019A)、PCR試劑盒(貨號RR820A)、細胞計數試劑盒-8(CCK-8,貨號RK035L)均購自日本TaKaRa 公司;Transwell 小室(貨號3422)購自美國Corning 公司;鼠抗人Notch3(貨號sc-515825)、Hes2(貨號sc-166705)單克隆抗體購自美國Santa Cruz Biotechnology 公司;鼠抗人E-鈣黏蛋白(E-cadherin,貨號A3044)、波形蛋白(Vimentin,貨號A19607)、β-肌動蛋白(β-actin,貨 號A10752)單克隆抗體及鼠抗人二抗(貨號A06631)均購自武漢愛博泰克生物科技有限公司;CO2細胞培養箱(型號HERAcell 240i)購自美國Thermo Fisher Scientific 公司;實時熒光定量PCR(qPCR)儀(型號7500)、凝膠成像系統(型號Healthcare)均購自美國應用生物系統公司;多功能酶標儀(型號iMark680)購自美國Bio-Rad公司;倒置熒光顯微鏡(型號IX73)購自日本Olympus公司。
1.2 研究方法
1.2.1 細胞培養 MDA-MB-231 細胞培養使用DMEM 培養基(含10%胎牛血清以及100 U/mL 青霉素和100 mg/L 鏈霉素),在37 ℃和5%CO2細胞培養箱中進行培養。待細胞融合度為80%~90%時進行傳代。
1.2.2 細胞轉染 將對數生長期的MDA-MB-231 細胞(5×104個/mL)接種于6 孔板中,每孔2 mL,培養過夜;待細胞融合度為60%~80%時,采用Lipofectamine 3000試劑進行轉染實驗,細胞分為:對照組(不進行任何轉染)、pc-NC 組(轉染pcDNA3.1-NC-GFP)、Notch3 過表達組(pc-Notch3 組,轉染pcDNA3.1-Notch3-GFP)、Notch3 過表達+si-NC 組(pc-Notch3+si-NC 組,共轉染pcDNA3.1-Notch3-GFP 和si-NCGFP)、Notch3過表達+Hes2敲低組(pc-Notch3+si-Hes2組,共轉染pcDNA3.1-Notch3-GFP 和si-Hes2-GFP)。收集轉染細胞用于后續實驗。
1.2.3 qPCR 檢 測MDA-MB-231細胞中Notch3、Hes2 的mRNA 表達 轉染后48 h,用Trizol 試劑從MDA-MB-231 細胞提取總RNA,使用逆轉錄試劑盒將總RNA(1 μg)逆轉錄為cDNA。以cDNA 為模板,采用qPCR 擴增目的基因Notch3、Hes2。反應條件:95 ℃預變性30 s;95 ℃變性5 s,60 ℃退火40 s,72 ℃延伸30 s,40 個循環。采用2-ΔΔCt法評估目的基因的相對表達水平。β-actin作為內參基因。引物序列見表1。實驗重復3次。
1.2.4 CCK-8 法檢測細胞增殖活性 將轉染的MDA-MB-231細胞以1 000個/孔接種于96孔板,根據CCK-8試劑盒說明書評估細胞增殖活性。在轉染0、24、48、72 h時每孔加入10 μL CCK-8,37 ℃、5%CO2培養箱中孵育2 h 后,在450 nm波長處定量吸光度(A450)值。實驗重復3次。
1.2.5 劃痕愈合實驗檢測細胞遷移能力 將轉染的MDA-MB-231細胞以2×105個/孔的密度接種在6孔板中,在37 ℃、5%CO2培養箱中孵育細胞。當細胞密度達到90%~95%時使用移液器吸頭進行劃痕,用PBS洗滌細胞,并用含有2%胎牛血清的DMEM 培養基培養細胞。于0 h、48 h 后用光學顯微鏡觀察劃痕愈合情況。通過測量細胞劃痕寬度計算細胞遷移率,遷移率(%)=(0 h劃痕寬度-48 h細胞劃痕寬度)/0 h劃痕寬度×100%。實驗重復3次。

Tab.1 The primer sequence for qPCR表1 qPCR引物序列
1.2.6 Transwell小室實驗檢測細胞侵襲能力 將5×104個轉染的MDA-MB-231 細胞接種于Transwell 上室,無血清培養基孵育,同時將600 μL 含10%胎牛血清的DMEM 培養基加到下室。培養48 h 后,將移至Transwell 下室的細胞用4%多聚甲醛固定,0.05%結晶紫染色。在光學顯微鏡下收集代表性圖像,并計數穿膜細胞數。實驗重復3次。
1.2.7 Western blot 檢測細胞Notch3、Hes2 和EMT 相關蛋白表達 將轉染的MDA-MB-231 細胞以2×105個/孔的密度接種在6孔板中,實驗設置3個復孔,在37 ℃、5%CO2培養箱中孵育細胞。當細胞密度達到80%時,用RIPA 裂解緩沖液提取MDA-MB-231 細胞中的總蛋白質,并通過BCA 蛋白質定量試劑盒測量濃度。將30 μg 總蛋白質進行凝膠電泳分離,并將凝膠中分離的蛋白質轉移至聚偏二氟乙烯膜。轉移后,將膜用5%脫脂牛奶封閉1 h,與鼠抗人Notch3(1∶500)、Hes2(1∶500)、E-cadherin(1∶1 000)、Vimentin(1∶1 000)和β-actin(1∶2 000)一抗在4 ℃下孵育過夜。然后將膜洗滌后與鼠抗人二抗(1∶4 000)在室溫下孵育1 h。增強化學發光底物顯色,用Image-Pro Plus 6.0 軟件分析膜上蛋白質條帶灰度,并以β-actin 為內參,計算目的蛋白的相對表達量。實驗重復3次。
1.3 統計學方法 采用SPSS 25.0軟件進行數據分析。計量資料以均數±標準差(±s)表示,多組間比較采用單因素方差分析,組間多重比較行SNK-q檢驗;不同時間點多組間比較采用重復測量設計的方差分析。P<0.05 為差異有統計學意義。
2 結果
2.1 各組MDA-MB-231 細胞Notch3、Hes2 mRNA和蛋白表達水平比較 對照組和pc-NC 組Notch3、Hes2 的mRNA 和蛋白表達水平差異無統計學意義(P>0.05)。與對照組和pc-NC 組比較,pc-Notch3組、pc-Notch3+si-NC組和pc-Notch3+si-Hes2 組Notch3 的mRNA 和蛋白表達水平顯著升高(P<0.05),pc-Notch3 組和pc-Notch3+si-NC 組Hes2 的mRNA 和蛋白表達水平顯著升高(P<0.05);與pc-Notch3組和pc-Notch3+si-NC 組比較,pc-Notch3+si-Hes2 組Hes2 的mRNA 和蛋白表達水平顯著降低(P<0.05)。pc-Notch3 組、pc-Notch3+si-NC 組、pc-Notch3+si-Hes2組Notch3的mRNA 和蛋白表達水平差異無統計學意義(P>0.05)。pc-Notch3 組、pc-Notch3+si-NC 組Hes2 的mRNA 和蛋白表達水平差異無統計學意義(P>0.05)。見圖1、表2。
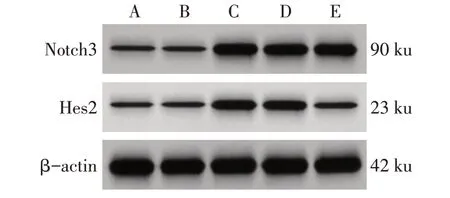
Fig.1 Western blot assay of Notch3 and Hes2 of MDA-MB-231 cells in each group圖1 各組MDA-MB-231細胞Notch3、Hes2蛋白印跡圖
Tab.2 Comparison of Notch3,Hes2 mRNA and protein levels of MDA-MB-231 cells between the five groups表2 各組MDA-MB-231細胞Notch3、Hes2的mRNA和蛋白表達水平比較 (n=3,±s)
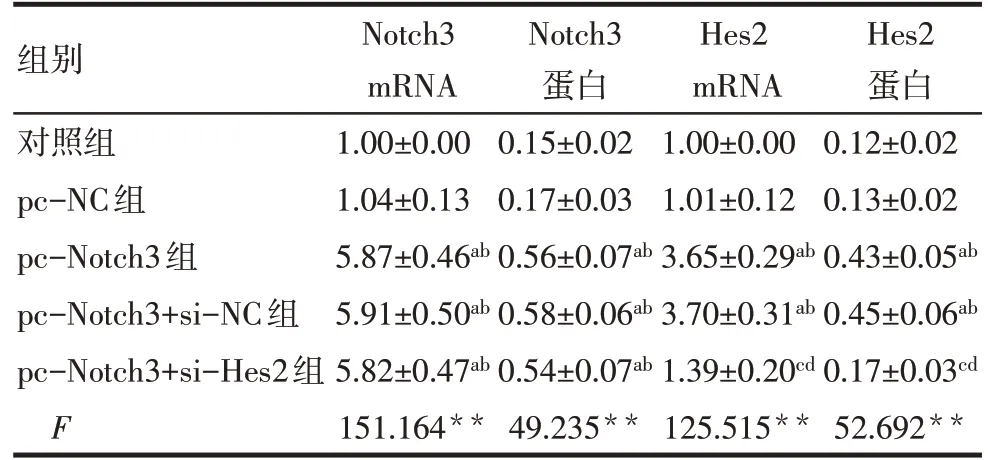
Tab.2 Comparison of Notch3,Hes2 mRNA and protein levels of MDA-MB-231 cells between the five groups表2 各組MDA-MB-231細胞Notch3、Hes2的mRNA和蛋白表達水平比較 (n=3,±s)
**P<0.01;a與對照組比較,b與pc-NC組比較,c與pc-Notch3組比較,d與pc-Notch3+si-NC組比較,P<0.05。
2.2 各組MDA-MB-231細胞增殖活性比較 在0~72 h 時,各組細胞增殖活性隨時間的增加而升高(P<0.05)。轉染0 h、24 h 時,各組間細胞增殖活性差異無統計學意義(P>0.05);轉染48 h、72 h 時,對照組和pc-NC 組細胞增殖活性差異無統計學意義(P>0.05);與對照組和pc-NC組比較,pc-Notch3組和pc-Notch3+si-NC 組細胞增殖活性顯著降低(P<0.05);與pc-Notch3 組和pc-Notch3+si-NC 組比較,pc-Notch3+si-Hes2 組細胞增殖活性顯著升高(P<0.05)。pc-Notch3 組和pc-Notch3+si-NC 組細胞增殖活性差異無統計學意義(P>0.05)。見表3。
2.3 各組MDA-MB-231 細胞遷移能力比較 對照組和pc-NC 組細胞遷移率差異無統計學意義(P>0.05)。與對照組和pc-NC 組比較,pc-Notch3 組和pc-Notch3+si-NC 組細胞遷移率顯著降低(P<0.05);與pc-Notch3 組和pc-Notch3+si-NC 組比較,pc-Notch3+si-Hes2 組細胞遷移率顯著升高(P<0.05)。pc-Notch3 組和pc-Notch3+si-NC 組細胞遷移率差異無統計學意義(P>0.05)。見圖2、表4。
2.4 各組MDA-MB-231 細胞侵襲能力比較 對照組和pc-NC 組穿膜細胞數差異無統計學意義(P>0.05)。與對照組和pc-NC 組比較,pc-Notch3 組和pc-Notch3+si-NC 組穿膜細胞數顯著降低(P<0.05);與pc-Notch3 組和pc-Notch3+si-NC 組比較,pc-Notch3+si-Hes2 組穿膜細胞數顯著升高(P<0.05)。pc-Notch3 組和pc-Notch3+si-NC 組穿膜細胞數差異無統計學意義(P>0.05)。見圖3、表4。
2.5 各組MDA-MB-231細胞EMT 相關蛋白表達水平比較 對照組和pc-NC組E-cadherin、Vimentin蛋白表達水平差異無統計學意義(P>0.05)。與對照組和pc-NC 組比較,pc-Notch3 組和pc-Notch3+si-NC 組E-cadherin 蛋白表達水平顯著升高,Vimentin蛋白表達水平顯著降低(P<0.05);與pc-Notch3 組和pc-Notch3+si-NC 組比較,pc-Notch3+si-Hes2 組E-cadherin蛋白表達水平顯著降低,Vimentin蛋白表達水平顯著升高(P<0.05)。pc-Notch3 組和pc-Notch3+si-NC組E-cadherin、Vimentin蛋白表達水平差異無統計學意義(P>0.05)。見圖4、表5。
3 討論
TNBC 的復發率和轉移潛力均高于其他乳腺癌亞型[11]。由于TNBC 的內在復雜性,以及缺乏特異性的治療靶點和預后監測指標,往往預后較差[12]。因此,有必要尋找新的治療靶點。
Tab.3 Comparison of proliferative activity of MDA-MB-231 cells between the five groups表3 各組MDA-MB-231細胞增殖活性比較 (n=3,±s)
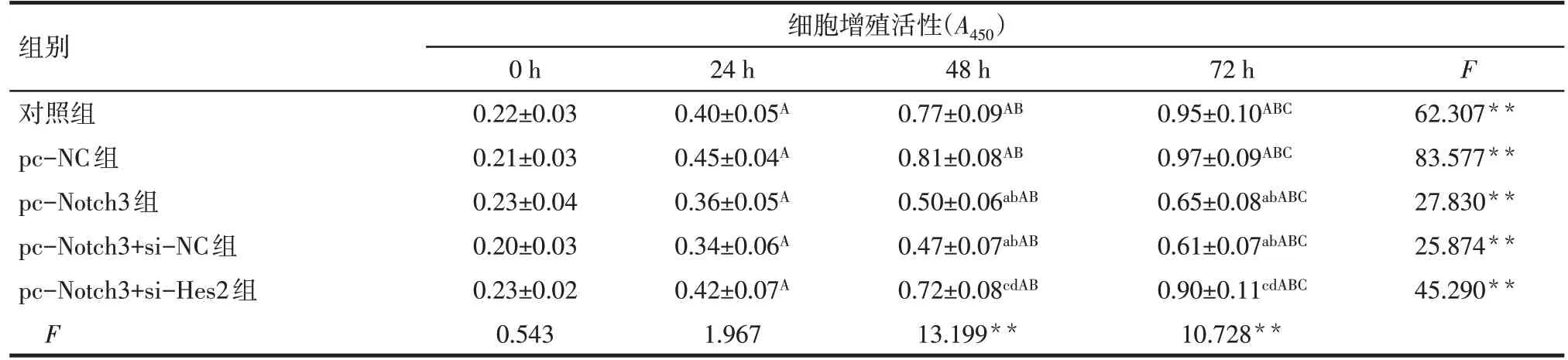
Tab.3 Comparison of proliferative activity of MDA-MB-231 cells between the five groups表3 各組MDA-MB-231細胞增殖活性比較 (n=3,±s)
**P<0.01;組間比較:a與對照組比較,b與pc-NC組比較,c與pc-Notch3組比較,d與pc-Notch3+si-NC組比較,P<0.05;組內比較:A與0 h比較,B與24 h比較,C與48 h比較,P<0.05。

Fig.2 Changes of migration ability of MDA-MB-231 cells in each group(×100)圖2 各組MDA-MB-231細胞遷移能力變化(×100)
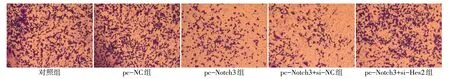
Fig.3 Comparison of invasive ability of MDA-MB-231 cells between the five groups(Crystal violet staining,×200)圖3 各組MDA-MB-231細胞侵襲能力比較(結晶紫染色,×200)
Tab.4 Comparison of MDA-MB-231 cell migration rate and number of transmembrane cells between the five groups表4 各組MDA-MB-231細胞遷移率和穿膜細胞數比較 (n=3,±s)
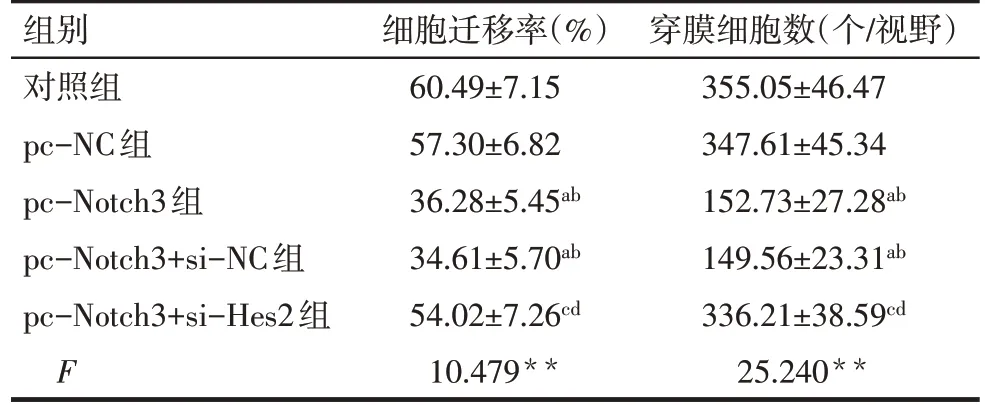
Tab.4 Comparison of MDA-MB-231 cell migration rate and number of transmembrane cells between the five groups表4 各組MDA-MB-231細胞遷移率和穿膜細胞數比較 (n=3,±s)
**P<0.01;a與對照組比較,b與pc-NC組比較,c與pc-Notch3組比較,d與pc-Notch3+si-NC組比較,P<0.05。
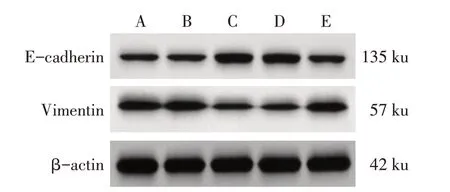
Fig.4 Western blot assay of E-cadherin and Vimentin of MDA-MB-231 cells in each group圖4 各組MDA-MB-231細胞E-cadherin、Vimentin蛋白印跡圖
Tab.5 Comparison of E-cadherin and Vimentin protein levels of MDA-MB-231 cells between the five groups表5 各組MDA-MB-231細胞E-cadherin、Vimentin蛋白水平比較 (n=3,±s)
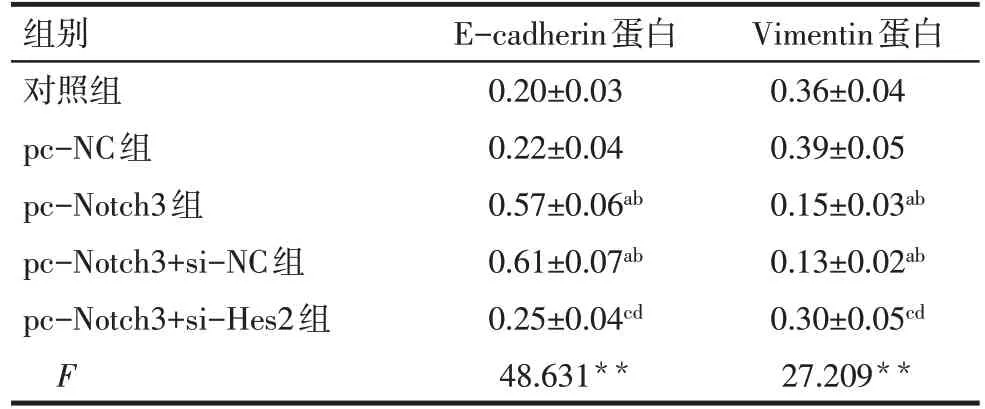
Tab.5 Comparison of E-cadherin and Vimentin protein levels of MDA-MB-231 cells between the five groups表5 各組MDA-MB-231細胞E-cadherin、Vimentin蛋白水平比較 (n=3,±s)
**P<0.01;a與對照組比較,b與pc-NC組比較,c與pc-Notch3組比較,d與pc-Notch3+si-NC組比較,P<0.05。
Notch 家族包括Notch1、Notch2、Notch3、Notch4,在腫瘤發生過程中,其具有不同的活性和生物學功能;其中Notch3 在乳腺癌(如TNBC)轉移中發揮關鍵作用[13]。EMT 是上皮細胞的一種特征性轉化,被認為是癌癥轉移的驅動力,其特征是上皮標志物Ecadherin 的丟失和間充質標志物Vimentin 的過表達[14]。目前,關于Notch3在乳腺癌EMT中的作用存在爭議[15]。第1 種觀點認為,Notch3 通過誘導EMT促進腫瘤侵襲性,乳腺癌細胞中Notch3 表達下調可顯著抑制EMT,降低乳腺癌發生骨轉移的風險[16]。第2種觀點認為,在乳腺癌患者中,Notch3表達上調與低淋巴結轉移率相關,Notch3 可通過激活GATA結合蛋白3轉錄抑制EMT及乳腺癌轉移[17];且Notch3 在體外可通過腎臟腦蛋白介導的Hippo/YAP信號通路負調節EMT[4]。本研究結果支持第2 種觀點,Notch3 誘導EMT 促進腫瘤侵襲的研究結論不一,推測可能與Notch3下游基因的激活有關,不同下游基因的激活可能導致Notch3在乳腺癌中發揮不同作用。這些研究表明Notch3信號通過激活新的下游基因來抑制乳腺癌細胞發生EMT。因此,探究Notch3 抑制TNBC 轉移的分子機制有助于尋找TNBC治療新靶點。
Hes 家族基因是公認的Notch 信號通路的下游靶基因[18]。研究顯示,Hes2在卵巢癌中表達水平升高與卵巢癌細胞的增殖活力和遷移能力有關[19],且參與食管癌[20]等侵襲性腫瘤的進展。但已有的研究并未發現Hes2 的相關機制,且關于Hes2 對乳腺癌的影響罕見報道。本研究結果顯示,過表達Notch3后,MDA-MB-231細胞中Hes2的mRNA和蛋白水平顯著高于對照組,且MDA-MB-231 細胞的增殖活性、遷移與侵襲能力均降低,同時E-cadherin蛋白表達水平升高,Vimentin蛋白表達水平降低,提示EMT受到抑制,Notch3 可能通過Hes2 在逆轉MDA-MB-231細胞EMT中發揮作用。
為驗證以上推測,本研究在過表達Notch3 的MDA-MB-231 細胞中,采用小分子干擾技術敲低Hes2 表達,進行CCK-8 測定、劃痕愈合測定和Transwell 小室測定以探索表型變化。結果顯示,在TNBC 細胞系MDA-MB-231 中,Vimentin 蛋白表達水平升高,E-cadherin 蛋白表達水平降低,并導致Notch3 過表達對細胞增殖、遷移和侵襲的抑制作用被顯著減弱,提示敲低Hes2 表達可促進EMT,過表達Notch3 可能通過上調Hes2 來逆轉TNBC 的EMT,抑制腫瘤轉移。
綜上所述,Notch3 對TNBC 轉移和EMT 的抑制作用可能與Hes2 表達水平升高有關。本研究為TNBC 提供了一個潛在的治療靶標,但目前Notch-Hes 信號通路對乳腺癌影響的研究尚不全面,其在腫瘤中的功能和調控機制仍需進一步明確。此外,Notch3 在TNBC 中的作用還需通過體內研究進一步驗證,這也將是今后的研究重點。

