去腎交感神經對2型糖尿病大鼠血管內皮細胞自噬及NLRP3活化的影響
王勇,牛偉華,盧成志△,許夢萍,徐建強,何強,許學升
2020年中國2型糖尿病(T2DM)防治指南指出,我國糖尿病患病率仍在上升,2015—2017 年達到11.2%,其中90%以上為T2DM。糖尿病常導致血液流變學、微循環和細胞代謝的紊亂,進而引起心、腦、腎和視網膜等重要靶器官的損害,其中以血管病變最為嚴重,可加速動脈粥樣硬化進展,且心血管事件是糖尿病患者死亡的主要原因[1]。血管內皮功能障礙主要表現為內皮依賴性血管舒張功能受損,是動脈粥樣硬化的早期標志之一[2]。近期研究表明,去腎交感神經(renal denervation,RDN)能有效治療高血壓[3-4],同時改善血管內皮功能障礙[5],但具體機制尚未闡明。本研究通過觀察RDN對T2DM大鼠血管內皮細胞自噬和核苷酸結合寡聚化結構域受體蛋白3(NLRP3)炎癥小體表達的影響,初步了解RDN改善T2DM 大鼠血管內皮功能的機制,為RDN 治療T2DM 引起的血管內皮功能障礙提供理論依據及實驗基礎。
1 材料與方法
1.1 材料
1.1.1 實驗動物及分組 清潔級健康雄性SD 大鼠30 只,6周齡,體質量200~220 g,購自北京維通利華實驗動物技術有限公司[生產許可證號:SCXX(京)2019-0002],于中國醫學科學院放射醫學研究所飼養。大鼠適應性喂養3 d,采用隨機數字表法分組:(1)對照組(CON組,n=6),給予普通飼料喂養。(2)高脂組(HFD 組,n=24),給予高脂飲食喂養12 周后,采用鏈脲佐菌素(STZ)腹腔注射30 mg/kg 的方法制備T2DM大鼠模型,1周后剪尾取血,空腹血糖≥11.1 mmol/L 為造模成功[6]。隨機抽取18只建模成功的大鼠,再次采用隨機數字表法分為糖尿病對照組(T2DM 組,n=6),雙側假手術組(Sham組,n=6),雙側手術組(RDN組,n=6)。
1.1.2 主要藥品、試劑及儀器 STZ(美國Sigma 公司),苯酚(濟南米樂化工有限公司),無水乙醇(濟南匯豐達化工有限公司)。10%苯酚無水乙醇溶液:苯酚溶液置于水浴箱加熱2 h,取10 mL 苯酚,再取90 mL 無水乙醇,充分混勻后裝于200 mL的瓶中。戊巴比妥鈉(北京華業寰宇化工有限公司),Trizol試劑(美國Invitrogen公司),血糖試劑盒、胰島素試劑盒(上海哈靈生物技術有限公司),去甲腎上腺素(NE)試劑盒、血管性血友病因子(vWF)試劑盒(上海酶聯生物科技有限公司),一氧化氮(NO)試劑盒(南京建成生物工程研究所),BCA蛋白定量試劑盒(美國Pierce公司),乙酰膽堿(Ach)、硝普鈉(SNP)、NE(美國Sigma公司),酪氨酸羥化酶(TH)抗體(武漢博士德生物工程有限公司),通用二步法免疫組化檢測試劑盒(PV-9000,北京中杉金橋生物技術有限公司),抗Beclin1、LC3、p62 抗體(美國CST 公司),抗NLRP3、胱天蛋白酶(Caspase)-1、活化的Caspase 3(cleaved Caspase-3)、白細胞介素(IL)-1β抗體(北京博奧森生物有限公司),抗內皮型一氧化氮合酶(eNOS)抗體(英國EterLife公司),抗β-actin抗體(美國Abbkine公司),羊抗兔二抗(碧云天公司);TIANScript cDNA第一鏈合成試劑盒購自天根生化科技(北京)有限公司,無創血壓計BP-98A(日本Softron),血糖測試儀(強生穩豪),620M離體微血管張力測定系統(丹麥ADInstrument),PowerLab多導生理記錄儀(澳大利亞AD),H-7650透射電鏡(日本日立),實時熒光定量PCR儀(Bio-Rad公司)。
1.2 研究方法
1.2.1 血壓和心率的測量 采用尾套法測量基線狀態、RDN術前及術后4周大鼠的血壓及心率。
1.2.2 RDN模型的建立[7]大鼠術前12 h禁食,4 h禁水,腹腔注射戊巴比妥鈉100 mg/kg 麻醉,腹部正中切口,暴露腎臟,用彎頭無齒鑷分離出腎動脈,在解剖顯微鏡(×25)下找出腎動脈所有可見的腎神經,RDN組用細頭棉簽蘸取溶于10%苯酚無水乙醇溶液抹雙側腎動脈周圍2 min達到充分去神經效果,Sham組予以生理鹽水涂抹2 min,不破壞腎神經。術后前3 d腹腔內注射慶大霉素8萬U/d預防感染,常規進食水。
1.2.3 血液標本采集及保存 分別于基線狀態、RDN術前及術后4周,禁食12 h清晨眼內眥靜脈取血2 mL,3 000 r/min離心10 min,取出上清液于-80 ℃保存,酶聯免疫吸附試驗(ELISA)檢測大鼠血清空腹血糖(FPG)、空腹胰島素(FINS)、NE、vWF、NO水平及腎臟組織中NE的水平,具體操作嚴格按照說明書進行。
1.2.4 標本取材、腎動脈HE 染色以及TH 陽性神經纖維檢測 RDN 術后4 周處死大鼠,剪取整段腎動脈及周圍組織。生理鹽水漂洗后,4%甲醛溶液固定,石蠟包埋,切片(范圍包括近、中、遠段),HE 染色觀察腎動脈周圍組織,免疫組化分析腎動脈中TH 陽性神經纖維,具體操作嚴格按照說明書進行。所得圖像經Image Pro Plus軟件進行定量分析,每張切片在高倍鏡下觀察,陽性表達為棕黃色,以積分光密度(IOD)為指標進行圖像分析,計算5個高倍顯微鏡下的平均IOD值。
1.2.5 透射電鏡觀察內皮細胞中的自噬結構 取各組大鼠胸主動脈切成1.0 mm×1.0 mm×1.0 mm 大小,2.5%戊二醛固定后再經鋨酸固定,乙醇丙酮脫水,環氧樹脂包埋,切片后醋酸鈉、檸檬酸鉛雙重染色,透射電鏡觀察并攝片,分析主動脈血管內皮細胞自噬體的變化情況。
1.2.6 血管環張力實驗 處死大鼠后,迅速切取4 mm 左右的胸主動脈,保存于生理鹽溶液(PSS),仔細剔除周圍脂肪和結締組織,懸吊于盛有10 mL,37 ℃PSS液的離體血管恒溫浴槽中,持續95%O2和5%CO2混合氣體;通過PowerLab 多導生理記錄儀分析血管張力的變化,浴槽內基礎張力調至1.0 g,并設定為基線值。當動脈環穩定于基線水平時,向水浴槽中加入1 μmol/L 的NE,使動脈環收縮達到最大反應后,穩定15 min,加入10 μmol/L 的Ach 觀察預收縮血管舒張程度,如果預收縮血管舒張可達到60%~90%,可以認為內皮完整,反之則認為內皮受損。給予NE收縮血管達到最大反應后穩定30 min,加入內皮非依賴性血管舒張劑SNP(1×10-6mol/L),檢測血管舒張功能。將Ach濃度梯度設為1×10-9~1×10-4mol/L,SNP濃度梯度為1×10-10~1×10-5mol/L,對比4組大鼠的Ach和SNP濃度-舒張效應曲線。
1.2.7 實時熒光定量PCR 法檢測胸主動脈內皮細胞NLRP3 mRNA 表達 RDN 術后4 周,用Trizol 提取組織樣本中總RNA,取5 μL RNA 用1%瓊脂糖凝膠進行電泳,以檢測RNA的完整性。用TIANScript cDNA第一鏈合成試劑盒進行反轉錄,根據試劑盒說明書進行操作。引物由生工生物工程(上海)股份有限公司設計合成,見表1。反應條件:95 ℃預變性15 min;95 ℃變性15 s,58 ℃退火30 s,72 ℃延伸30 s,共40個循環。以GAPDH為內參,采用2-ΔΔCt法進行相對定量分析。
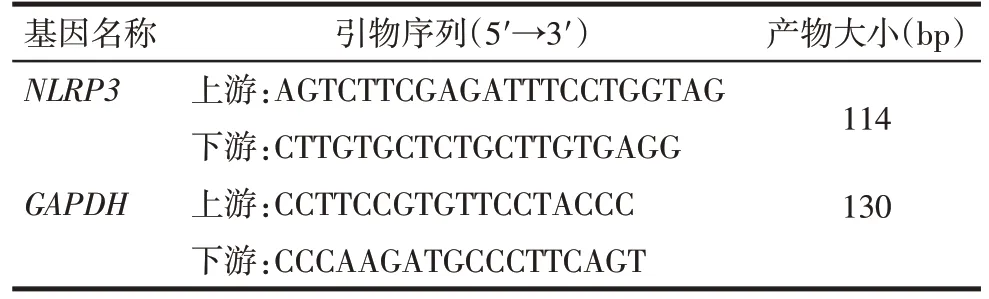
Tab.1 Primer sequences for PCR analyses表1 實時熒光定量PCR引物序列
1.2.8 Western blot 法檢測主動脈內皮細胞蛋白表達 取適量主動脈加蛋白裂解液提取蛋白,BCA法測定蛋白濃度。每孔加蛋白質約30 μg 行SDS-PAGE 電泳,電泳后再將蛋白轉移到聚偏二氟乙烯膜上(濕轉),脫脂牛奶封閉。一抗Beclin1、LC3、p62、NLRP3、Caspase-1、IL-1β、cleaved Caspase-3、β-actin 抗體(均為1∶1 000),eNOS 抗體(1∶800)4 ℃孵育過夜。洗膜孵二抗(1∶5 000),室溫下放置2 h,洗膜,曝光顯色,凝膠成像系統分析蛋白的相對表達量。β-actin作為內參,采用Quantity One軟件進行半定量分析。
1.3 統計學方法 采用SPSS 23.0軟件對數據進行分析。符合正態分布的計量資料以±s表示。在滿足方差齊性的條件下,組間多個均數比較采用單因素方差分析(ANOVA),多重比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 基線狀態及RDN 術前各組大鼠資料比較 高脂喂養前4組大鼠的收縮壓(SBP)、心率(HR)、FPG、FINS、NE、vWF、NO 水平差異均無統計學意義,見表2。RDN 術前,與CON 組比較,T2DM 組、Sham 組、RDN組大鼠SBP、HR、FPG,FINS、NE、vWF水平明顯升高,NO 水平明顯降低,差異均有統計學意義(P<0.05);T2DM組、Sham組、RDN組間兩兩比較差異無統計學意義,見表3。
2.2 RDN 術后4 周各組大鼠SBP、HR、FPG 等指標及腎臟NE 水平比較 與T2DM 組和Sham 組比較,RDN 組SBP、HR、FPG、FINS、NE、vWF 及腎臟NE 水平明顯降低,NO 水平明顯升高,差異均有統計學意義(P<0.05),T2DM組與Sham組間各指標比較差異無統計學意義,見表4。
2.3 RDN 術后4 周腎動脈HE 染色及TH 陽性表達情況 HE 染色顯示,正常腎動脈血管外膜結構完整,血管周圍可見大量神經纖維,RDN 組腎動脈血管外膜局部缺失,結構不完整,血管周圍未見明顯神經纖維,見圖1。RDN術后4周,免疫組化結果顯示,CON 組、T2DM 組、Sham 組和RDN 組的IOD 值分別為0.295±0.019、0.447±0.035、0.445±0.028、0.310±0.011;與T2DM 組和Sham 組比較,RDN 組腎動脈TH表達水平降低,差異有統計學意義(F=60.724,P<0.01),見圖2。
Tab.2 Comparison of baseline parameters between the four groups表2 各組大鼠基線狀態指標比較 (n=6,±s)
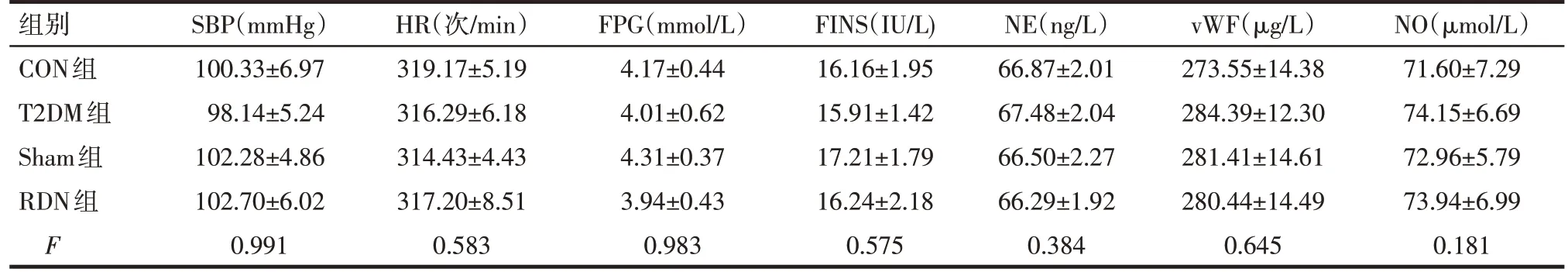
Tab.2 Comparison of baseline parameters between the four groups表2 各組大鼠基線狀態指標比較 (n=6,±s)
均P>0.05;1 mmHg=0.133 kPa。
Tab.3 Comparison of parameters before RDN between the four groups表3 RDN術前各組大鼠指標比較 (n=6,±s)
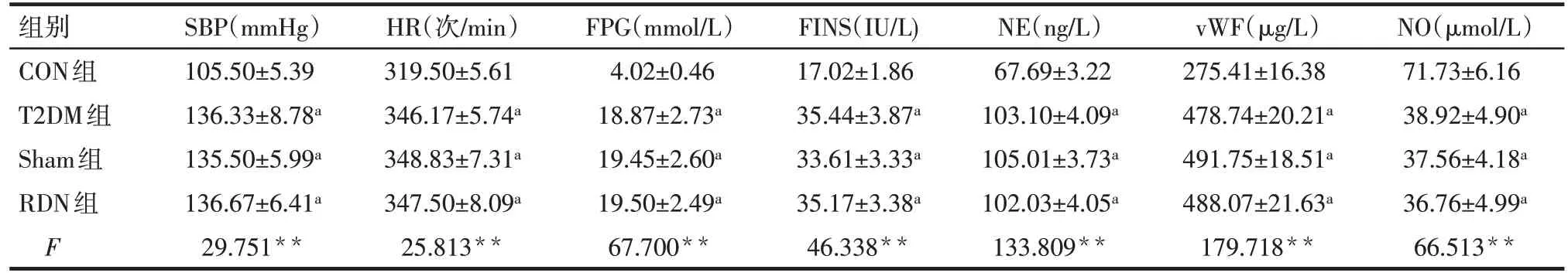
Tab.3 Comparison of parameters before RDN between the four groups表3 RDN術前各組大鼠指標比較 (n=6,±s)
**P<0.01;a與CON組比較,P<0.05。
2.4 RDN 對胸主動脈內皮細胞中自噬體的影響 RDN 術后4 周,透射電子顯微鏡下可見CON 組內皮細胞各細胞器結構清晰,僅有少量自噬體,自噬體與溶酶體融合形成較大的自噬溶酶體,自噬溶酶體內可見正在降解的受損的線粒體,見圖3A、B;T2DM 組和Sham 組可見線粒體嵴裂溶解消失,靠近線粒體雙層膜部位殘留少量線粒體嵴結構,未見明顯自噬體,見圖3C、D;RDN 組可見線粒體嵴排列紊亂,線粒體基質區域部分蛋白降解形成空泡化,自噬小體為雙層膜結構,內含被吞噬的細胞器,見圖3E、F。
2.5 RDN 對胸主動脈內皮舒張功能的影響 RDN術后4 周,與CON 組比較,T2DM 組大鼠主動脈內皮舒張功能明顯降低;與T2DM 組和Sham 組比較,RDN 組的主動脈對SNP 和Ach 舒張率升高,差異有統計學意義(P<0.05),見表5、6。
2.6 RDN 對胸主動脈內皮細胞自噬相關蛋白和cleaved Caspase-3、eNOS 蛋白的影響 RDN 術后4周,與CON組比較,T2DM組、Sham組和RDN組大鼠自噬蛋白Beclin1、LC3 水平明顯降低,p62 水平明顯升高,凋亡蛋白cleaved Caspase-3 水平升高,eNOS水平明顯降低,差異均有統計學意義(P<0.05);與T2DM 組和Sham 組比較,RDN 組Beclin1、LC3、eNOS水平明顯升高,p62、cleaved Caspase-3 水平降低,差異均有統計學意義(P<0.05),T2DM組和Sham組比較差異無統計學意義,見表7,圖4。
2.7 RDN 對胸主動脈內皮細胞NLRP3 mRNA 及NLRP3 炎癥相關蛋白表達的影響 RDN 術后4 周,與CON 組比較,T2DM 組、Sham 組和RDN 組大鼠NLRP3 mRNA及蛋白表達,Caspase-1、IL-1β蛋白表達明顯升高,差異均有統計學意義(P<0.05);與T2DM組和Sham組比較,RDN組NLRP3 mRNA及蛋白表達,Caspase-1、IL-1β 蛋白表達明顯降低,差異均有統計學意義(P<0.05),T2DM組和Sham組比較差異均無統計學意義,見表8、圖5。
Tab.4 Comparison of parameters after RDN between the four groups表4 RDN術后4周各組大鼠指標比較 (n=6,±s)
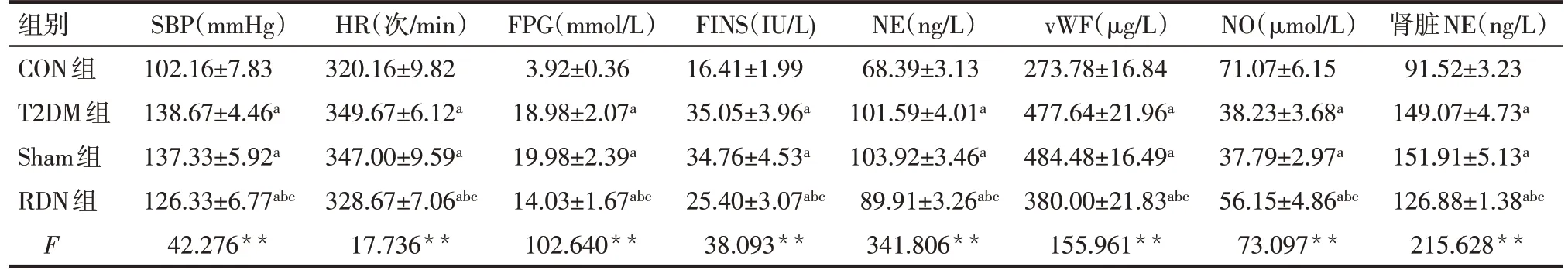
Tab.4 Comparison of parameters after RDN between the four groups表4 RDN術后4周各組大鼠指標比較 (n=6,±s)
**P<0.01;a與CON組比較,b與T2DM組比較,c與Sham組比較,P<0.05。
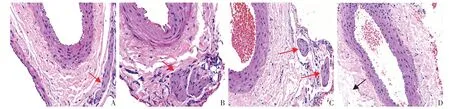
Fig.1 Comparison of histological characteristics between chemical ablated renal nerves and normal renal nerves (HE staining,×400)圖1 正常腎動脈與RDN后腎動脈周圍神經組織染色比較(HE染色,×400)
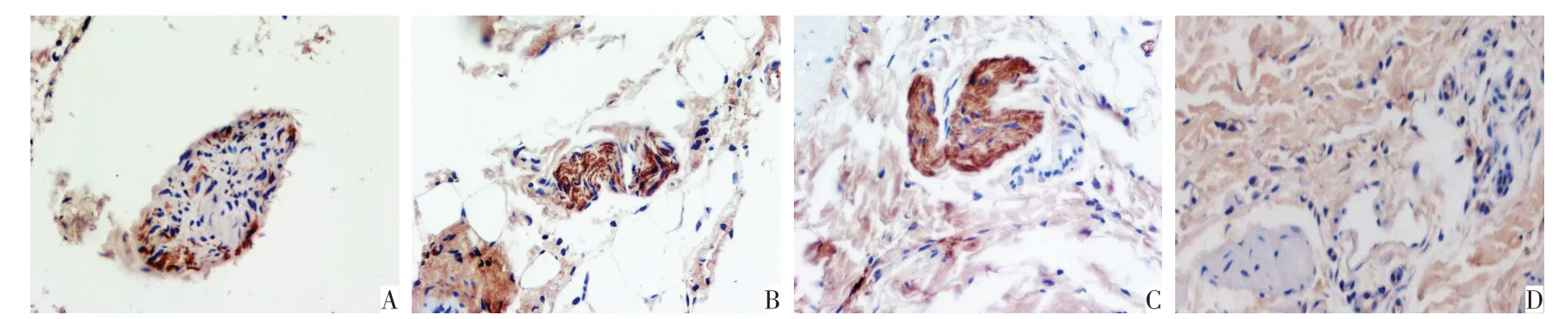
Fig.2 The expression of tyrosine hydroxylase(TH)staining in the renal artery at the end of 4 weeks after RND(Immunohistochemical staining,×400)圖2 RDN術后4周腎動脈TH表達(免疫組化染色,×400)

Fig.3 Changes of autophagosome in rat aortic endothelial cells observed by transmission electron microscope (×5 000)圖3 透視電子顯微鏡觀察胸主動脈內皮細胞自噬體的變化(×5 000)
Tab.5 Effects of SNP on the endothelial relaxation function of aorta at the end of 4 weeks after RND in the four groups表5 RDN術后4周各組間SNP對胸主動脈內皮舒張功能的影響 (n=6,%,±s)
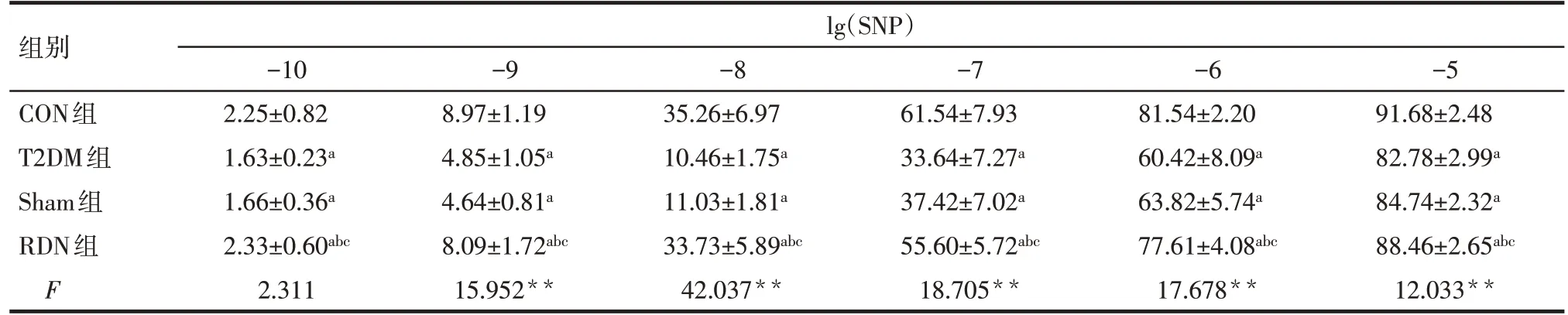
Tab.5 Effects of SNP on the endothelial relaxation function of aorta at the end of 4 weeks after RND in the four groups表5 RDN術后4周各組間SNP對胸主動脈內皮舒張功能的影響 (n=6,%,±s)
**P<0.01;a與CON組比較,b與T2DM組比較,c與Sham組比較,P<0.05;lg(SNP)為SNP濃度取常用對數值。
Tab.6 Effects of SNP on aortic relaxation to acetylcholine(Ach)at the end of 4 weeks after RND in the four groups表6 RDN術后4周各組間Ach對胸主動脈內皮舒張功能的影響 (n=6,%,±s)
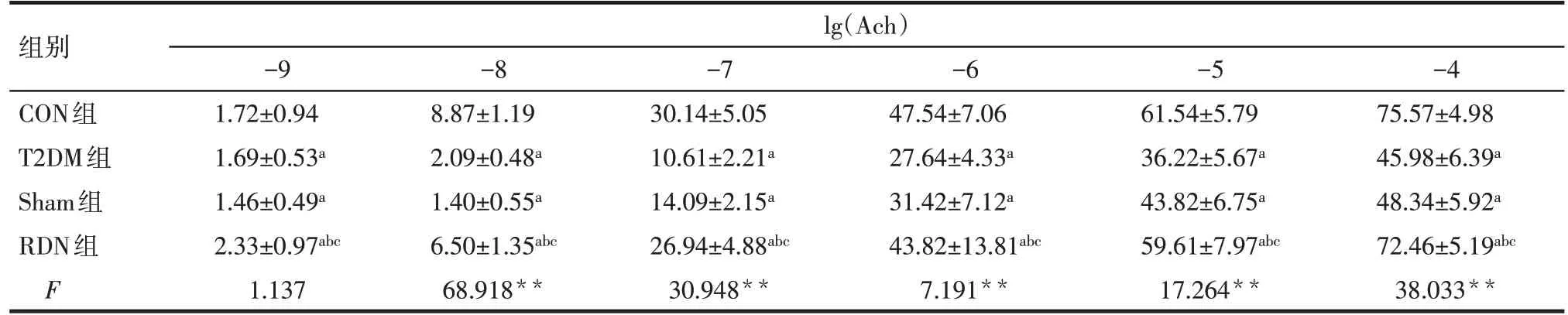
Tab.6 Effects of SNP on aortic relaxation to acetylcholine(Ach)at the end of 4 weeks after RND in the four groups表6 RDN術后4周各組間Ach對胸主動脈內皮舒張功能的影響 (n=6,%,±s)
**P<0.01;a與CON組比較,b與T2DM組比較,c與Sham組比較,P<0.05;lg(Ach)為Ach濃度取常用對數值。
Tab.7 Comparison of Beclin1,LC3,p62,cleaved Caspase-3 and eNOS protein levels in the thoracic aorta at the end of 4 weeks after RND between the four groups表7 RDN術后4周各組間胸主動脈內皮細胞Beclin1、LC3、p62、cleaved Caspase-3、eNOS蛋白水平比較 (n=6,±s)

Tab.7 Comparison of Beclin1,LC3,p62,cleaved Caspase-3 and eNOS protein levels in the thoracic aorta at the end of 4 weeks after RND between the four groups表7 RDN術后4周各組間胸主動脈內皮細胞Beclin1、LC3、p62、cleaved Caspase-3、eNOS蛋白水平比較 (n=6,±s)
**P<0.01;a與CON 組比較,b與T2DM 組比較,c與Sham 組比較,P<0.05。
3 討論
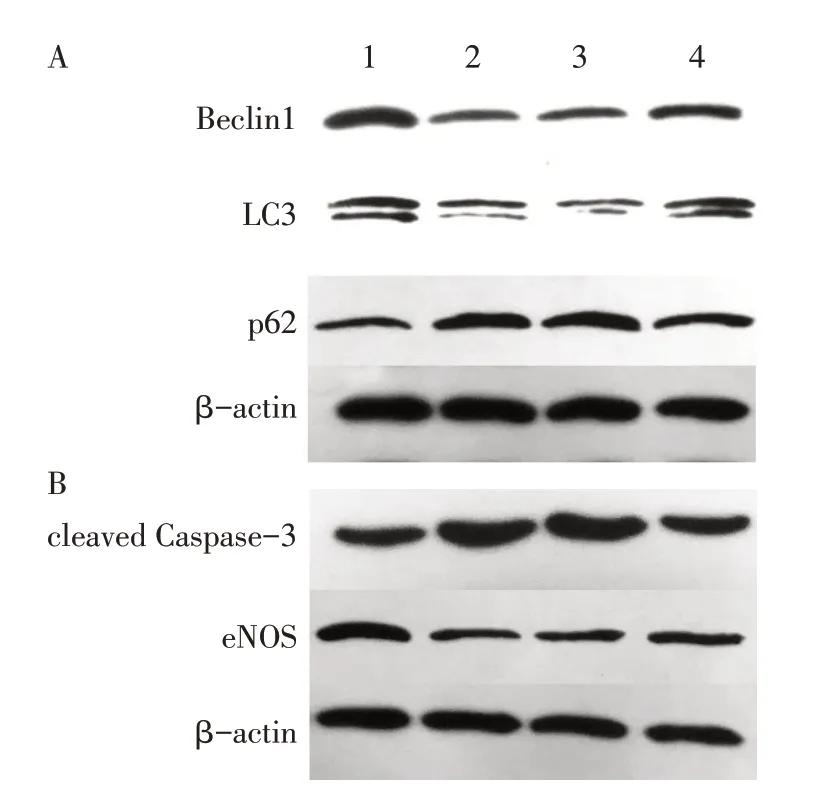
Fig.4 Beclin1,LC3,p62,cleaved Caspase-3 and eNOS protein levels at the end of 4 weeks after RND圖4 RDN術后4周各組Beclin1、LC3、p62、cleaved Caspase-3、eNOS蛋白表達
Tab.8 Comparison of expression levels of NLRP3 mRNA and other inflammatory proteins in the thoracic aorta at the end of 4 weeks after RND between the four groups表8 RDN術后4周各組胸主動脈NLRP3 mRNA、蛋白及炎癥蛋白表達水平比較 (n=6,±s)
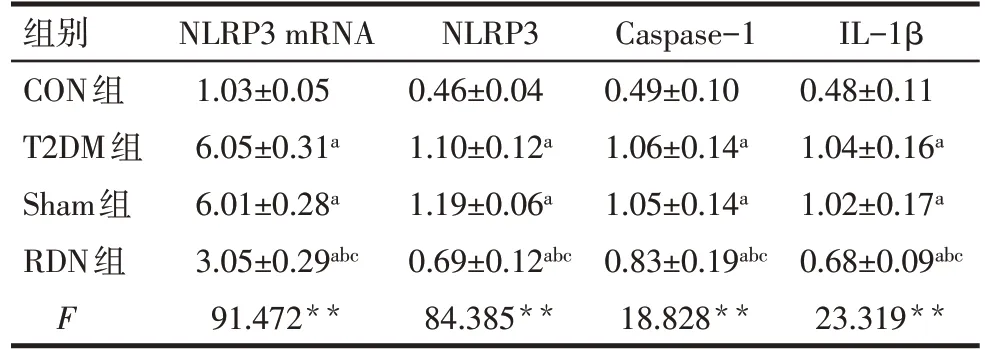
Tab.8 Comparison of expression levels of NLRP3 mRNA and other inflammatory proteins in the thoracic aorta at the end of 4 weeks after RND between the four groups表8 RDN術后4周各組胸主動脈NLRP3 mRNA、蛋白及炎癥蛋白表達水平比較 (n=6,±s)
**P<0.01;a與CON 組比較,b與T2DM 組比較,c與Sham 組比較,P<0.05。
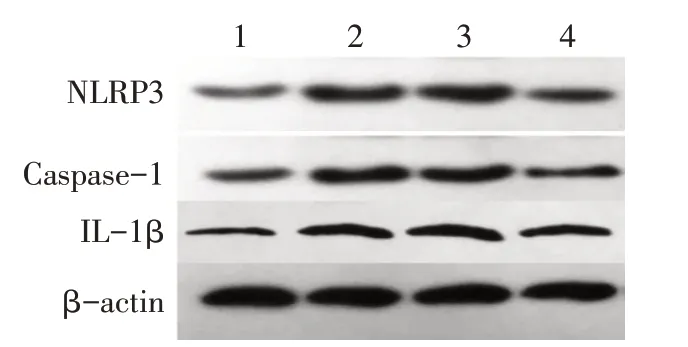
Fig.5 NLRP3,Caspase-1 and IL-1β protein levels at the end of 4 weeks after RND圖5 RDN術后4周胸主動脈內皮細胞NLRP3、Caspase-1、IL-1β蛋白表達
T2DM 引起的大血管病變嚴重影響患者的生活質量,是致死、致殘的主要原因。高血糖導致的血管內皮功能障礙是心血管疾病的基礎。交感神經興奮可促進葡萄糖的利用,增加脂肪分解和糖異生,并減少胰島素分泌,然而胰島素抵抗可使腎上腺素分泌增多,導致交感神經過度興奮,兩者之間形成惡性循環[8]。大量臨床研究及流行病學調查發現T2DM 患者交感神經活性升高[9-10]。本研究結果發現,與CON 組相比,給予高脂飲食聯合小劑量STZ 誘導的糖尿病大鼠模型HR增快、全身及腎臟NE水平和腎動脈周圍神經TH陽性表達水平升高,表明交感神經活性升高;RDN 治療后,與T2DM 和Sham 組相比,HR降低、全身及腎臟NE水平和腎動脈周圍神經TH陽性表達水平降低,表明RDN可以降低全身及局部交感神經活性。
自噬是真核生物細胞內的循環利用機制,通過形成自噬體結構,可降解或清除細胞中受損或多余的蛋白質和細胞器等成分,維持細胞的平衡。相反,自噬不足或過度會使毒性或受損分子在細胞中積聚,導致與血管內皮功能紊亂相關的疾病。研究表明,糖尿病引起的血管內皮細胞功能障礙與自噬不足密切相關[11]。本研究結果顯示,通過高脂飲食聯合小劑量STZ誘導的糖尿病大鼠模型血管內皮功能指標vWF 升高,NO 水平降低,表明內皮功能受損嚴重;血管內皮細胞eNOS 蛋白表達降低,自噬蛋白Beclin1和LC3表達降低,p62表達增加,提示糖尿病大鼠主動脈內皮功能障礙可能與自噬水平受到抑制有關。RDN 干預后能夠提高自噬水平并顯著改善受損的主動脈內皮功能,表明RDN可能通過激活自噬對糖尿病大鼠主動脈內皮功能發揮保護作用。
NLRP3炎癥小體是模式識別受體的一種大分子蛋白復合體,主要由NLRP3 蛋白、凋亡相關斑點蛋白(ASC)和無活性的Caspase-1前體組成,可通過活化Caspase-1調控IL-1β和IL-18等炎性因子的成熟和釋放,在炎癥反應中起著關鍵作用。研究發現,NLRP3炎癥小體在糖尿病及其所導致的慢性并發癥的發生發展過程中起著重要的作用[12]。李紅霞等[13]研究發現NLRP3 炎癥小體在糖尿病前期高表達,對糖尿病的早期診斷有潛在的價值。另外,活性氧在NLRP3 炎癥小體的激活過程中的重要作用受到越來越多關注。Lian 等[14]研究發現,降低活性氧水平可以抑制NLRP3炎癥小體的表達,改善內皮細胞的功能。筆者團隊前期研究發現,RDN 可能通過降低活性氧及心肌氧化應激水平改善心肌梗死犬的心臟結構和功能[15]。本研究發現,通過高脂飲食聯合小劑量STZ 誘導的糖尿病大鼠模型血管內皮NLRP3 mRNA及蛋白表達增高,Caspase-1、IL-1β蛋白表達升高,表明NLRP3炎癥復合體在內皮損傷的發生過程中起著重要作用;RDN干預后NLRP3炎癥小體水平降低并且受損的主動脈內皮功能明顯改善,表明RDN可能通過抑制NLRP3炎癥小體的表達對糖尿病大鼠主動脈內皮功能發揮保護作用,分析可能原因是RDN通過降低交感神經活性,降低氧化應激水平,抑制NLRP3炎癥復合體的表達。
自噬可以負向調控NLRP3炎癥小體的激活,從而抑制機體產生的炎癥反應,減輕疾病中產生的炎性損傷。近期Qiao 等[16]研究發現,分子伴侶介導的自噬負向調控NLRP3 炎癥小體的活化在動脈粥樣硬化抗炎治療中發揮重要作用。王明霞等[17]研究發現,胡黃連苷Ⅱ可能通過促進巨噬細胞自噬,抑制NLRP3炎癥小體的激活,抑制炎癥反應。此外,Zhou等[18]發現,小檗堿能夠促進巨噬細胞的自噬進而抑制NLRP3 炎癥小體活化,以抑制其誘導的炎癥反應,改善胰島素抵抗。本研究發現RDN術后自噬水平升高,同時NLRP3 炎癥小體表達水平降低,自噬水平的升高亦有可能負向調控NLRP3 炎癥小體的活化。
綜上所述,RDN 可以改善T2DM 大鼠的內皮功能障礙,其機制可能與增強血管內皮自噬水平、降低NLPR3炎癥小體的表達有關。但由于本研究樣本量小,觀察時間短,仍需要更多關于RDN、自噬及NLRP3炎癥復合體對T2DM血管內皮功能影響的相關研究進一步驗證。

