超說明書用藥醫療損害責任糾紛判決與循證證據的相關性分析Δ
保琦,胡琳,胡華杰,黃濤,傅孟元,海沙爾江·吾守爾,2,管曉東,2#,史錄文,2(.北京大學藥學院藥事管理與臨床藥學系,北京 009;2.北京大學醫藥管理國際研究中心,北京 009)
超說明書用藥是指藥品使用不在國家藥品主管部門批準的藥品說明書上的用法[1],包括劑量、適應人群、適應證或給藥途徑等與藥品說明書不同[2]。由于藥品說明書更新可能滯后[3],部分超說明書用藥行為存在一定合理性[4],這也一定程度上滿足了患者治療需求并促進了臨床醫學發展[5]。超說明書用藥在我國醫療機構普遍存在[6],但其會增大患者用藥風險、導致不良反應發生并引發醫療糾紛[7],其合理性常成為醫療糾紛中的主要爭議點[8]。2021年《醫師法》首次對超說明書用藥明確規定:在尚無有效或者更好治療手段等特殊情況下,醫師取得患者明確知情同意后,可以采用藥品說明書中未明確但具有循證醫學證據的藥品用法實施治療[9]。而是否具有循證證據是超說明書用藥引發的醫療損害責任糾紛判決的關鍵。本文通過對超說明書用藥引發的醫療損害責任糾紛進行實證研究,探究判決結果與超說明書用藥是否存在明確循證證據的相關性,以期為完善醫療機構超說明書用藥管理制度提供參考。
1 資料與方法
1.1 納入與排除標準
本研究的納入標準如下:研究數據來源于“北大法寶”司法案例庫(https://www.pkulaw.com/case/),案由為“民事糾紛”,檢索時間截至2021年12月31日,檢索關鍵詞為“超說明書”。案例庫分為應用案例、法寶推薦、普通案例,其中應用案例指援引指導性案例,法寶推薦指由“北大法寶”司法案例庫經過專業篩選推送的案例,普通案例指除以上參照之外各級法院審結發布的案例。
本研究的排除標準包括:(1)用藥與超說明書無關案例;(2)醫療器械案例;(3)有二審結果的案例對應的一審案例;(4)法院不予受理的民事裁定案例;(5)和解的民事裁定案例。
1.2 案例信息提取說明
根據文書內容提取案例客觀因素、主觀因素和判決結果。客觀因素包括案例時間、地區、審判程度、醫院級別等基本信息,主觀因素包括鑒定方式和患方索賠金額,判決結果包括超說明書用藥與醫療損害因果關系、醫方責任等級和總賠償金額。本研究涉及的分類變量情況及分類依據見表1。

表1 超說明書用藥醫療損害責任糾紛信息提取變量情況及分類依據
1.3 超說明書用藥循證證據
參考廣東省藥學會《超說明書用藥目錄》的收錄標準[11]和《超說明書用藥循證評價規范》[12],在案例審結日期前滿足下列條件之一的超說明書用藥,被認為具有循證證據:(1)該用法被美國、歐盟、日本的藥品說明書收錄(美國FDA官網www.fda.gov;歐盟EMA官網http://www.ema.europa.eu/ema;日本 PDMA 官網 http://www.pmda.go.jp);(2)該用法被《中國藥典臨床用藥須知(2015年版)》以及《臨床診療指南(2020年版)》(中華醫學會著,人民衛生出版社)收錄;(3)查詢以循證為基礎的藥典知識庫系統Micromedex?,結果為有效、推薦等級Ⅱb、證據等級B級或以上;(4)對于Micromedex?未收載的超說明書用藥,依據Micromedex?的Thomson循證等級的分級定義,通過PubMed、Cochrane和Embase數據庫檢索相關文獻判定為有效、推薦等級Ⅱb、證據等級B級或以上[2]。
1.4 統計學方法
對案例中提取的客觀因素、主觀因素和判決結果進行描述性分析,采用χ2檢驗分析超說明書用藥-醫療損害因果關系與循證證據的關系、循證證據與主觀因素中鑒定方式的關系;采用非參數檢驗分析醫方責任比例及總賠償金額與循證證據的關系、循證證據與主觀因素中的索賠金額的關系。檢驗水準α=0.05。本研究使用Excel 2019軟件建立數據庫,使用Stata 14.0軟件對案例特征進行描述性分析和單因素分析。
2 結果
2.1 超說明書用藥引發醫療損害責任糾紛案例的基本特征
本研究按照檢索方案共獲取98例案例,經過剔除,最終納入57例案例,檢索流程見圖1。
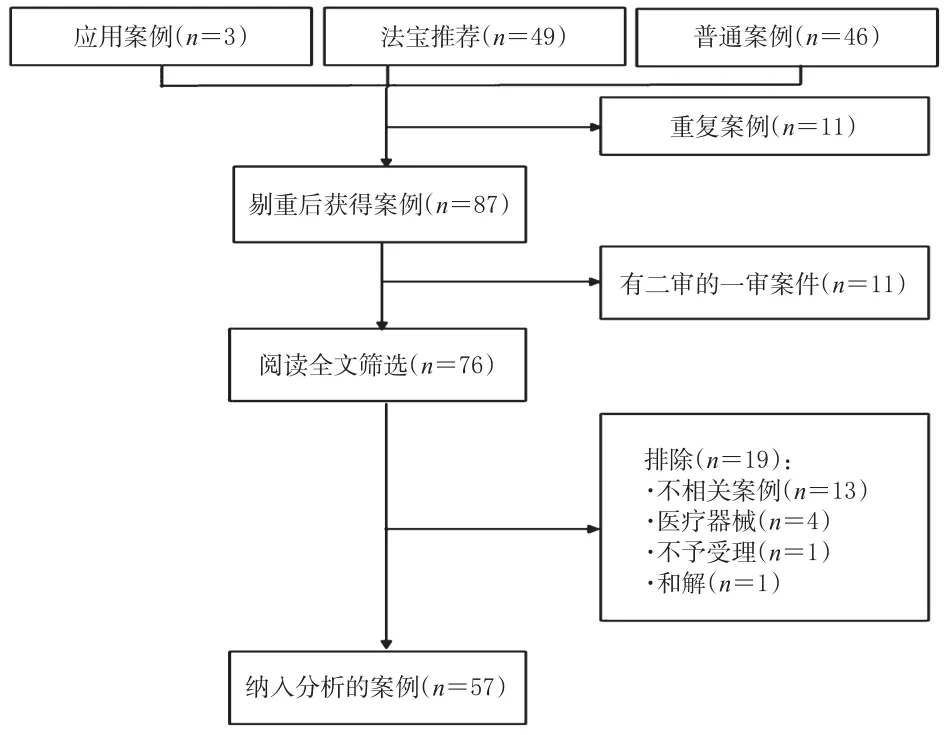
圖1 案例篩選流程及結果
描述性統計結果顯示:(1)案例主要發生在我國東部地區(63.2%)、三級醫院(64.9%),且上訴二審較多(61.4%)。(2)案例共涉及80種藥品,其中包括化學藥71種、中成藥9種。化學藥中數量最多的種類為抗血栓形成藥(B01)和系統用抗菌藥物(J01),均為7種;中成藥中有8種為中藥注射劑。(3)研究涉及的超說明書用藥分類,主要為超劑量用藥(45.6%)和超適應證用藥(40.4%)。(4)案例的主觀因素中,鑒定機構主要為鑒定中心或鑒定所(61.4%),委托醫學會鑒定的相對少(24.6%);案例的患方索賠金額主要在25萬~<50萬元(36.8%)。(5)案例的判定結果中,超說明書用藥被判定為與醫療損害無因果關系34例(59.7%),有因果關系23例(40.4%);醫方承擔次要責任居多(28.1%);多數案例的實際賠償金額少于10萬元(54.4%)。(6)案例中有32例(56.1%)無循證證據,25例(43.9%)有循證證據。案例的主要基本情況見表2。
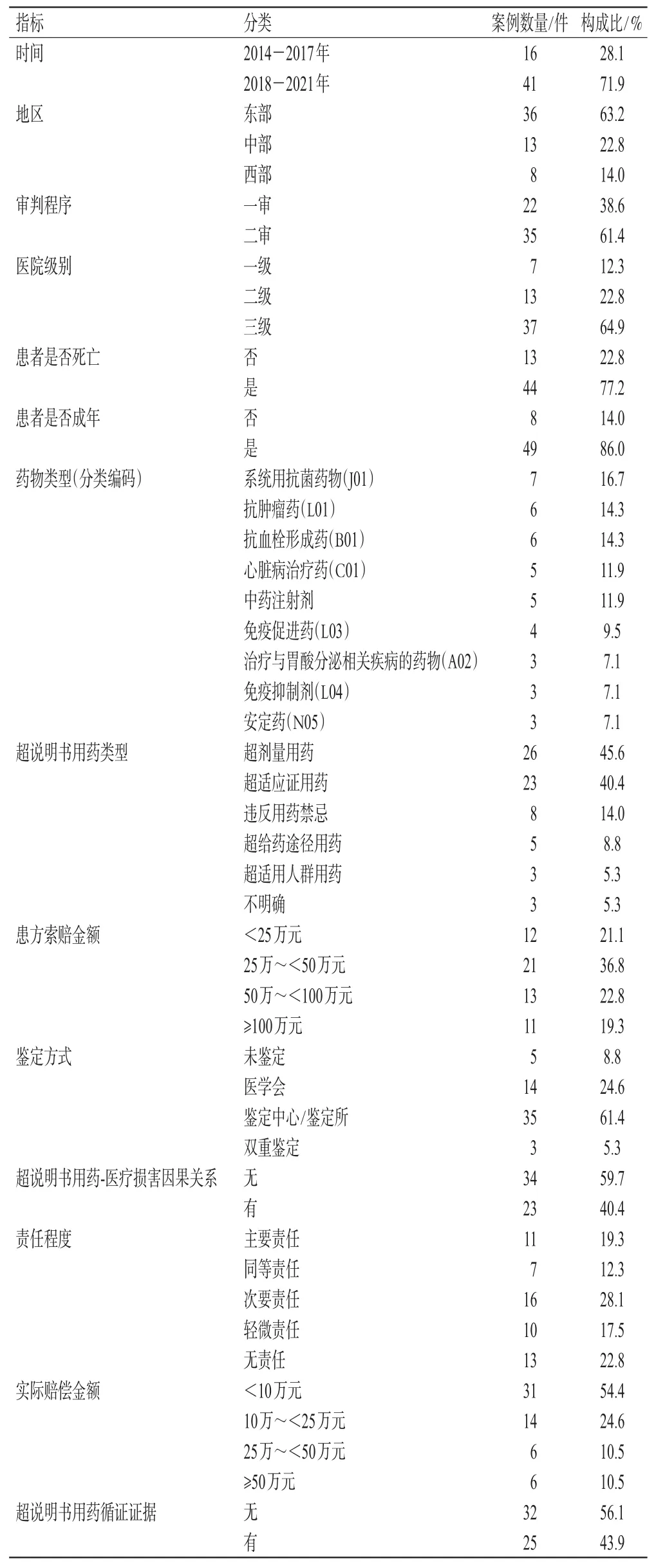
表2 超說明書用藥引發醫療損害責任糾紛案例基本情況
2.2 超說明書用藥引發醫療損害責任糾紛案例的循證證據與判決結果的相關性
單因素分析結果顯示,超說明書用藥無循證證據的案例中,超說明書用藥被判決為與醫療損害有因果關系的比例高于有循證證據的案例,但差異無統計學意義(P=0.256);超說明書用藥無循證證據的案例醫方平均責任比例高于有循證證據的案例,但差異無統計學意義(P=0.598);超說明書用藥無循證證據案例的例均賠償金額為14.9萬元,與有循證證據案例賠償金額(19.8萬元)的差異無統計學意義(P=0.741),詳見表3。
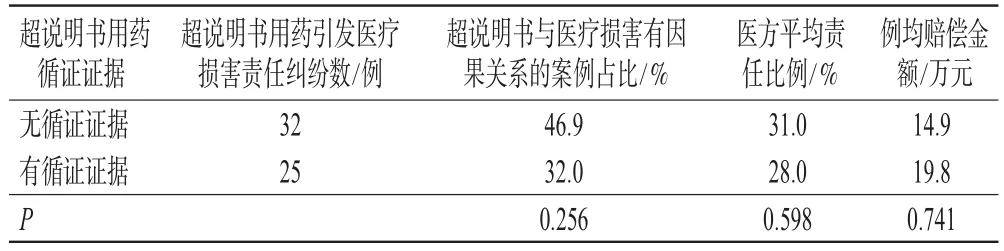
表3 超說明書用藥有無循證證據的醫療損害責任糾紛的判決結果
2.3 超說明書用藥引發醫療損害責任糾紛案例的循證證據與主觀因素的相關性
單因素分析結果顯示,鑒定機構的選擇差異無統計學意義(P=0.260、0.931、0.847)。而超說明書用藥無循證證據的案例例均索賠金額為47.9萬元,有循證證據的案例例均索賠金額為71.6萬元,有循證證據的案例例均索賠金額顯著高于無循證證據的案例(P=0.040),詳見表4。

表4 超說明書用藥有無循證證據的醫療損害責任糾紛的主觀因素
3 討論
3.1 超說明書用藥有無循證證據與判決結果無顯著相關性
《醫師法》第二十九條規定:“在尚無有效或者更好治療手段等特殊情況下,醫師取得患者明確知情同意后,可以采用藥品說明書中未明確但具有循證醫學證據的藥品用法實施治療”[9]。具備循證證據和知情同意,是超說明書用藥合法的必要條件,二者缺一不可。本研究結果顯示,57例糾紛案例中25例(43.9%)具有循證證據,僅1例(1.75%)取得患者知情同意但告知不充分。循證醫學證據本質上是一種技術性資料,并不產生法律效力[13]。本研究結果一定程度上說明,超說明書用藥雖具有循證證據,但并不能對法律風險形成有效保護。臨床藥師應充分發揮其職能,提前介入處方審核[14];醫院要建立規范統一的超說明書用藥管理制度,在臨床應用和司法判決中形成共識,重點保護患者知情同意權,規范告知患者用藥理由、治療方案、預期效果及可能出現的風險并尊重其意見,根據風險程度、用藥目的等因素告知患者并簽署知情同意書[15]。這不僅利于醫方提高認識,知曉法律風險,使得有循證證據的超說明書用藥得到合法保護;也利于患者維護自身權益,減少不規范的超說明書用藥行為和醫療損害責任糾紛。
3.2 超說明書用藥循證證據與鑒定機構無顯著相關關系,與索賠金額呈負相關
超說明書用藥引發醫療損害責任糾紛中認定醫院是否承擔責任主要依靠鑒定結果[7]。我國醫療鑒定制度主要是醫學會進行的醫療事故技術鑒定和鑒定所進行的醫療過失司法鑒定并行的“雙軌制”[16]。本研究結果顯示,借助鑒定中心或鑒定所進行鑒定的案例比醫學會多,但不受循證證據有無的影響。借助醫學會鑒定的案例中,醫方的賠償比例更低[17]。由于醫學會的鑒定缺乏實質中立性,案例相關方更傾向于選擇鑒定所作為鑒定機構[18]。與此同時,索賠金額受地區經濟發展程度、患者損害嚴重程度等客觀因素的影響[14]。本研究結果顯示,有循證證據的超說明書案例索賠金額更高,這也導致這些案例雖然醫方責任比例略低,但實際賠償金額更高。隨著《醫療糾紛預防和處理條例》[19]的發布,管理部門需要進一步推進構建“一元化”醫療損害鑒定制度,并建立規范合理的索賠金額依據,維護司法權威并促進醫藥衛生事業發展。
3.3 抗菌藥物的循證證據和抗癌藥物使用的判決結果問題突出
本研究中抗菌藥物超說明書使用引發糾紛的原因在于無指征使用和過量使用,一般缺乏循證證據支持。抗菌藥物的濫用已導致嚴重的細菌耐藥性[20],農村地區濫用抗菌藥物問題尤為突出[21]。社會要進一步加強宣傳,明確遵守抗菌藥物臨床使用指南,規范抗菌藥物的使用。抗癌藥物主要包括抗腫瘤藥(L01)和免疫機能調節藥(L03、L04)。由于腫瘤治療理念不斷提升,腫瘤靶向和免疫療法迅速發展等原因,抗癌藥物是臨床上超說明書用藥的主要類型之一[22]。本研究中由于案例中癌癥患者死亡率較高,雖然多數案例具有循證證據,但醫方仍然承擔了較高的責任比例和賠償金額。因此,要改善抗癌藥物的超說明書使用現狀,一方面要鼓勵藥品研發商及時更新說明書,因為藥品說明書的法律效力最為明確;另一方面也要在臨床應用時推進分級管理方案[23],加強與患者的溝通,嚴格落實知情同意,在保障患者權益的同時,規避醫方的執業風險。
3.4 局限性
本研究存在一定的局限性:(1)研究選用的“北大法寶”數據庫及檢索方式所得案例對我國超說明書用藥醫療損害責任糾紛的代表性有限;(2)部分案例判決文書信息缺失,可提取的客觀因素和主觀因素有限;(3)部分案例醫方具有超說明書用藥以外的診療過錯,影響超說明書用藥醫療損害責任糾紛判決結果與循證證據的相關性判斷;(4)由于研究納入樣本量有限,采用χ2檢驗與非參數檢驗的方法分析超說明書用藥醫療損害責任糾紛判決結果與循證證據的相關性,并未有效控制患者受害程度、地區經濟水平等因素的影響。
4 結論
超說明書用藥醫療損害責任糾紛判決結果與循證證據無顯著相關性,但循證證據、索賠金額、藥物類型等可能是影響判決結果的相關因素。本研究結果說明司法審判與醫學科學間可能存在一定分歧。醫院應發揮藥師職能,建立完善的超說明書用藥管理制度,保證超說明書用藥知情同意;國家、司法機構、醫學會和鑒定所管理部門要規范醫療損害鑒定制度和索賠金額依據,并重點關注抗菌藥物、抗癌藥物的使用。

