北部灣沿岸三種常見赤潮藻類對浮游微食物網主要類群的影響
陸家昌,陸敏楨,李 杰,賴俊翔,莊軍蓮
(廣西科學院、廣西北部灣海洋研究中心、廣西近海海洋環境科學重點實驗室,廣西 南寧 530007)
浮游植物是海洋初級生產者,通過光合作用將水體中的無機營養轉化成顆粒有機物。在浮游植物的生產中,約有一半的初級生產以溶解有機物的形式釋放到水體中[1]。浮游細菌利用水體中的溶解有機物進行生產,并通過微食物網中微型鞭毛蟲(nanoflagellate, NF)和纖毛蟲等原生動物的攝食,將細菌的生產向更高營養級傳遞,從而使得這部分初級生產重新回到經典食物網中[2-3]。異養細菌、微型鞭毛蟲和纖毛蟲是微食物網中的重要組成類群[4],自然水體中,浮游植物與微食物網各類群之間關系復雜。一方面,浮游細菌和大部分含色素體微型鞭毛蟲(pigmented nanoflagellate, PNF)可以與藻類競爭營養鹽[5];另一方面,異養細菌的分解和纖毛蟲等原生動物的排泄又是營養鹽再生的重要途徑,特別是在貧營養海區,這一途徑又是浮游植物生長所需營養鹽的重要來源[6-8]。此外,異養微型鞭毛蟲(heterotrophic nanoflagellate, HNF)和纖毛蟲又可以作為捕食者,直接以合適粒徑的浮游植物為食,對浮游植物形成下行控制[9-10]。
適宜條件下,浮游植物暴發性增殖形成藻華,積累大量顆粒有機物。藻華衰亡后,沉降到底部,其中的有機物通過異養細菌的分解進入微食物網,在藻華的衰亡、分解過程中,微食物網發揮著重要作用[11]。此外,微食物網的結構和功能也是近岸浮游植物群落變化的重要調節因素,其在營養鹽循環中的作用對藻華的形成具有重要影響[12]。因此,了解不同赤潮種與微食物網結構和功能之間的關系,有助于認識藻華形成和衰亡過程中微食物網的功能和作用。
不同類群的浮游植物的生理生態特性不同,其對光照、溫度、營養鹽等環境因子的適應性也有差異,因此不同種類的藻華的暴發也具有一定時序性,比如,甲藻赤潮一般出現在硅藻藻華之后,而球形棕囊藻(Phaeocystisglobosa)赤潮多出現在較寒冷的季節[13-15]。然而,這種時序性并不是一成不變的。野外調查發現,紅色哈卡藻(Akashiwosanguinea)、球形棕囊藻和中肋骨條藻(Skeletonemacostatum)都曾在水溫20 ℃左右形成藻華[16-18]。此外,不同原因種藻華對海洋環境的影響也不相同。一般認為,除可能分解耗氧,在海洋底部形成缺氧區外,大部分的硅藻藻華對海洋環境是無害的,甚至有些種類硅藻的藻華對漁業生產還可能是有益的[19]。而紅色哈卡藻和球形棕囊藻會分泌毒素、在海水表面形成泡沫,對海洋環境和漁業生產造成危害,形成的藻華被認為是有害藻華[20-22]。本研究以自然水體中的微食物網為研究對象,以中肋骨條藻這一北部灣近岸常見的硅藻為對照,通過向自然水體中引入浮游植物的方法,分別比較有毒有害的紅色哈卡藻、球形棕囊藻與中肋骨條藻對微食物網主要類群影響的差異。本研究有助于認識微食物網在北部灣近岸有毒有害藻華形成和衰亡過程中的作用。
1 材料與方法
1.1 實驗設計
實驗所需微食物網主要生物類群通過采集自然海水的方式獲得。海水采樣體積為100 L,于2019年3月19日采自北部灣近岸海域(21.528 144°N,108.168 819°E),采樣站位水深為5.3 m,采水深度為0.5 m,采樣時水溫為19.2 ℃,鹽度為30.5。自然海水中的葉綠素a濃度為3.62 μg /L,浮游植物以硅藻為主。
在重力作用下以200 μm孔徑篩絹反復過濾自然海水水樣3次去除捕食者后,分裝到容積為15 L的透明塑料瓶中,每個塑料瓶裝10 L。實驗所用中肋骨條藻、紅色哈卡藻和球形棕囊藻游離單細胞均由廣西北部灣海洋研究中心藻種室提供,培養溫度為20.0 ℃,光照強度4 500 lx,光照和黑暗時間為12 h∶12 h。將中肋骨條藻、紅色哈卡藻和球形棕囊藻游離單細胞按8 μg/L的葉綠素a終濃度引入實驗水體,3種藻類接種后,水體中最終的細胞密度分別為(1.83±0.37)×104、(4.75±0.45)×102、(5.23±1.23)×105cells/mL。每個處理設3個平行。實驗以添加中肋骨條藻這一北部灣近岸海域常見的硅藻為對照組,分別比較有毒有害的紅色哈卡藻、球形棕囊藻與中肋骨條藻對微食物網主要類群影響的差異。由于過濾去除捕食者后,培養過程中自然海水中會自發形成優勢種,因此實驗不設置空白海水組,而以第0 天的結果作為代表。為去除原f/2培養液[23]的干擾,微藻在進行實驗前先在3 500 r/min下離心5 min,再以不含營養鹽的人工海水再懸浮。離心前,先通過預實驗確定轉速和離心時間,以確保離心不會對藻細胞造成損傷。實驗在控溫培養箱中進行,實驗溫度為20 ℃,光照強度(4 290±730) lx,設置光照和黑暗時間為12 h∶12 h。培養2 d后,添加藻類均成為絕對優勢種,顯微鏡下很難再找到原來的藻類。實驗用球形棕囊藻為游離單細胞藻,實驗過程中未見形成囊體,流式細胞分析表明其為球形棕囊藻的單細胞體。實驗于每天上午9:00左右采樣,采樣前先輕輕搖晃,混合均勻。分別取2 mL和10 mL水樣用于細菌和微型鞭毛蟲計數,取50 mL水樣用于營養鹽濃度測定,取100 mL水樣進行藻細胞計數,每個樣品取3個平行樣。由于培養體積有限,實驗僅在開始和結束時對纖毛蟲樣品進行取樣,取樣體積為1.5 L。
1.2 細菌和微型鞭毛蟲的計數
用于細菌和微型鞭毛蟲分析的水樣先以終濃度為0.5%(體積分數)的戊二醛進行固定,并以終濃度為10 μg/mL的4’,6-二脒基-2-苯基吲哚避光條件下染色10 min,而后低壓過濾(<13.33 kPa)到黑膜(聚碳酸酯濾膜,孔徑為0.22 μm)上制成玻片,于-20 ℃保存。玻片在熒光顯微鏡下進行鏡檢,紫外激發光下計數細菌數量,計數數量不少于300個。紫外激發光下找到微型鞭毛蟲細胞,再切換到藍光下確認該鞭毛蟲是否有自發紅色熒光,有自發紅色熒光的是含色素體微型鞭毛蟲,沒有的是異養微型鞭毛蟲。通過顯微鏡(Nikon 80i)自帶的軟件系統(NIS-elements V3)對微型鞭毛蟲的細胞粒徑進行測量,根據粒徑的大小,分別將異養微型鞭毛蟲和含色素體微型鞭毛蟲劃分為2~5、>5~10、>10~20 μm 3個類群。為確保鏡檢結果的可靠性,需保證計數的微型鞭毛蟲的個體總數不少于100個[24]。
1.3 纖毛蟲和藻細胞的計數
實驗前后,不同培養瓶中各取1.5 L水樣裝入塑料樣品瓶中,以Lugol’s液固定,終濃度為1%(體積分數)。樣品于陰涼處自然沉淀48 h后,以虹吸管將上清液小心吸出,濃縮到剩余約120 mL。分兩次吸取30 mL濃縮液于倒置顯微鏡下觀察計數纖毛蟲的個體密度。本研究不對纖毛蟲種類進行鑒定,而只對其個體密度進行計數。另外,每天從培養瓶中取5 mL水樣,加Lugol’s液固定后直接于倒置顯微鏡下觀察計數藻細胞密度。
1.4 營養鹽濃度的測定
所有與營養鹽濃度測定相關的實驗器具均以1 mol /L的HCl進行浸泡,并用去離子水洗凈。水樣經0.45 μm孔徑的醋酸纖維濾膜過濾后于-20 ℃冰箱中儲存。實驗結束后應用荷蘭Skalar公司生產的營養鹽自動分析儀對溶解無機氮(dissolved inorganic nitrogen, DIN)和溶解活性磷酸鹽濃度進行測定,其中溶解無機氮是硝酸鹽、亞硝酸鹽和氨氮3項之和。
1.5 數據處理
數據以平均值±標準差的形式表示,使用SPSS 16.0軟件對數據進行統計學處理,置信區間設為95%,組間參數比較在符合正態分布或近似正態分布及方差整齊前提下進行。時間序列的培養實驗中,營養鹽濃度、微型鞭毛蟲個體密度和細菌的細胞密度的變化都不是獨立的,它們是前一個時間點的結果的延續,前一個時間點的結果對其后的結果存在影響。對于具有時間序列的延續性數據,采用重復測量方差分析(repeated measured ANOVA)法進行分析。實驗前后各組間纖毛蟲個體密度的差異采用Turkey HSD進行比較。
2 結果與討論
2.1 浮游植物的密度變化
3種藻細胞的密度均在接種后迅速增加,中肋骨條藻的細胞密度在接種第4天達到峰值(7.02±0.08)×105cells/mL,紅色哈卡藻在第5天達到峰值(11.65±0.08)×102cells/mL,而球形棕囊藻游離單細胞的迅速增殖期只有2 d,峰值為(17.25±1.16)×105cells/mL。中肋骨條藻和紅色哈卡藻細胞在經歷4~5 d的增殖后迅速衰亡,但球形棕囊藻游離單細胞在2 d的迅速增殖后并未衰亡,其細胞密度一直維持相對穩定[(18.92±1.42)×105cells/mL],直至實驗結束(圖1)。

圖1 不同添加組浮游植物細胞密度的變化Fig. 1 Variations of the phytoplankton density among different treatments
2.2 營養鹽濃度的變化
實驗起始時,水體中的磷酸鹽濃度為(0.21±0.00) μmol/L,溶解無機氮的濃度為(51.52±0.68)μmol/L。實驗水體是一個氮過剩,而磷缺乏的系統。浮游植物的生長受磷酸鹽的限制。不同浮游植物對營養鹽的利用不同,球形棕囊藻添加組在第二天即將磷酸鹽消耗殆盡,第二天后系統中的磷酸鹽濃度一直維持在極低水平(約為0.06 μmol/L)。紅色哈卡藻雖然在第5天后開始衰敗,但水體中的磷酸鹽濃度從實驗開始就一直降低,直至實驗結束時,水體中磷酸鹽濃度降至0.09 μmol/L。實驗開始后中肋骨條藻快速增殖,迅速消耗水中磷酸鹽,在第5天時,磷酸鹽濃度降至最低,與其他兩種藻不同,中肋骨條藻在衰亡后迅速向水體中釋放磷酸鹽。第5天后水體中磷酸鹽濃度開始升高,實驗結束時,水體中磷酸鹽濃度與實驗起始時比,恢復了79%(0.17 μmol /L,圖2)。
球形棕囊藻添加組中溶解無機氮濃度顯著低于其他兩組(P<0.05),而中肋骨條藻和紅色哈卡藻添加組中溶解無機氮濃度無顯著差異(P>0.05)。與實驗初始溶解無機氮濃度相比,實驗結束時,紅色哈卡藻添加組中溶解無機氮濃度降低了19.80%,中肋骨條藻添加組降低了7.37%。中肋骨條藻和紅色哈卡藻添加組中溶解無機氮濃度在前7天類似。除了第4天大幅變動外,球形棕囊藻添加組中溶解無機氮濃度的變化與磷酸鹽濃度變化類似,在迅速降低后,該組溶解無機氮在低濃度狀態下保持相對平衡,實驗結束時,球形棕囊藻添加組溶解無機氮濃度降低了90.21%(圖2)。
2.3 浮游細菌的密度變化
實驗起始時,水體中浮游細菌的細胞密度為(7.97±0.99)×106cells/mL,實驗結束時,各實驗組的浮游細菌的細胞密度均有所提高。此時,中肋骨條藻、紅色哈卡藻和球形棕囊藻添加組浮游細菌細胞密度分別為(21.93±2.20)×106、(10.23±2.35)×106、(13.28±0.96)×106cells/mL。實驗過程中,中肋骨條藻添加組的浮游細菌的細胞密度顯著高于其他兩組(P<0.05),而球形棕囊藻和紅色哈卡藻添加組浮游細菌的細胞密度無顯著差異(P>0.05,圖3)。
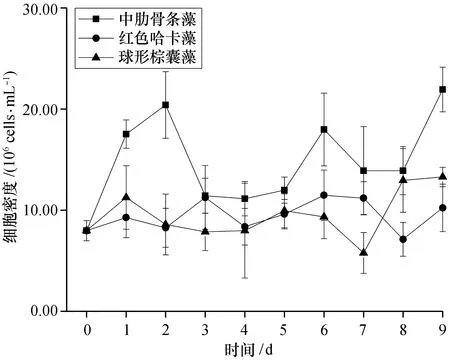
圖3 不同添加組異養細菌細胞密度的變化Fig. 3 Variations of the density of heterotrophic bacteriaamong different treatments
2.4 微型鞭毛蟲的密度變化
紅色哈卡藻添加組的含色素體微型鞭毛蟲的密度高于中肋骨條藻和球形棕囊藻添加組。紅色哈卡藻添加組的異養微型鞭毛蟲和含色素體微型鞭毛蟲的密度均顯著高于中肋骨條藻和球形棕囊藻添加組(P<0.05)。雖然球形棕囊藻添加組異養微型鞭毛蟲的密度與中肋骨條藻無顯著差異(P>0.05),但是球形棕囊藻添加組含色素體微型鞭毛蟲的密度顯著低于中肋骨條藻(P<0.05,圖4)。較之中肋骨條藻,紅色哈卡藻添加組2~5 μm 異養微型鞭毛蟲、>5~10 μm異養微型鞭毛蟲、2~5 μm 含色素體微型鞭毛蟲和>5~10 μm 含色素體微型鞭毛蟲的密度顯著提高(P<0.05,圖5)。雖然球形棕囊藻添加組2~5 μm 異養微型鞭毛蟲密度與中肋骨條藻添加組無顯著差異(P>0.05),甚至除個別時間點外,球形棕囊藻添加組2~5 μm 異養微型鞭毛蟲密度明顯高于中肋骨條藻添加組,但是,球形棕囊藻添加組>5~10 μm 異養微型鞭毛蟲、2~5 μm 含色素體微型鞭毛蟲和>5~10 μm 含色素體微型鞭毛蟲密度顯著低于中肋骨條藻添加組(P<0.05,圖5)。

圖4 不同添加組異養微型鞭毛蟲和含色素體微型鞭毛蟲的個體密度變化Fig. 4 Variations of HNF and PNF densities among different treatments

圖5 不同添加組不同粒徑微型鞭毛蟲的個體密度變化Fig. 5 Size-dependent variations of nanoflagellate density among different treatments
除第2天外,無論是生長還是衰退,所有組的HNF/PNF的比值均大于1。實驗開始時,實驗水體處于磷限制狀態。此時,HNF/PNF的比值為12.7±0.2,表明營養鹽限制條件下,微型鞭毛蟲群落偏向于異養。雖然統計結果顯示無顯著差異(P>0.05),但在藻類生長階段,紅色哈卡藻添加組比中肋骨條藻添加組更偏向異養,而在衰亡階段,紅色哈卡藻添加組和中肋骨條藻添加組無明顯差異。較之紅色哈卡藻和中肋骨條藻,球形棕囊藻添加組的微型鞭毛蟲群落顯著偏向于異養(P<0.05,圖6)。
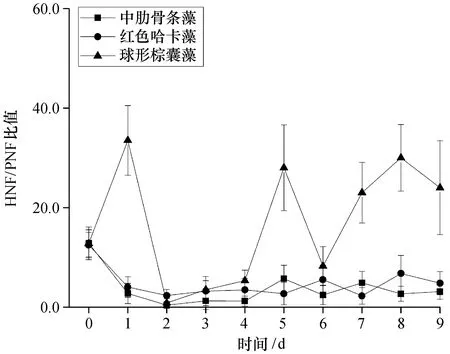
圖6 不同添加組HNF和PNF的比值Fig. 6 Ratio of HNF to PNF among different treatments
2.5 纖毛蟲的密度比較
實驗開始時,中肋骨條藻、紅色哈卡藻和球形棕囊藻添加組纖毛蟲的個體密度分別為(12.12±3.56)×103、(13.43±1.01)×103、(13.79±6.52)×103ind/L,各組之間無顯著差異(P>0.05)。由于已經過濾去除捕食者,較之實驗開始時,實驗結束時纖毛蟲的密度均顯著提高(P<0.05),實驗結束時中肋骨條藻、紅色哈卡藻和球形棕囊藻添加組纖毛蟲的個體密度分別為(1 192.92±714.96)×103、(1 480.83±214.95)×103、(142.88 ±34.78)×103ind/L。各組間纖毛蟲密度差異顯著(P<0.05),纖毛蟲密度紅色哈卡藻添加組>中肋骨條藻添加組>球形棕囊藻添加組(圖7)。

圖7 不同添加組纖毛蟲個體密度的比較Fig. 7 Comparisons on the density of ciliates among different treatments“*”表示同種藻類添加組在實驗開始和結束時纖毛蟲密度差異顯著,P<0.05;小寫字母表示實驗開始時,各藻類添加組間纖毛蟲密度的差異,字母相同,表示差異不顯著,P>0.05;大寫字母表示實驗結束時,各藻類添加組間纖毛蟲密度的差異,字母不同表示差異顯著,P<0.05。
2.6 討論
2.6.1 球形棕囊藻對微食物網的影響 實驗用球形棕囊藻游離單細胞為單倍體。棕囊藻屬的種類可以形成單倍體以適應貧營養條件[20,25],實驗結果也表明在磷酸鹽幾乎耗盡的情況下,球形棕囊藻游離單細胞數量仍維持穩定,并未衰亡(圖1、2),這也與我們在藻種室的日常培養中觀察到的球形棕囊藻游離細胞在指數生長期后仍然保持長時間穩定的現象相符。較之大粒徑的硅藻和甲藻,小粒徑浮游植物在對營養鹽的競爭中更具優勢[26]。實驗中,球形棕囊藻添加組的磷酸鹽在2 d后降到最低值,而中肋骨條藻添加組需要5 d,紅色哈卡藻添加組需要9 d(圖2)。實驗所用球形棕囊藻細胞粒徑微小,只有4 μm左右,可與含色素體微型鞭毛蟲競爭營養鹽,從而降低微食物網中含色素體微型鞭毛蟲的密度(圖4)。由于含色素體微型鞭毛蟲密度的降低遠大于異養微型鞭毛蟲密度的降低(圖4、6),從而導致球形棕囊藻添加組微型鞭毛蟲的營養結構(HNF/PNF)偏向異養(圖6)。實驗中,各組HNF/PNF的比值均大于1,通常情況下,富營養水體中該值小于1[27-28];就絕對值而言,實驗水體是一個氮豐富的系統,但又同時是一個磷限制的系統(圖2),磷的限制可能是導致這一現象的一個重要原因。球形棕囊藻不僅缺乏后生動物生長所必須的脂肪酸[比如二十碳五烯酸 (EPA)、二十二碳六烯酸 (DHA) 等],還可產生二甲基硫、丙烯酸等有毒有害物質,導致浮游動物中毒死亡[29-31]。雖然球形棕囊藻對原生動物的影響尚有爭議[32-33],但不能排除球形棕囊藻也可能對原生動物存在毒害作用,從而導致球形棕囊藻添加組纖毛蟲的密度在實驗結束時顯著低于紅色哈卡藻和中肋骨條藻添加組(P<0.05,圖7)。雖然統計結果差異不顯著(P>0.05),但實驗后期,球形棕囊藻添加組>5 ~10 μm 異養微型鞭毛蟲和>10~20 μm 異養微型鞭毛蟲的密度明顯低于中肋骨條藻和紅色哈卡藻添加組(圖5),這可能也與該粒徑范圍的異養微型鞭毛蟲攝食球形棕囊藻游離單細胞,從而遭受毒害作用有關。
2.6.2 紅色哈卡藻對微食物網的影響 磷限制水體中,實驗赤潮藻類的生長主要受磷酸鹽濃度的影響(圖1、2)。與其他兩種藻類類似,紅色哈卡藻增殖過程中(前5天),水體中的磷酸鹽濃度也迅速減少,但減少的幅度小于球形棕囊藻和中肋骨條藻添加組(圖2),這可能與紅色哈卡藻的營養方式有關。紅色哈卡藻不僅可以進行光合自養,也可進行吞噬異養,特別是在貧營養條件下,紅色哈卡藻通過捕食補充生長所需營養物質[34-35]。實驗還發現紅色哈卡藻衰亡后,水體中的磷酸鹽并沒有像中肋骨條藻添加組一樣重新釋放到水體中,而是持續降低(圖2)。就粒徑大小而言,微型鞭毛蟲遠小于紅色哈卡藻,紅色哈卡藻可能捕食微型鞭毛蟲,而異養微型鞭毛蟲不可能捕食紅色哈卡藻。但我們卻在實驗過程中觀察到成群的異養微型鞭毛蟲在攻擊啃食正在游動的紅色哈卡藻細胞。前人研究也發現確實有些微型鞭毛蟲可以“圍捕”紅色哈卡藻,而且異養微型鞭毛蟲對紅色哈卡藻的攝食遠大于對異養細菌和聚球藻的攝食[36]。這或者可以解釋為何紅色哈卡藻添加組異養微型鞭毛蟲的密度顯著高于中肋骨條藻和球形棕囊藻添加組(圖4、5),但“圍捕”紅色哈卡藻的異養微型鞭毛蟲的種類及其生理生態學特征還有待進一步研究。異養微型鞭毛蟲對紅色哈卡藻的啃食加快了紅色哈卡藻的分解,釋放的營養鹽(主要是磷酸鹽)促進了含色素體微型鞭毛蟲的生長(圖4、5)。異養微型鞭毛蟲和含色素體微型鞭毛蟲密度的顯著增加意味著纖毛蟲可利用的食物增加,從而使得紅色哈卡藻添加組纖毛蟲的密度顯著高于中肋骨條藻和球形棕囊藻添加組(圖7)。
2.6.3 中肋骨條藻對微食物網的影響 中肋骨條藻添加組營養鹽的變化與紅色哈卡藻和球形棕囊藻添加組不同,伴隨著中肋骨條藻的快速增殖,水體中營養鹽,特別是磷酸鹽濃度迅速降低,在磷酸鹽消耗殆盡后,中肋骨條藻迅速衰亡,營養鹽也隨之被重新釋放到水體中(圖1、2)。這表明微食物網,特別是微食物網中的異養細菌在中肋骨條藻衰亡藻體的分解和營養鹽的再生過程中發揮重要作用。結果也確實表明,中肋骨條藻添加組的細菌密度要高于紅色哈卡藻和球形棕囊藻添加組(圖3)。然而,中肋骨條藻添加組中細菌的主要捕食者2~5 μm 異養微型鞭毛蟲的密度卻顯著低于紅色哈卡藻添加組,而與球形棕囊藻添加組無顯著差異(圖5)。而且雖然中肋骨條藻衰亡后,營養鹽的釋放使得該組磷酸鹽的濃度在實驗后期高于其他兩組(圖2),但除纖毛蟲、2~5μm 異養微型鞭毛蟲和>10~20 μm 異養微型鞭毛蟲外,其他微型鞭毛蟲類群,特別是含色素體微型鞭毛蟲的密度也處于球形棕囊藻和紅色哈卡藻添加組之間(圖5),其中一個可能的解釋是由于纖毛蟲和>10~20 μm 異養微型鞭毛蟲對<10 μm微型鞭毛蟲的攝食一方面釋放了異養微型鞭毛蟲對細菌的攝食壓力,從而促進了細菌的生長并進一步促進了細菌對中肋骨條藻的分解;另外一方面,不只是浮游細菌分解硅藻細胞釋放營養鹽,捕食者的攝食與代謝在營養鹽再生中也發揮著非常重要的作用,而且這些捕食者對含色素體微型鞭毛蟲的攝食也可能減少了含色素體微型鞭毛蟲類群對營養鹽的利用,從而導致水體中營養鹽,特別是磷酸鹽濃度的迅速恢復(圖2)。
3 結論
由于不同藻類的生理生態特征不同,其對微食物網各主要類群的影響也不盡相同。球形棕囊藻游離單細胞由于個體微小,又適應低營養環境,其對微食物網的影響主要是與微食物網中的含色素體微型鞭毛蟲競爭營養鹽,其次,球形棕囊藻還能分泌有毒有害物質,抵御纖毛蟲等原生動物的捕食。紅色哈卡藻比較特殊,可被某些異養微型鞭毛蟲類群攝食,從而提高微型鞭毛蟲及纖毛蟲的密度。與其他兩種藻類相比,中肋骨條藻對微食物網主要類群的影響更容易受到水體中營養鹽的調節。

