循環腫瘤細胞聯合超聲造影預測乳腺癌新輔助化療療效
馬士輝,凌飛海,許宇光,郭子柏,桂安萍,陳 怡
(1. 廣東省中山市人民醫院乳腺中心,廣東 中山 528403;2. 廣東省中山市人民醫院超聲影像科,廣東 中山 528403)
乳腺癌是臨床中常見的惡性腫瘤,發病率有逐年升高的趨勢[1]。新輔助化療作為一種全身治療手段,在乳腺癌的綜合治療中占據著越來越重要的地位,臨床上常用乳腺彩超、鉬靶、核磁共振成像(magnetic resonance imaging,MRI)等輔助檢查評估新輔助化療是否有效,這些影像學檢查往往不能及時、早期的反應新輔助化療的療效[2-3]。血清CA153、CA125、CEA因其靈敏性、特異性均比較低,在監測新輔助化療療效的應用中作用有限[5-7]。隨著超聲技術的不斷發展,利用超聲造影技術評估乳腺癌原發病灶在經過新輔助化療前后的血流灌注變化來預測新輔助化療的效果具有較好的可行性[8-9]。循環腫瘤細胞(circulating tumor cells,CTCs)是從原發腫瘤脫落后進入到人體血液循環的腫瘤細胞,其有助于反應患者體內腫瘤細胞的情況,并且CTCs的變化明顯早于影像學的變化。多種腫瘤患者體內都可監測到CTCs,并且CTCs的數目與患者的臨床分期、預后及腫瘤的復發轉移密切相關[10-11]。本研究聯合不同的檢測指標來綜合評價新輔助化療的療效臨床具有可行性,以期為臨床判斷新輔助療效提供更多選擇。
1 資料與方法
1.1 一般資料
選擇本院2020年1月-12月確診為臨床分期III期的乳腺癌患者80例為研究對象,女性,年齡36~68歲,平均年齡(48.9±14.3)歲,浸潤性導管癌患者44例,浸潤性小葉癌患者23例,大汗腺癌患者9例,黏液腺癌患者4例;絕經前患者43例,絕經后患者37例。納入標準:患者均經病理學證實,且有明確的可測量轉移病灶;預期生存者超過3個月;依從性好。排除標準:并發有其他惡性腫瘤患者;無法耐受化療或靶向治療患者;1個月內進行過手術患者。本研究中患者均知情同意,并經醫院倫理委員會批準。
1.2 治療方法
患者均接受4×EC(表柔比星90 mg·m-2+環磷酰胺600 mg·m-2)→4×T(多西他賽75 mg·m-2)新輔助治療(根據分子分型可聯合靶向治療)。分別在第1次、第3次和第5次化療前通過流式細胞術來進行外周血CTCs計數,并通過超聲造影測量乳腺原發腫瘤具有活性部分的大小。
1.3 CTCs計數
抽取7.5 mL研究對象外周靜脈血進行CTCs檢測,操作過程嚴格按照說明書進行CTCs計數。將抽取到的外周靜脈血轉移至15 mL錐形管中(cell research試劑盒),加入6.0 mL試劑盒配套緩沖液,充分混勻后4 000 rpm離心10 min。采用Celltracks Autoprep檢測樣本中的CTCs檢測,采用 Celltracks Analyzer II軟件判定 CTCs(CTCs為CK+ADPI+CD45-)。在患者進行第1次、第3次和第5次化療前通過流式細胞術來進行外周血CTCs計數。
1.4 超聲造影儀器與方法
采用GE Logic 9超聲診斷儀,線陣探頭頻率9.0 MHz,造影劑采用聲諾維(意大利Bracco公司)。識別目標病變后,把探頭置于穩定位置,把成像模式切換到低機械指數的特定造影成像模式,實施雙幅顯像,機械指數設置(0.06~0.08),獲得足夠的組織抑制并保持足夠的深度穿透力。聲諾維25 mg與0.9%氯化鈉注射液5 mL配置成混懸液,造影劑以團注的方式進行注射并用5~10 mL生理鹽水沖洗。造影劑注射開始錄像,觀察病灶內微泡造影劑的走形及分布,動態采集圖像2 min,圖像存盤待脫機分析。
1.5 敏感度和特異度
敏感度=真陽性數/(真陽性數+假陰性數)×100%,用于判斷有病而被正確診斷的百分比;特異度=真陰性數/(真陰性數+假陽性數)×100%,用于判斷無病而被診斷無病的百分比。
1.6 統計學方法
采用SPSS 19.0 進行數據分析。計數資料采用χ2檢驗,計量資料采用t檢驗。以P<0.05 表示差異具有統計學意義。
2 結果
2.1 化療對乳腺癌患者CTCs的影響分析
在第1次、第3次和第5次化療前,患者的CTCs陽性率分別為62.50%(50/80)、55.00%(44/80)和38.75%(31/80),第5次化療前的CTCs陽性率遠低于第1次、第3次化療前(P<0.05)。
2.2 化療對乳腺癌患者CA153、CA125和CEA的影響比較
與第1次前相比,第3次化療前CA153、CA125和CEA水平無明顯變化(P>0.05),而第5次化療前上述指標明顯降低(P<0.01),見表1。
表1 化療對乳腺癌患者CA153、CA125和CEA的影響比較(±s,n= 80)

表1 化療對乳腺癌患者CA153、CA125和CEA的影響比較(±s,n= 80)
注:與第1次化療前比較,## P<0.01
時間 CA153/(U·mL-1)CEA/(ng·mL-1)第1次化療前 47.65±6.93 201.31±23.25 95.62±16.48第3次化療前 45.63±6.64 194.57±21.98 90.87±15.59第5次化療前 41.23±4.36## 96.89±16.45##64.36±12.43##CA125/(U·mL-1)
2.3 臨床病理因素與CTCs的關系分析
研究發現,ER和PR等病理狀態與CTCs陽性率無相關性(P>0.05),Her2和Ki67等病理狀態與CTCs陽性率密切相關(P<0.01),見表2。

表2 臨床病理因素與CTCs的關系分析(n= 80) 例
2.4 循環腫瘤細胞聯合超聲造影預測乳腺癌新輔助化療療效分析
研究證實,循環腫瘤細胞聯合超聲造影預測乳腺癌新輔助化療療效的敏感度、特異度和準確度明顯高于循環腫瘤細胞或超聲造影預測乳腺癌新輔助化療療效(P<0.01),見表3。
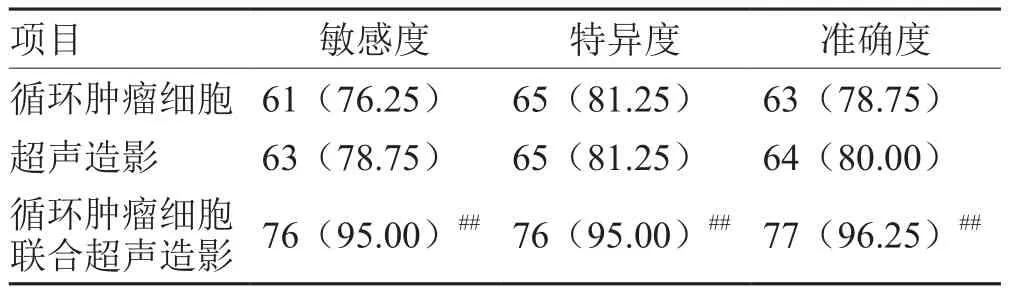
表3 循環腫瘤細胞聯合超聲造影預測乳腺癌新輔助化療療效分析(n= 80) 例(%)
3 討論
乳腺癌已成為威脅女性生活質量和生存狀態的惡性腫瘤之一,其發病率有逐年升高的趨勢。新輔助化療對中期乳腺癌患者后續接受手術和放療等治療措施十分關鍵[12-13]。因此,目前多項研究都在尋找合適的適用于臨床的腫瘤標志物來幫助乳腺癌的早期診斷、預后判斷及指導乳腺癌的個體化治療。在新近研究熱點中,某些腫瘤標志物例如循環腫瘤細胞(CTCs)和循環腫瘤DNA(ctDNA)得到了學者廣泛重視。在乳腺癌、結直腸癌、前列腺癌等轉移的預測價值上,CTCs計數水平越高提示術后局部復發或遠處轉移的風險越高[14-16]。乳腺癌患者出現遠處轉移的前提是外周血液中出現CTCs,CTCs的檢測對乳腺癌的早期診斷、監測療效及預后判斷都具有重要意義。本研究證實,在第1次、第3次和第5次化療前,患者的CTCs陽性率差異顯著,且循環腫瘤細胞聯合超聲造影預測乳腺癌新輔助化療療效的敏感度、特異度和準確度明顯高于循環腫瘤細胞或超聲造影預測效果,表明循環腫瘤細胞聯合超聲造影對預測乳腺癌新輔助化療療效具有重要參考價值。
外周血中CTCs計數與乳腺癌患者的臨床分期、分子分型及預后是否相關,目前不同的試驗得出的結果不一致,有試驗結果提示CTCs計數與乳腺癌患者臨床病例特征及預后相關,但也有資料顯示CTCs的檢出與腫塊大小、淋巴結狀態及激素受體情況均無明顯相關性。動態監測晚期乳腺癌患者的CTCs變化,具有實時指導治療的價值。血清腫瘤標志物,如血清CA153、CA125、CEA因其靈敏性、特異性均比較低,在監測新輔助化療療效的應用中作用有限[17-19]。本研究證實,與第1次前相比,第3次化療前CA153、CA125和CEA水平無明顯變化,至第5次化療前上述指標才明顯降低,而在第1次、第3次和第5次化療前,患者的CTCs陽性率差異顯著,提示在預測新輔助化療效果時CTCs較腫瘤標志物CA153、CA125和CEA更有效。
在乳腺癌早期CTCs就可能進入血液進而發生其他部位的播散轉移,是乳腺癌患者的獨立預后因素。鑒于CTCs在腫瘤研究中的重要作用,2007年,ASCO建議將CTCs作為一種新的腫瘤標志物,因而成為當前研究的熱點。循環腫瘤細胞與腫瘤的分期、預后有一定的關系,但是因為循環腫瘤細胞在外周靜脈血液中很稀少,陽性率不高,依靠單一的循環腫瘤細胞計數來判斷新輔助化療的療效可能準確性有限。超聲造影在臨床中更多的是應用在判斷腫瘤良惡性方面。彩色多普勒超聲在乳腺腫瘤中的應用具有重要作用。超聲造影因為可以反映腫瘤活性病灶大小,在判斷新輔助化療前后病灶大小具有廣闊的應用前景。超聲造影在顯示病灶血流灌注強度上優于二維超聲,可直接反映微循環下腫瘤的大小、形態,對腫瘤內部的液化壞死區較敏感,通過判斷是否存在充盈缺損以及充盈缺損的面積,可評估化療效果或指導臨床制定治療方案[20-22]。本研究證實,循環腫瘤細胞聯合超聲造影預測乳腺癌新輔助化療療效的敏感度、特異度和準確度分別為95.0%、95.0%和96.3%,明顯高于循環腫瘤細胞或超聲造影預測乳腺癌新輔助化療療效。
綜上所述,循環腫瘤細胞聯合超聲造影對預測乳腺癌新輔助化療療效具有重要參考價值。在以后的工作中,我們將進一步增大納入的樣本量,探討循環腫瘤細胞聯合超聲造影對預測乳腺癌新輔助化療療效的價值,以期為臨床制定乳腺癌治療方案提供依據。

