芳炔前體參與的芳烴1,2,3-三官能化反應*
韋海龍,劉雪梅,王滿學,黃 劍
(西安石油大學化學化工學院,陜西 西安 710065)
芳炔化學至今已有近百年的發展史。早期的研究中芳炔的的生成條件比較苛刻,在反應中官能團的兼容性較差,在合成化學中未能得到廣泛應用。最近二十年來由于條件溫和的生成芳炔的反應的發現,芳炔參與的新型反應得以迅速發展[1-6]。因其可高效地實現芳烴鄰位雙官能化,近年來芳炔化學引起了越來越多的合成化學家的研究興趣。從現有的報道來看,簡單芳炔的反應大多局限于芳烴的鄰位雙官能化,利用芳炔反應在芳環上一次性引入三個及以上的官能團的化學轉換鮮有報道[7-8]。
1 芳烴的1,2,3-功能化反應及其化合物的合成應用
早在20世紀80年代,Hart小組就采用2,6-二鹵代碘苯為原料,在芳基格氏試劑的作用下,首先在中間的碘上發生金屬鹵素交換生成一個新的2,6-二鹵代格氏試劑,然后該格氏試劑通過脫去鹵化鎂生成1,2-芳炔繼續與格氏試劑發生親核反應,然后得到2,3-芳炔中間體,繼續與格氏試劑發生親核反應,生成2,6-二取代芳基格氏試劑,再與親電試劑反應生成1,2,3-三取代芳烴[9]。由于反應中使用了格氏試劑作為芳炔活化條件,反應條件苛刻,冠能團兼容性不好,反應局限于與格氏試劑的反應,如圖1所示。
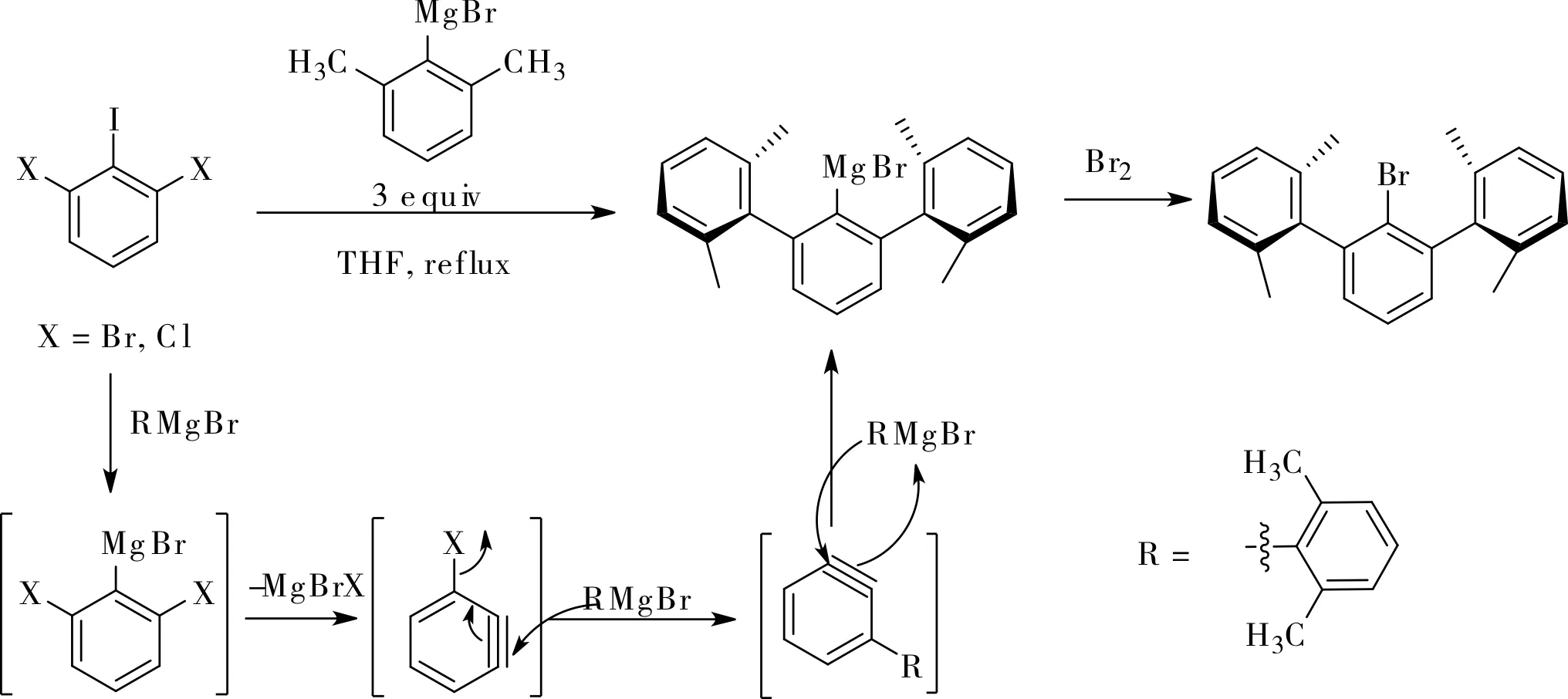
圖1 格氏試劑參與的1,2,3-三取代芳烴的合成Fig.1 Grignard reagent participated synthesis of 1,2,3-trisubstituted arene
近年來,Li小組在利用芳炔前體合成多取代芳烴方面做了大量工作。2015年,他們報道了一個新穎的利用芳炔前體TPBT與硫代酰胺合成2,4-二取代苯并噻唑的多米諾反應[10],如圖2所示。與傳統的芳炔前體只有鄰位兩個反應位點不同,TPBT在反應中可提供三個反應位點,生成三個新的化學鍵。他們認為,反應中生成的3-三氟甲磺酸基苯炔中間體A與硫代酰胺發生硫親核加成,生成的2,3-芳炔中間體B再與氮親核試劑發生環化反應生成兩可離子中間體C。最終的產物取決于中間體C的羰基是否具有α-H,羰基沒有α-H時將發生分子內羰基遷移生成2,4-二取代苯并噻唑,羰基具有α-H時將發生1,5-氫遷移生成2-取代苯并噻唑,如圖3所示。
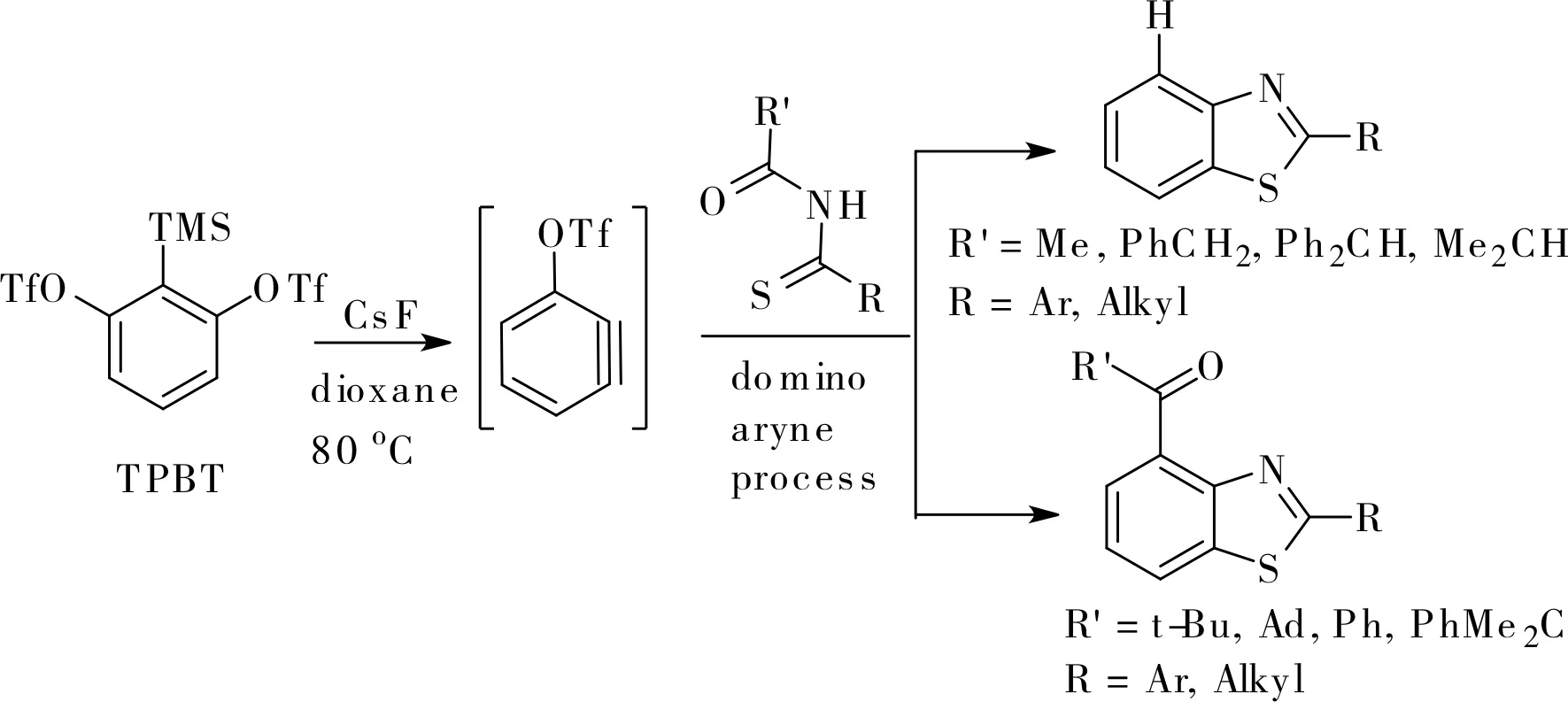
圖2 高效構建2,4-二取代苯并噻唑Fig.2 Efficient construction of 2,4-disubstituted benzothiazoles
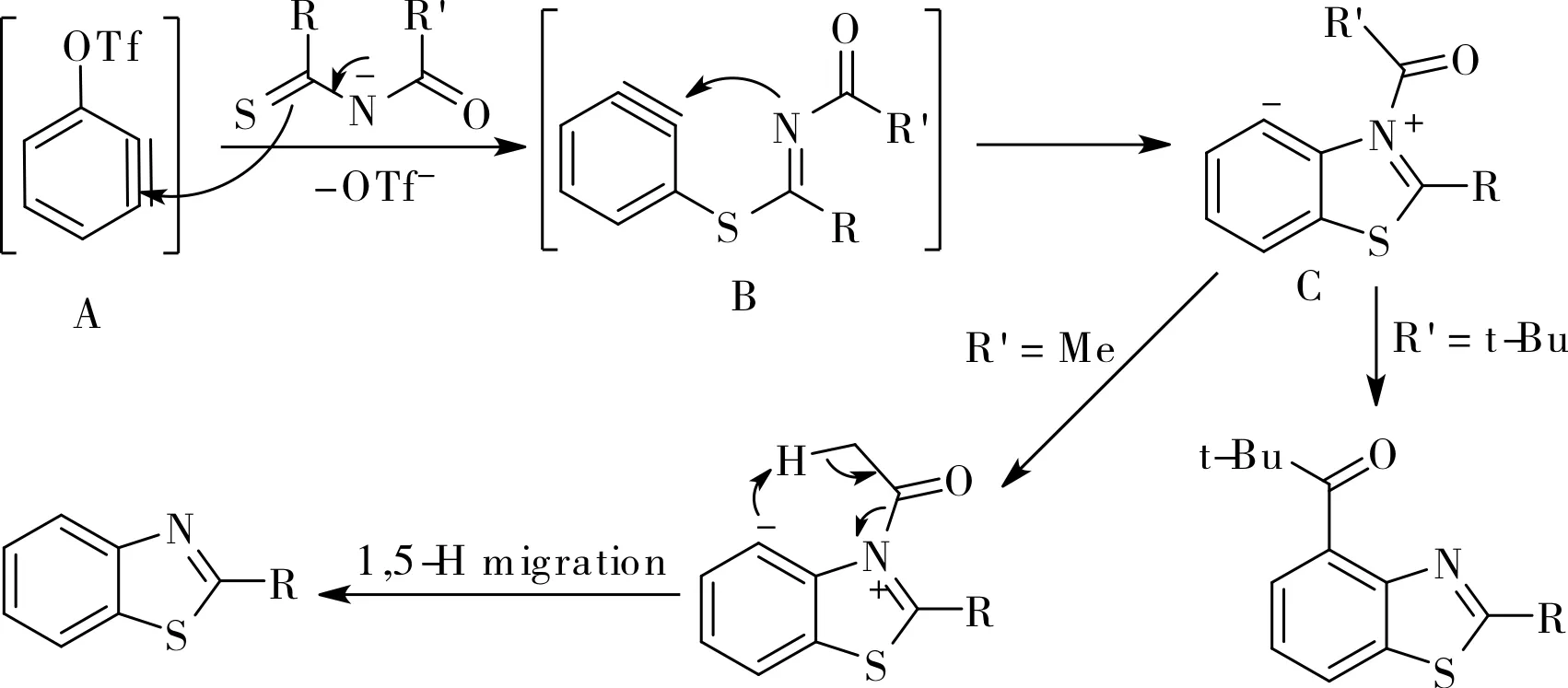
圖3 建議的機理Fig.3 Proposed mechanism
值得一提的是得到的產物2,4-二取代苯并噻唑可以容易地轉化為相應的羧酸、酰胺和腈類衍生物,如圖4所示。這些衍生物的骨架廣泛存在于一系列具有生物活性的化合物中,表明該方法在結構多樣化方面是多功能的。
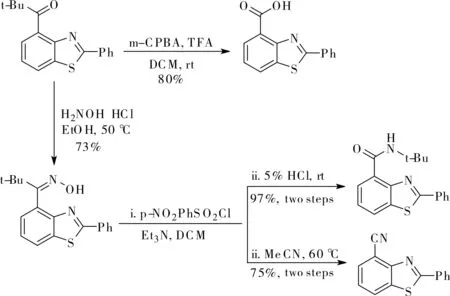
圖4 合成上的應用Fig.4 Synthetic applications
隨后,Li小組利用多米諾芳炔前體TPBT和磺酰胺合成了三取代的1,3-二氨基苯類化合物[11]。非常有趣的是,在100 ℃下采用甲苯作溶劑、碳酸鉀作芳炔活化試劑時產物為三取代的1,3-二氨基苯;改變反應條件,在室溫下采用乙腈作溶劑、氟化銫作芳炔活化試劑時,產物則變成1,3-二氨基苯,如圖5所示。
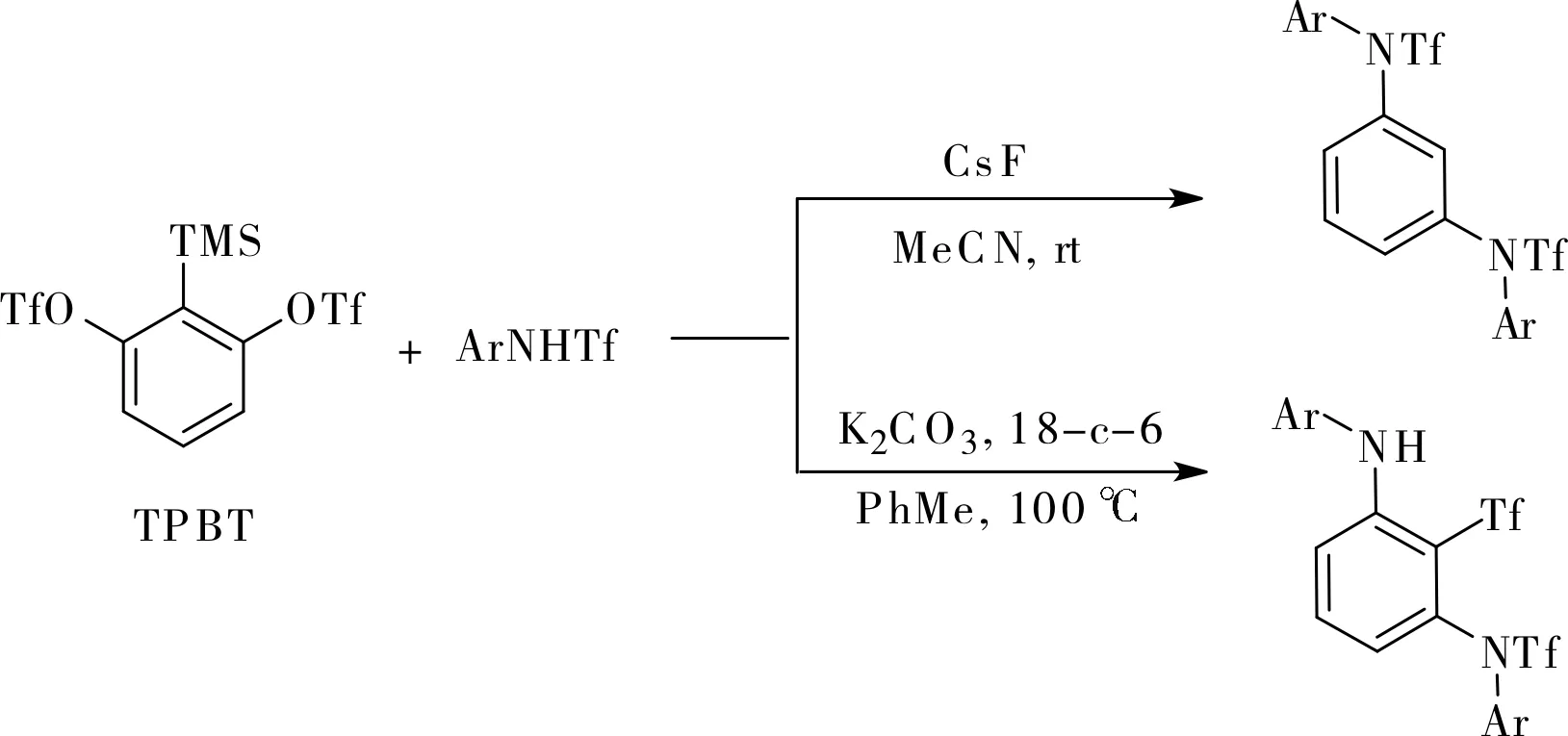
圖5 1,3-二氨基苯的合成Fig.5 Synthesis of 1, 3-diaminobenzens
2016年,Li小組報道了一個利用芳基烯丙基亞砜實現的芳炔的1,2,3-三官能化反應[12],如圖6所示。他們通過實驗推斷,反應中原位生成的苯炔先與亞砜發生[2+2]環加成,環加成產物A上的烯丙基從硫原子遷移到氧原子上生成兩可離子中間體B,然后發生氧鎓離子Claisen重排生成中間體C,最后開環氧原子烷基化生成最終產物(圖6)。產物1,2,3-三取代芳烴可以在適當的條件下很容易轉化為其它類型的化合物。例如,氧原子上的烷基可在BBr3的 作用下脫除,生成的酚羥基與鄰位的烯丙基很容易發生碘環化反應然后在強堿作用下脫除HI生成苯并呋喃,如圖7a所示;分子中的硫醚可被氧化為砜,然后在Ni的催化下與格氏試劑發生偶聯反應,如圖7b所示。
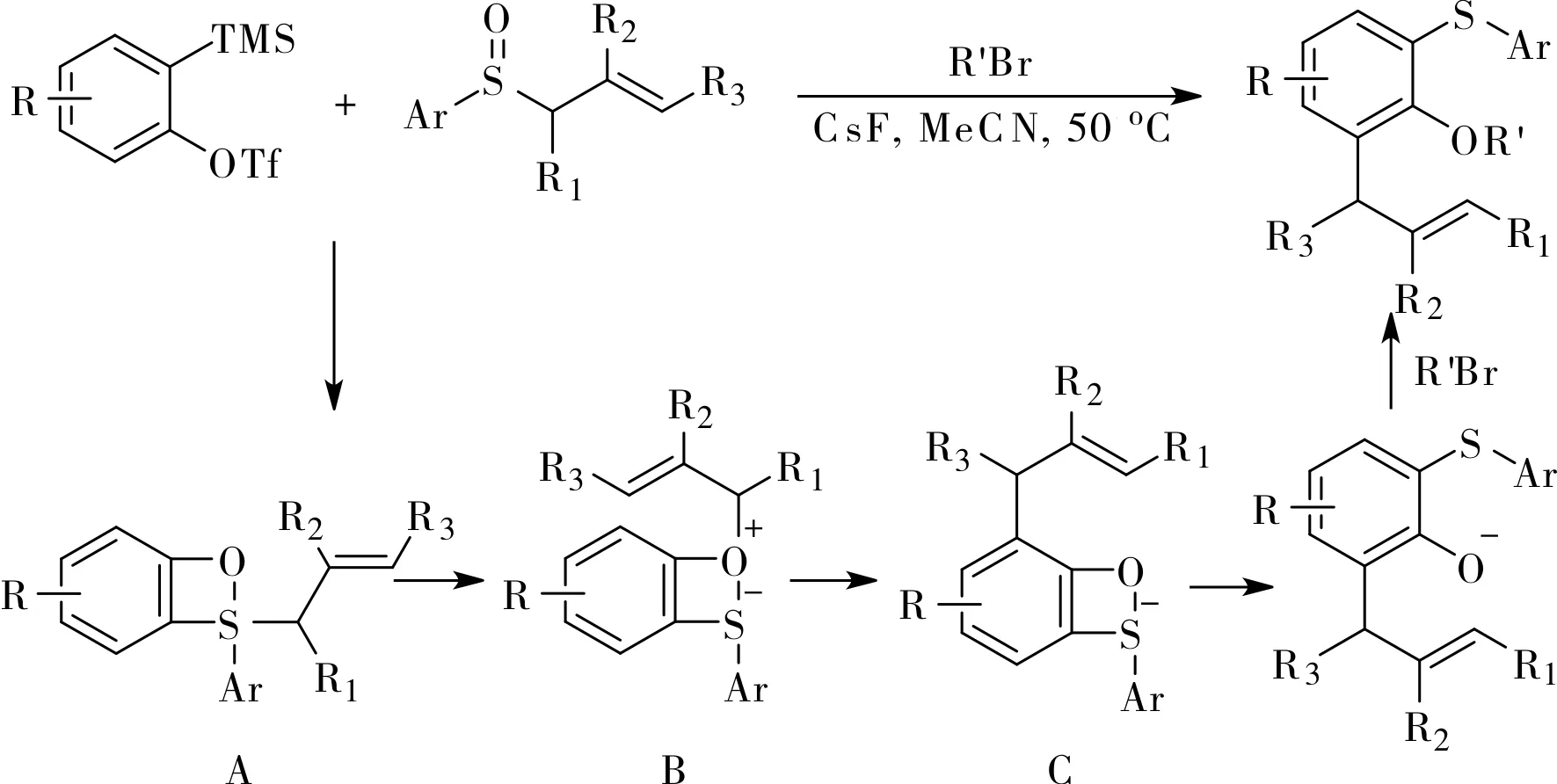
圖6 利用芳基烯丙基亞砜實現芳炔的三官能化Fig.6 Aryne trifunctionalization with aryl allyl sulfoxides

圖7 產物的修飾Fig.7 Elaboration of the products
在后來的研究中,Li小組采用3-三氟甲磺酸基芳炔的[2+2]環加成產物作芳炔前體,通過Grob碎裂化的方式,生成的2,3-芳炔中間體發生不同類型的反應,成功獲得了采用其它方法較難獲得的多取代苯化合物[13],如圖8所示。利用該方法可以快捷地合成消炎鎮痛藥非諾洛芬(Fenoprofen)和卡洛芬(Carprofen),如圖9a所示,他們還將這一方法進一步應用到抗癌新藥Niraparib的高效合成中,如圖9b所示。
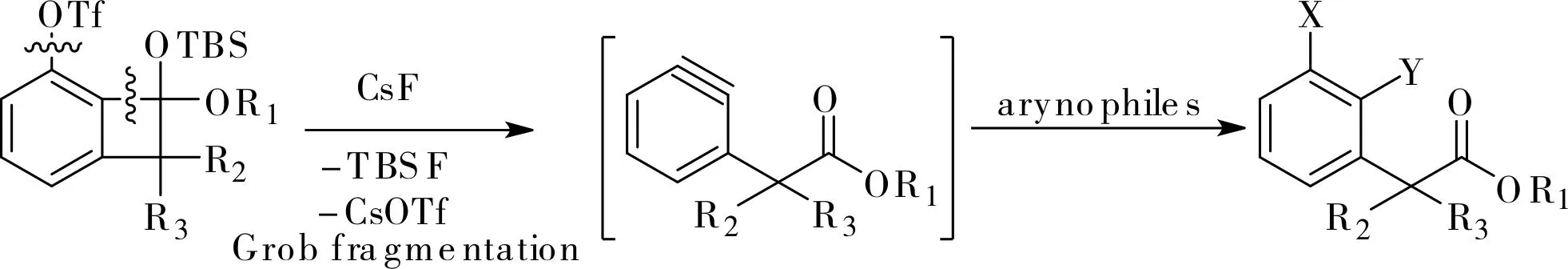
圖8 利用3-三氟甲磺酸基芳炔的[2+2]環加 成產物的Grob碎裂化選擇性的生成芳炔Fig.8 Selective Aryne formation via Grob fragmentation from the [2+2]cycloadducts of 3-Triflyloxyarynes
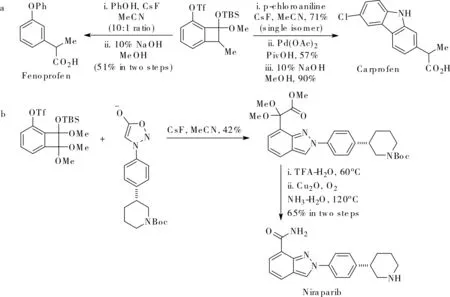
圖9 合成修飾Fig.9 Synthetic elaboration
Hosoya小組也報道了一個利用3-三氟甲磺酸基芳炔的[2+2]環加成產物作芳炔前體合成多取代苯化合物的多米諾反應[14]。該反應在親芳基試劑存在下利用有機鋰試劑打開苯并環丁酮的四元環,產物為α-芳基酮。機理研究表明,反應中經歷了羰基加成產物的C-C鍵斷裂并伴隨三氟甲磺酸根的離去,生成了2,3-芳炔中間體,如圖10所示。
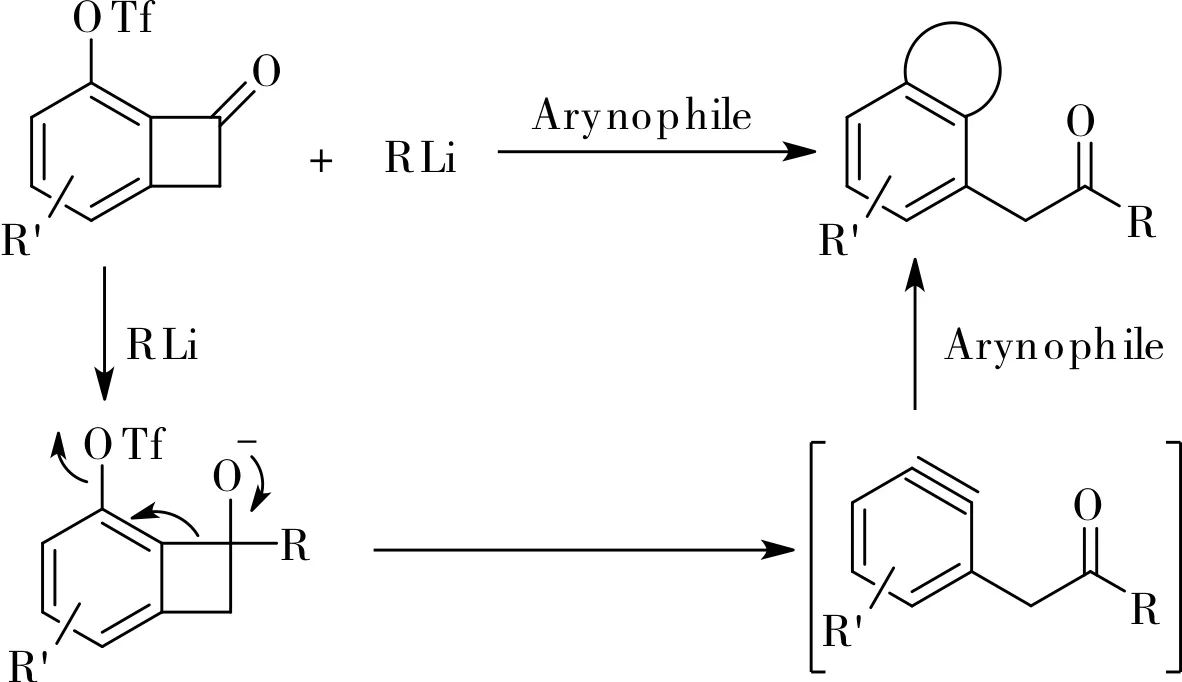
圖10 三氟甲磺酸基取代的苯并環丁酮、 有機鋰試劑和親芳基試劑的三組分偶聯反應Fig.10 Three-component coupling of triflyloxy-substitutedbenzocyclobutenones, organolithium reagents, and arynophiles
受到Li和Hosoya兩個小組工作的啟發,Wu小組和Sha小組合作報道了一個利用芳炔前體合成多取代色烷化合物的多米諾反應[15]。他們在色烷分子內引入三氟甲磺酸基和苯并環己酮結構單元,在苯基鋰的作用下四元環打開并伴隨三氟甲磺酸根的離去,生成的6,7-色烷型芳炔中間體與2,5-二甲基呋喃發生Diels-Alder反應,產物為三取代色烷,如圖11所示。
2019年,Li小組在前期工作的基礎上,將苯乙烯結構作為2,3-芳炔的反應端,利用1,2-苯二炔的親核,Diels-Alder環加成串聯得到了具有[6,n,6,6]和[6,5,6,6,6]骨架結構的苯并稠環結構[16],如圖12所示。他們還將這一方法用于麥角堿骨架的合成,如圖13所示。含氮雜環產物經吡啶的氮甲基化和硼氫化鈉還原一鍋法兩步操作,再脫除對甲苯磺酸基并氧化脫氫便得到麥角堿骨架,該路線簡潔高效。
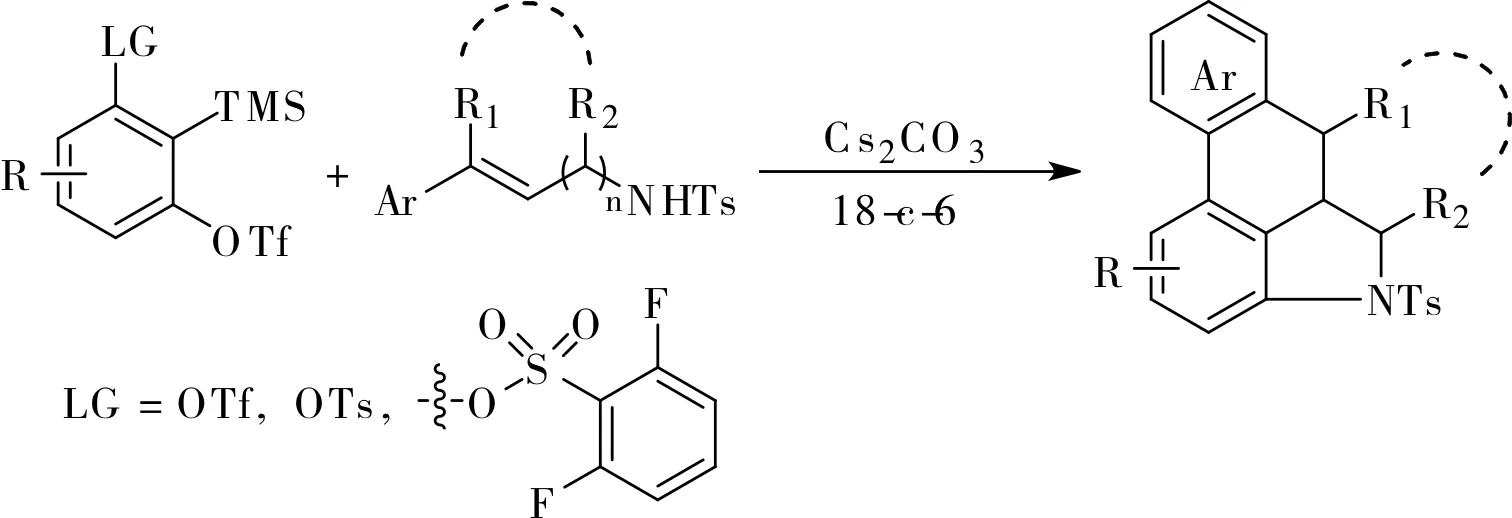
圖12 通過芳炔的親核反應與Diels-Alder 串聯實現芳環的三官能化Fig.12 Arene trifunctionalization through aryne nucleophilic, Diels-Alder cascade
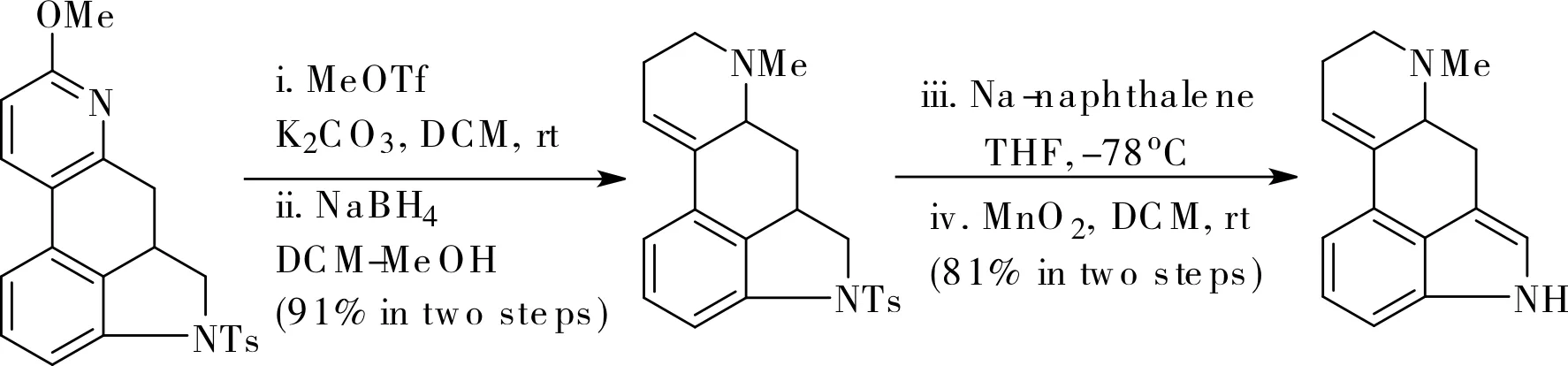
圖13 麥角堿骨架的合成Fig.13 Synthesis of ergot alkaloid skeleton
Hoye小組將1,3-二炔作為2,3-芳炔的反應端,利用1,2-苯二炔的親核,六脫氫Diels-Alder(HDDA)環加成串聯反應得到了萘炔,再與分子鏈末端的親芳基試劑發生加成反應最終得到含有萘結構單元的稠環體系[17],如圖14所示,該方法可用于克級規模的制備。如果在磺酰胺的分子鏈中增加一個1,3-二炔單元,在第一次六脫氫Diels-Alder環加成后,生成的萘炔將與另一個1,3-二炔單元再發生一次六脫氫Diels-Alder環加成,生成的蒽炔與分子鏈末端的親芳基試劑發生加成反應,最終得到具有蒽結構單元的更大的稠環體系,如圖15所示。
最近,Li小組在前期工作的基礎上,進一步發展了利用3-硅基苯炔快速合成多取代芳烴的策略[18],他們在篩選3-硅基取代芳炔前體時發現,當含硅基團是三甲基硅(TMS)、三乙基硅(TES)、 三正丁基硅(n-Bu3Si)及三丙基硅(TPS)時,得到的唯一產物是去硅基化產物1,2,3-取代產物;而當使用二甲基叔丁基硅(TBS)或三異丙基硅(TIPS)時,得到1,2,3,5-四取代產物,如圖16所示。后一種情況包含了苯炔對亞砜硫氧雙鍵的插入、陰離子[3,6]-重排及苯環上的1,3-硅遷移過程。

圖14 利用1,3-二炔和1,2-苯二炔等效物合成萘Fig.14 Synthesis of naphthalene from 1,3-diynes and 1,2-benzdiyne equivalents
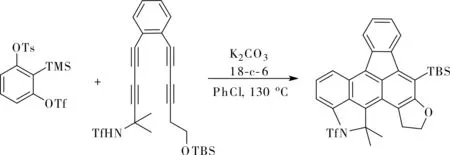
圖15 合成更大的稠環芳烴Fig.15 Synthesis of larger polycyclic arenes
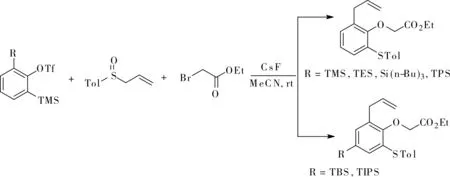
圖16 3-硅基芳炔的1,2,3-三官能化和1,2,3,5-四官能化Fig.16 3-silylaryne 1,2,3-trifunctionalization and 1,2,3,5-tetrasubstitution
2 結 語
多取代苯環結構廣泛存在于具有生物活性的天然產物、藥物分子及有機功能材料結構中。如何高效快捷精準地構建特定組合的多取代芳烴在合成化學領域中具有重要的研究意義。雖然利用苯炔中間體可快速合成各種二取代芳烴,但傳統苯炔反應的瓶頸是無法同時在苯炔環上其它位點官能化,不能發揮其在制備多取代芳環結構中的作用。突破傳統苯炔二取代反應的局限性,發展苯炔多位點官能化方法,通過1,2-苯二炔及簡單芳炔參與的串聯過程兩條途徑,實現芳炔的多官能化轉化,簡單快捷地合成多種天然產物和藥物分子,必將引起越來越多的合成化學家的研究興趣。

