12歲女孩反復腹痛、嘔吐伴三酰甘油升高、抗核抗體陽性
方優紅 林海華 樓金玕 陳潔
(浙江大學醫學院附屬兒童醫院消化內科/國家兒童健康與疾病臨床醫學研究中心,浙江杭州 310052)
1 病例介紹
(1)病史:患兒,女,12歲2個月,因反復腹痛、嘔吐2年余,關節痛3個月就診。2年余前患兒無明顯誘因出現上腹痛,伴嘔吐、發熱,無腹瀉,無皮疹等。查血常規示白細胞計數14.89×109/L(參考值:4×109/L~12×109/L),中性粒細胞百分比85.4%(參考值:50.0%~75.0%);血淀粉酶385 U/L(參考值:28~100 U/L);超敏C反應蛋白正常。腹部超聲提示胰尾部增粗,考慮“急性胰腺炎”收入院。入院后查血淀粉酶217.9 U/L,血脂肪酶101.2 U/L(參考值:13~60 U/L),空腹三酰甘油3.49 mmol/L(參考值:<1.7 mmol/L),病程中曾有一過性升高至18.9 mmol/L。予對癥支持治療后,腹痛、嘔吐癥狀好轉出院。出院后反復因腹痛、嘔吐住院4次,診斷為復發性急性胰腺炎,其中3次在我院住院。每次發作均予抗感染、靜脈補液、經鼻胃管腸內營養,逐漸過度至低脂飲食,同時予奧美拉唑抑酸,生長抑素抑酶對癥治療后癥狀好轉。3個月前患兒出現四肢關節疼痛伴活動障礙,患兒雙側踝關節、膝關節、雙手指關節出現疼痛伴活動障礙,手指指尖皮膚呈紫紅色伴脫屑,伴雙下肢見大量紅色皮疹,壓之不褪色。為求進一步診治,收入院。
(2)體格檢查:體溫38.2℃,脈搏154次/min,呼吸24次/min,血壓130/80 mm Hg,神志清楚,皮膚、鞏膜無黃染,呼吸音清,心律齊,未聞及雜音,腹軟,無壓痛及反跳痛,肝脾不大,腎區無叩痛,四肢腫脹伴壓痛,手指關節、雙膝關節及踝關節活動障礙,手背及雙下肢見大量紅色皮疹,不高出皮面,壓之不褪色,手指尖皮膚呈紫紅色,伴脫屑,神經系統無陽性體征。
(3)輔助檢查:4次急性胰腺炎發作在我院住院的相關實驗室檢查見表1。每次胰腺炎發作均伴血淀粉酶及血脂肪酶升高,超敏C反應蛋白有一過性升高,反復多次血清三酰甘油升高。胰腺炎好轉、低脂飲食后三酰甘油下降,但未降至正常范圍。第3次、第4次住院查免疫球蛋白升高,抗核抗體1∶1 000陽性,抗雙鏈DNA弱陽性。多次入院尿常規、凝血功能、肝功能、腎功能、血電解質、血糖均正常。急性胰腺炎發作期間胰腺超聲、腹部平掃+增強CT、磁共振胰膽管成像提示急性胰腺炎表現,未提示胰膽管結石及胰腺畸形(圖1)。胰腺炎緩解期間,胰腺影像學檢查正常。此次血常規示血紅蛋白49 g/L(參考值:110~155 g/L);超敏C反應蛋白13.34 mg/L(參考值:0~8 mg/L);紅細胞沉降率24 mm/h(參考值:0~20 mm/h);尿常規示潛血4+,尿蛋白3+,尿紅細胞564個/HP(參考值:0~3/HP),尿白細胞102個/HP(參考值:0~3/HP);24 h尿蛋白定量2 822.4 mg/24 h(參考值:<150 mg/24 h),尿微量蛋白449.18 mg/L(參考值:<100 mg/L);血清白蛋白23 g/L(參考值:32~52 g/L),肌酐95μmol/L(參考值:15~77μmol/L),尿素氮12.81 mmol/L(參考值:1.79~6.43 mmol/L);抗核抗體1∶1 000,抗Sm蛋白抗體陽性,抗雙鏈DNA抗體陽性(參考值:>800 IU/mL),抗組蛋白抗體陽性。雙腎MRI示雙腎腫大;心臟超聲示肺動脈高壓(42 mm Hg);頭顱MRI示腦溝裂寬深;關節磁共振示雙膝關節積液,周圍軟組織廣泛滲出。24 h動態血壓監測示24 h平均血壓為130/78 mm Hg,最高血壓146/99 mm Hg。

表1 患兒4次急性胰腺炎發作時在我院住院的實驗室指標結果
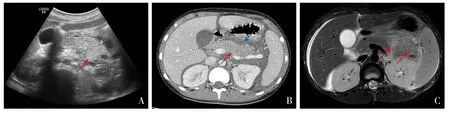
圖1 患兒急性胰腺炎發作時影像學表現 A:胰腺超聲提示胰腺尾部回聲增粗增強(箭頭所示),胰周積液;B:腹部增強CT提示胰腺體積增大(紅色箭頭所示),胰腺動脈期強化偏低周圍可見大量液體密度影(藍色箭頭所示);C:磁共振胰膽管成像提示胰腺體尾部飽滿,壓脂后局部信號增高,胰周可見片狀長T2信號(箭頭所示)。
2 診斷思路
病史特點:(1)青少年女性,反復上腹痛、嘔吐發作2年余,關節痛3個月,腹痛、嘔吐發作間期癥狀完全緩解,3個月前出現關節腫痛,血尿、蛋白尿;(2)實驗室檢查:發作時血淀粉酶、血脂肪酶升高,多次伴空腹三酰甘油明顯升高,抗核抗體陽性,后出現抗雙鏈DNA陽性,尿隱血陽性,尿蛋白陽性;(3)影像學提示胰腺腫大伴滲出,胰膽管未見結構異常及結石;(4)腹痛、嘔吐癥狀予對癥支持治療后好轉,發作間期血淀粉酶、血脂肪酶及胰腺影像學正常。
根據病史及實驗室檢查,患兒反復腹痛嘔吐發作,診斷復發性急性胰腺炎明確,需要明確有無相關發病因素,急性胰腺炎常見病因包括:酒精、吸煙、藥物、腹部外傷、胰膽管結石、膽胰系統畸形、惡性腫瘤、高脂血癥、遺傳因素、自身免疫性胰腺炎(autoimmune pancreatitis,AIP)及特發性胰腺炎。結合本例兒童的特點,從以下幾個方面考慮胰腺炎的病因:(1)膽胰系統畸形:常見的解剖畸形有Oddi括約肌功能障礙、膽胰合流異常、胰腺分裂、環形胰腺、乳頭旁憩室、十二指腸重復囊腫、消化道中段扭轉不良[1-2],本例患兒多次超聲、磁共振胰膽管成像檢查未發現以上畸形存在,因此不支持該病診斷。(2)遺傳性胰腺炎:復發性急性胰腺炎跟基因突變有關,常見的相關基因包括CFTR、SPINK1、CTRC、GPIHBP1、PRSS1、K23R基因等[3],雖然患兒無明顯家族史,可進一步行外周血胰腺炎相關基因檢測鑒別。(3)高三酰甘油相關胰腺炎:患兒胰腺炎發作期間多次發現空腹三酰甘油明顯升高,最高大于30 mmol/L,為重度高三酰甘油血癥。高脂血癥引起的胰腺炎率約占急性胰腺炎病因的10%[4],且高脂血癥容易導致重癥胰腺炎,臨床癥狀嚴重、病程較長、并發癥發生率高[5]。引起高脂血癥的病因可分為原發性與繼發性2大類。前者主要為一些隱性遺傳單基因遺傳性疾病,目前不能完全排除,需行相關基因檢查進一步鑒別。繼發性高脂血癥是指由明確的全身系統疾病引起的血脂異常。兒童常見原因包括肥胖、代謝綜合征、甲狀腺功能減低、皮質醇增多癥、糖尿病、長期應用影響脂質代謝的藥物(如糖皮質激素、抗驚厥藥)和乙醇(經常過量飲酒)等,本例患兒不存在以上引起繼發性高脂血癥的病因。患兒復發性急性胰腺炎反復發作,病因不明,需要考慮遺傳性胰腺炎,同時結合既往多次發作時空腹三酰甘油顯著升高,無引起高脂血癥的基礎疾病,考慮存在先天性高脂血癥可能。(4)AIP:是一類特殊類型的胰腺炎,常以梗阻性黃疸伴或不伴胰腺腫塊,病理組織學上以淋巴漿細胞浸潤、纖維化為表現,激素治療快速起效[6]。成人AIP分為2種亞型:1型和2型。1型AIP是最常見的類型,男性多見,又稱淋巴漿細胞浸潤性硬化性胰腺炎,也稱IgG4相關疾病的胰腺炎表現,以血清IgG4陽性伴胰腺外病變,組織病理以大量IgG4陽性漿細胞浸潤為特點。2型AIP又稱為特發性導管中心性胰腺炎,與1型不一樣,無明顯性別傾向,發病年齡較年輕,不伴血清IgG4升高,部分合并炎癥性腸病,如潰瘍性結腸炎。根據2019美國風濕病學會/歐洲抗風濕病聯盟IgG4分類標準[7],本例患兒有胰腺累及,但影像學無典型的AIP表現,不符合任何排除標準,入選標準中,符合1條,血清IgG4升高不超過正常值2倍,不符合IgG4相關性疾病診斷標準。(5)自身免疫疾病相關性胰腺炎:患兒為女性,急性胰腺炎反復發作,抗核抗體1∶1 000陽性,IgG明顯升高,最后出現四肢關節腫痛,血尿、蛋白尿,且抗雙鏈DNA抗體陽性,需要考慮系統性紅斑狼瘡(systemic lupus erythematosus,SLE)相關性胰腺炎,但胰腺炎發作一般與SLE疾病活動相關,但該患兒胰腺炎發作時無典型SLE癥狀,需進一步排除其他原因。
3 進一步檢查
為明確是否存在遺傳性胰腺炎或遺傳因素導致的高三酰甘油血癥,征得家屬同意后,抽取患兒及父母外周血各2 mL,送北京金準醫學檢驗實驗室行患兒全外顯子基因檢測及父母Sanger測序驗證,結果未發現復發性胰腺炎及高脂血癥相關致病基因。為明確腎臟疾病進行了腎臟穿刺,腎臟穿刺病理(圖2):腎小球13只,小球腫脹,細胞數增多,系膜細胞及內皮細胞增生(活動性指數=3),毛細血管腔狹窄,基底膜無明顯增厚,約5只小球見細胞性新月體形成(活動性指數=4),個別小球見壞死性病變(活動性指數=4),約3只小球與小囊輕度粘連(慢性指數=1),小管細胞輕度空泡變性,灶性輕度萎縮(慢性指數=1),間質水腫,無明顯纖維化,散在及灶性淋巴單核細胞浸潤(活動性指數=2),間質血管無殊。腎穿刺冷凍切片免疫熒光:小球6只,小球內IgG++,IgA++,IgM+,C3+++,C1q++,C4±,Fib顆粒狀沉積于毛細血管袢及系膜區,Ⅳ膠原檢測:a2和a5分布無異常。符合狼瘡性腎炎(Ⅳ型),活動性指數11/24,慢性指數2/12。腎臟穿刺電鏡檢查考慮免疫復合物介導的系膜增生性腎小球腎炎。
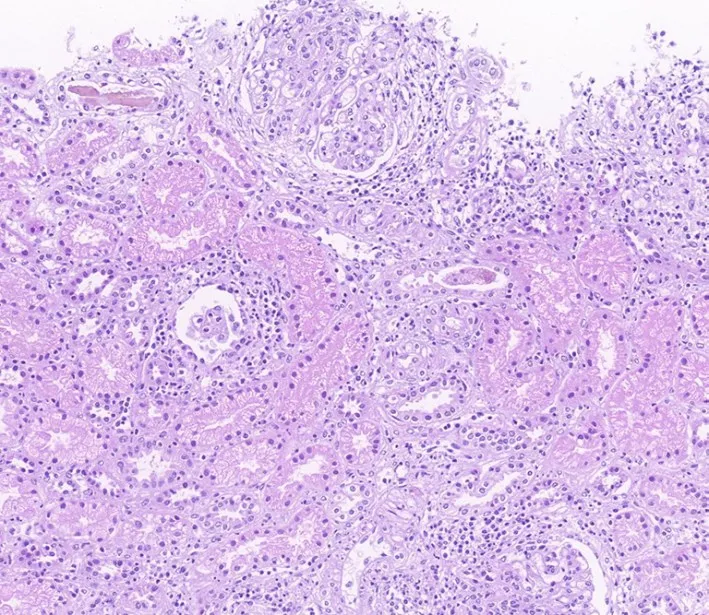
圖2 腎穿病理結果(蘇木精-伊紅染色,×200) 系膜細胞及內皮細胞增生(紅色箭頭所示),毛細血管腔狹窄,基底膜無明顯增厚,細胞性新月體形成,小球與小囊輕度粘連,小管細胞輕度空泡變性,灶性輕度萎縮(藍色箭頭所示),間質水腫,無明顯纖維化,散在及灶性淋巴單核細胞浸潤。
4 臨床經過
給予羥氯喹口服及甲潑尼龍琥珀酸鈉和環磷酰胺靜脈滴注治療,關節腫痛、活動障礙好轉。隨后改為醋酸潑尼松片口服,逐漸減量至停止。定期環磷酰胺沖擊治療,患兒關節癥狀好轉,仍有蛋白尿及血尿,繼續定期予環磷酰胺,同時加用貝利優單克隆抗體泵注治療,并繼續給予降壓、抗凝等對癥支持治療。患兒目前給予2次貝利優單克隆抗體治療,仍有血尿及蛋白尿,血壓正常,無關節痛及四肢活動障礙等。
5 診斷及診斷依據
診斷:SLE;狼瘡性腎炎(Ⅳ型);復發性急性胰腺炎。SLE診斷依據:根據2019年歐洲抗風濕病聯盟/美國風濕病學會SLE分類標準[8]:患兒符合入圍標準,抗核抗體升高,相加標準中患兒符合發熱(2分),關節受累(6分),24 h尿蛋白大于0.5 g,腎活檢示Ⅳ型狼瘡性腎炎(10分),低C3和C4(4分),SLE特異性抗體抗雙鏈DNA抗體陽性(6分),總得分大于10分,符合SLE分類標準。狼瘡性腎炎病理分型根據2003年國際腎臟病學會/腎臟病理學會的分類標準[9]符合狼瘡性腎炎Ⅳ型。復發性急性胰腺炎診斷依據:患兒反復胰腺炎發作大于2次,發作間期大于3個月,無慢性胰腺炎依據。
6 討論
SLE是一種多系統受累的自身免疫性疾病,主要累及皮膚黏膜、骨骼肌肉、腎臟及血液系統,還可以累及肺、心臟、中樞神經及消化等多個器官和系統。兒童時期發病的SLE是指18歲以下起病的SLE,平均出現癥狀的年齡為11~12歲。與成人時期發病的SLE相比,兒童SLE臨床癥狀更嚴重,狼瘡性腎炎、血液系統異常、光敏感、神經精神癥狀、皮膚黏膜癥狀的發生率更高[10]。
兒童SLE患者中消化道癥狀以非特異性表現為主,常見的表現為腹痛和納差,其他少見的表現有胰腺炎、腸道血管炎等。SLE累及胰腺并出現胰腺炎癥又稱為SLE相關性胰腺炎,是指排除其他病因,同時符合2019年歐洲抗風濕病聯盟/美國風濕病學會SLE分類標準[8],與SLE發病密切相關的胰腺組織的炎癥反應。SLE相關性胰腺炎在成人及兒童中均少見,成人SLE合并胰腺炎的發病率在0.67%~0.92%[11-12]。兒童SLE合并胰腺炎的發病率不詳,Limwattana等[13]報道兒童SLE患者中發生率為1.1%。一項多中心的研究發現,852例兒童SLE患者中共22例合并胰腺炎,其中20例為急性胰腺炎,僅2例為復發性急性胰腺炎,每例各發生2次胰腺炎[14]。
SLE相關性胰腺炎發病機制不完全明確,以急性胰腺炎為主,少數為復發性急性胰腺炎。胰腺炎多發生于SLE疾病活動期,且有明顯的多臟器受累表現。SLE相關性胰腺炎與SLE伴發機械性或中毒-代謝因素相關胰腺炎患者比較,前者SLE疾病活動度評分明顯較升高,提示SLE疾病活動與胰腺炎發生有關[15]。此外,SLE患者本身可合并代謝紊亂,如高脂血癥,高脂血癥又與胰腺炎發病密切相關。因此SLE相關性胰腺炎發生的機制可能是多因素的,包括血管炎、間質水腫、免疫復合物沉積導致的血管阻塞、藥物中毒、代謝紊亂等,胰腺組織病理主要為免疫損傷,在早期可能為血管炎[16-17]。
本例患兒在SLE典型癥狀出現前,復發性急性胰腺炎反復發作5次,通過相關檢查,并未發現復發性胰腺炎的確切病因。但發現一些病因相關的線索,血清三酰甘油明顯升高,抗核抗體陽性,進一步完善檢查后,未發現引起高脂血癥的其他因素。在胰腺炎癥狀好轉后,三酰甘油水平下降,從而考慮高脂血癥并非導致胰腺炎的直接發病原因。抗核抗體陽性,根據SLE分類標準,不符合SLE診斷標準,當時亦無其他自身免疫性疾病依據,因此對患兒復發性胰腺炎的病因仍不能做出推斷。根據文獻報告,SLE相關性胰腺炎大部分發生在SLE的早期,SLE診斷的前2年,也可以作為SLE的首發癥狀出現[18]。本例患兒胰腺炎反復發作時已有抗核抗體滴度顯著升高,在排除其他病因后,結合最后出現的典型SLE表現,需考慮復發性急性胰腺炎與SLE早期的代謝紊亂、血管炎有關。但仍存在疑點,SLE相關性胰腺炎與SLE疾病活動密切相關,該患兒胰腺炎發作時,不存在SLE活動相關表現,表2為患兒在我院歷次住院期間出現的臟器累及情況,胰腺炎發作期間無其他系統累及,可能在該例患兒中胰腺炎的發生機制不是以免疫損傷為主,而是與血管炎或代謝紊亂相關,但目前無病理依據支持,有待于日后進一步的研究。
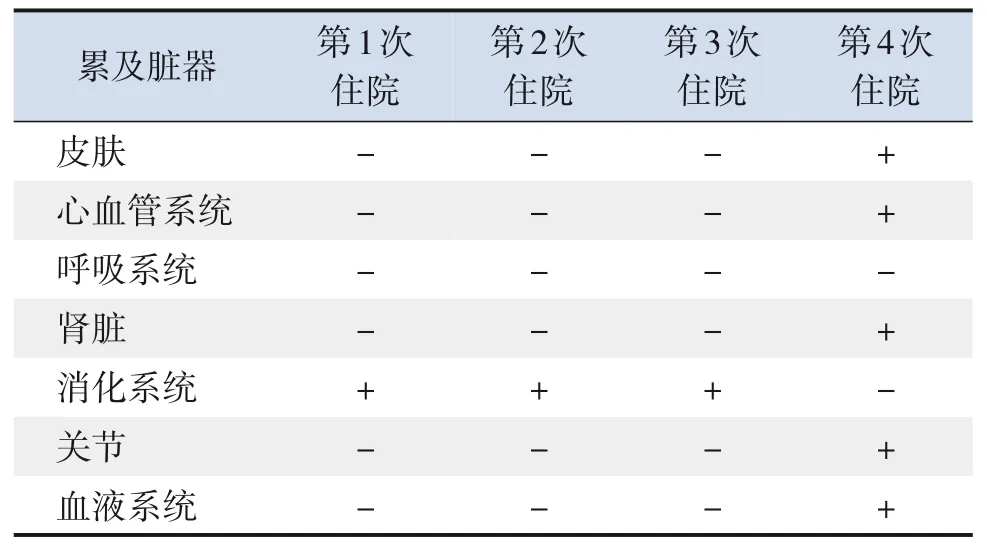
表2 患兒4次在我院住院期間累及臟器情況
本病例雖然不能完全支持復發性急性胰腺炎為SLE相關性胰腺炎,但從臨床經過、實驗室檢查推測與SLE的關系密切。本例的診治主要給我們以下啟示:(1)SLE疾病活動為復發性胰腺炎的少見病因,大部分發生在SLE診斷前,部分SLE病例可以表現為以急性胰腺炎為首發表現,甚至在SLE典型癥狀出現前發生。(2)SLE相關性胰腺炎的臨床表現無特異性,與其他原因導致的胰腺炎相似,主要為上腹痛、嘔吐等,雖然該疾病發生率低,仍需要警惕,必要時需要完善相關檢查,以免延誤診斷。(3)兒童SLE進展快,容易出現多臟器累及,如自身抗體抗核抗體升高,需密切隨訪,避免延誤SLE的診斷,對治療及預后造成影響。
7 結語
兒童SLE發病率低,臨床表現可以不典型,臨床醫生需警惕急性胰腺炎或者復發性急性胰腺炎可能為SLE的首發臨床表現,臨床醫生需要提高認識,對原因不明的胰腺炎完善相關的免疫學指標,以免延誤診斷。

